儿童先天性肺囊性腺瘤样畸形CT表现
2014-03-07侯振洲张丽丽
陈 霞 侯振洲 张丽丽
儿童先天性肺囊性腺瘤样畸形CT表现
陈 霞 侯振洲 张丽丽
先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation, CCAM)是指细支气管发育停滞,肺泡发育不全,引起的肺间质大量增生[1],发病率为1︰35000~1︰25000,是一种较少见的肺发育异常。本研究收集12例经病理证实的CCAM患者的资料,结合文献报道探讨其CT表现特点。
1 资料与方法
1.1 研究对象 2012-01~2013-06河北省儿童医院收治的经手术切除、病理证实的12例CCAM患者,其中男9例,女3例;年龄2 d~12岁,中位年龄2岁9个月。10例因不同程度的呼吸困难、咳喘或发热以肺部感染就诊;1例孕检时发现,1例体格检查时发现,就诊时均无临床症状。12例患儿均行胸部CT检查,其中1例行CT增强扫描。按照CCAM的病理组织学分型标准进行分型:大囊型病例为病理I型,小囊型病例为病理II型[2]。
1.2 仪器与方法 采用Siemens Somatom Emotion6 CT机。扫描参数:管电压110 kV,管电流35 mA,层厚6 mm,螺距1.0。增强扫描用非离子型造影剂碘海醇,剂量2.0 ml/kg,速度1.8 ml/s。
2 结果
2.1 CT特征 右肺受累10例,其中上叶5例,下叶4例,上中下叶受累1例;左肺2例,上、下叶各1例。CT表现:①9例大囊型,其中3例单发,2例表现为单发薄壁气囊肿,右肺上、下叶各1例,直径分别为12.9 cm、8.0 cm,内可见多发不规则线样分隔,其中1例囊腔内有小液平,囊肿周围肺组织未见异常密度影,2例均发现纵隔向健侧移位。另1例位于左肺下叶,患儿10 d,因呼吸喘憋就诊,胸部CT示左肺下叶椭圆形均匀密度液囊肿,大小约2.1 cm×3.7 cm×3.0 cm,边界清晰光滑,周围肺组织透光度不均匀,可见片状高透光区,纵隔向健侧移位(图1A)。经抗炎治疗,患儿30 d时胸部CT平扫示(图1B)左肺下叶不规则薄壁气囊肿,长径约4.3 cm,内可见线样分隔,纵隔向健侧移位。5例多发大小不等薄壁气囊肿,右肺4例,上、下叶各2例,1例位于左肺上叶;最大直径3.8~13.0 cm,囊腔内均未见液平;2例囊腔周围肺野见索条及小片状高密度影,均位于右肺,上、下叶各1例;4例纵隔向健侧移位。1例多发液囊肿(图2),CT平扫见右肺下叶软组织肿块,增强后呈多发薄壁含液囊肿,最大者直径约3.6 cm,壁厚约1.0 mm,囊壁及分隔明显强化,囊内成分无强化,病变下部见一始自腹腔干起始部的纤细血管影穿过膈肌进入病变组织囊壁,病变周围肺组织见小片及条索样高密度影。②3例蜂窝样改变,均位于右肺,呈多个直径为1~2 cm的小囊,囊内未见气液平,其中2例累及右肺上叶,未见与气管相通,囊肿周围肺组织未见异常密度影,纵隔无移位;1例累及右肺上中下叶伴右肺发育不良,囊肿与右肺上、下叶支气管相通,右肺体积缩小,未见正常充气肺组织,纵隔右移,鸡胸。12例均未见自发性气胸,2例单发薄壁大囊患者因胸部X线误诊为气胸行胸腔穿刺导致右侧气胸伴纵隔及颈胸部皮下气肿。未见实性型病例。
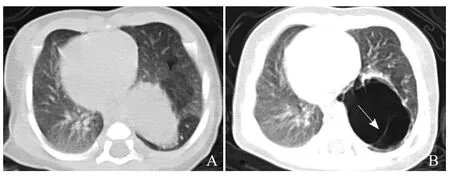
图1 男,10 d,出生后第2天出现呼吸喘憋。A.患儿10 d时胸部CT,左肺下叶含液囊肿(箭),周围肺组织片状高透光区,纵隔向健侧移位;B.经抗炎治疗20 d后,囊腔内液体吸收,呈薄壁气囊肿,内可见不规则线样分隔(箭)
2.2 手术及病理所见 术中病变肺叶体积膨胀,受累位置同CT所见。术中未记录囊腔是否与支气管相通。1例增强扫描示体动脉供血与膈肌粘连,滋养血管自粘连处通过;11例未见异常血供。大体标本呈灰白或暗紫色,切面呈单个大囊腔、大小不等的囊腔或蜂窝样结构(1例囊内见黄白色脓液),镜下见囊腔为异常增生的管腔样结构,壁内被覆纤毛柱状上皮或立方上皮,上皮下可见薄层平滑肌(图2D),未见软骨板。部分病例周围有散在的肺泡样结构,并见较多炎症细胞浸润。病理诊断:9例CCAM I型,其中3例继发感染,3例II型,其中1例继发感染。

图2 女,8岁,因咳嗽就诊。A.胸部CT平扫示右肺下叶团块状软组织密度病变;B.增强扫描示病变呈薄壁囊性,囊壁及分隔明显强化;C.多平面重组示病变下部可见始自腹腔干右旁的血管影(箭)穿过膈肌进入病变组织囊壁;D.病变呈大小不等囊腔,壁内被覆复层纤毛柱状上皮,上皮下方见少量平滑肌(HE, ×10)
3 讨论
CCAM是一种较少见的支气管-肺发育异常疾病,约占肺部先天性畸形的25%,发病率男性高于女性[3,4]。本组男性9例,女性3例;临床表现为急性或反复肺感染、进行性呼吸困难、窒息。1岁以下儿童多因呼吸困难就诊,年龄较大者则以反复感染就诊,常误诊为支气管源性肺囊肿、肺大泡[4]或支气管扩张[5]等疾病。本组2例误诊为肺大泡,2例误诊为支气管源性肺囊肿合并感染。部分患儿系胎儿期超声检查发现,就诊时无临床症状,本组1例孕检时发现右肺囊性病变,考虑囊性腺瘤样畸形。虽然胎儿产前超声检查对诊断CCAM有重要意义,但常误诊为肺隔离症、膈疝等[6,7],CT仍是重要的检查手段。孙国强等[8]认为双肺发病相等,上叶多见,可多叶受累。大多数学者则认为其多累及单侧单叶,上、下叶均可受累,以下叶多见,中叶少见,多叶或双侧累及极为罕见[9,10]。本组6例上叶受累(5例右肺,1例左肺),5例下叶受累(4例右肺,1例左肺),1例右肺上中下叶均受累,未见中叶单独受累,上、下叶受累无显著差异,右肺受累明显多于左肺。CCAM大部分为肺循环供血,亦可由体动脉供血[11]。本组1例CT平扫示右肺下叶软组织肿块,增强扫描呈多发薄壁含液囊肿,并由体动脉供血,术前误诊为肺隔离症合并感染,术中证实滋养血管穿过膈肌进入病变肺组织,术后病理证实为CCAM I型合并感染。11例经手术证实由肺动脉供血。12例均未见含气空腔破裂引起的自发性气胸,但2例单发薄壁大囊病例因胸部X线误诊为气胸行胸腔穿刺导致右侧气胸伴纵隔及颈胸部皮下气肿,表明囊腔较大时胸部X线较难鉴别单发薄壁大囊与气胸,需要CT检查协助诊断。
CCAM的CT表现主要有3种:①大囊型:表现为一个或多个大小不等的薄壁囊腔,含气和(或)液,周围可见多发含气小囊肿;②小囊型:由多个直径1~2 cm的薄壁小囊组成,类似蜂窝状改变;③实性型:表现为较致密的实性肿块。①和②中完全含液囊肿少见。本组9例大囊型,3例小囊型,无实性型病例。本组9例I型,3例II型,与文献报道I型最常见、III型最少见相一致[4,12]。本研究CT分型与病理分型一致,表明CCAM患儿组织病理学改变可以由胸部CT结果判断。9例I型病例中7例合并纵隔移位,II型病例均未见合并纵隔移位。郭徐林等[13]报道约25%的CCAM出现合并症,包括呼吸道异常、心血管系统畸形、泌尿系统异常、消化道异常和中枢神经系统异常。本组病例中未发现患儿合并其他畸形。
CCAM的临床表现无特异性,需要与支气管肺囊肿、肺隔离症、气胸、膈疝、肺脓肿、肺结核空洞相鉴别。①支气管源性肺囊肿:CCAM特别是单发大囊型合并感染时,囊腔内液体积聚,与支气管源性肺囊肿鉴别困难,但I型CCAM囊肿以外的肺实质部分有支气管梗阻的相似特征,囊肿周围常有肺气肿发生。支气管源性肺囊肿腔内容物排出气体积聚时与CCAM单发大囊型不易区别,但CCAM囊壁多不及支气管源性肺囊肿规则,壁内可有息肉样突起或周围较多小囊样结构,支气管源性肺囊肿因为不与支气管相通,不合并囊壁感染破坏腔内,不会有气体积聚。②肺隔离症:下叶CCAM发生感染囊腔内充满脓液,或肺隔离症与支气管异常沟通形成数个厚壁含气液面的囊腔时,不易与肺隔离症鉴别,CT增强发现来自体循环的异常血供可确诊,CCAM也可能由体动脉供血,即CCAM合并肺隔离症,故最后确诊需要依靠病理组织学检查。③气胸:单发大囊型CCAM胸部X线与气胸鉴别困难,可能误诊为气胸行胸腔穿刺引流,CT扫描可以清晰地显示CCAM囊壁欠规则,囊腔内线样分隔。④膈疝:囊腔形态混杂,口服2%的造影剂后见造影剂进入囊腔即可确诊。⑤肺脓肿或感染后肺大泡:临床上多有明确的感染史,病变在抗炎治疗后逐渐好转,直至囊腔完全吸收,而CCAM合并感染时抗炎治疗后周围炎症吸收,囊腔大小变化不大。⑥肺结核空洞:多有明确结核病史或结核中毒症状,且肺结核空洞多为内壁不光滑的厚壁空洞。⑦囊性胸膜肺母细胞瘤:即胸膜肺母细胞瘤I型,较罕见,CCAM发生率相对较高,但仍需病理学检查进行区分。
总之,影像学检查,尤其是CT检查是CCAM的主要检查方法。临床发现局限于某一肺叶或者肺段的伴有囊性改变的肺感染患儿,抗感染治疗后炎症吸收,囊腔不消失者,应考虑该病的可能。肺内单发或多发含气囊腔而无呼吸系统症状患儿,CCAM的可能性更大。早期诊断有助于正确治疗,避免人为并发症,如胸腔穿刺所致气胸的发生。各病理分型的CCAM的CT表现有一定的特征性,结合各种图像后处理技术可以更好地显示病变及合并的其他畸形。CCAM不能自愈,且存在瘤体压迫、反复感染和潜在恶性的危险,一旦发现即使无症状也应早期手术切除。
[1] Roeleveld PP, Martin J, Chow CW, et al. A neonate with coexisting congenital cystic adenomatoid malformation of the lung and alveolar capillary dysplasia: a case report with review of literature. Pediatr Crit Care Med, 2008, 9(2): e10-e13.
[2] Stocker JT, Madewell JE, Drake RM. Congenital cystic adenomatoid malformation of the lung. Classification and morphologic spectrum. Hum Pathol, 1977, 8(2): 155-171.
[3] 苏金亮, 周利民, 纪建松, 等. 先天性肺囊性腺瘤样畸形的CT表现. 放射学实践, 2012, 27(1): 46-48.
[4] 卢根, 申昆玲, 胡英惠, 等. 小儿先天性肺囊性腺瘤样畸形23例诊治分析. 中国实用儿科杂志, 2009, 24(7): 539-541.
[5] 许素珍, 龚水根. 先天性肺囊性腺瘤样畸形1例. 中国医学影像技术, 2009, 25(7): 1198.
[6] 朱亚芳, 解左平, 邱合荣, 等. 胎儿先天性肺囊性腺瘤样畸形的产前超声诊断. 中国优生与遗传杂志, 2010, 18(12): 105, 114.
[7] 黄志新, 邓学东, 车惠娟. 胎儿先天性肺囊腺瘤样畸形产前超声诊断及临床意义. 中华医学超声杂志(电子版), 2012, 9(11): 968-972.
[8] 孙国强. 实用儿科放射诊断学. 第2版. 北京: 人民军医出版社, 2011: 322.
[9] Peranteau WH, Merchant AM, Hedrick HL, et al. Prenatal course and postnatal management of peripheral bronchial atresia: association with congenital cystic adenomatoid malformation of the lung. Fetal Diagn Ther, 2008, 24(3): 190-196.
[10] 王雪莉, 史青, 奚政君, 等. 儿童肺先天性囊性腺瘤样畸形23例临床病理分析. 临床儿科杂志, 2012, 30(11): 1040-1043.
[11] 曾骐, 冯力民, 任甄华, 等. 先天性肺囊性腺瘤样畸形的诊断和治疗. 中华胸心血管外科杂志, 2003, 19(3): 148-150.
[12] 席艳丽, 唐文伟, 张新荣. 小儿先天性肺囊性腺瘤样畸形的影像与病理对照分析. 中国医学影像技术, 2010, 26(8): 1488-1491.
[13] 郭徐林, 赵晓月, 权太东, 等. 胎儿先天性肺囊性腺瘤样畸形的早期超声诊断. 临床超声医学杂志, 2008, 10(7): 494-495.
囊腺瘤样畸形,肺,先天性;体层摄影术,X线计算机;病例报告
2013-09-06 【修回日期】2014-01-04
(责任编辑 唐 洁)
R734.2;R445.3
河北省儿童医院CT、MRI科 河北石家庄 050031
侯振洲 E-mail: houzhenzhou@yeah.net
10.3969/j.issn.1005-5185.2014.02.013
