卵圆孔未闭解剖和检查技术的进展
2014-03-07韩军良赵钢
韩军良,赵钢
心源性脑梗死的常见原因包括心房颤动、瓣膜病、近期的心肌梗死、扩张型心肌病、病态窦房结综合征、卵圆孔未闭(patent foramen ovale,PFO)合并深静脉血栓等[1],相对而言,与PFO相关的脑梗死容易在临床实践中被人们所忽略,部分医生甚至对卵圆孔的解剖生理病理和检查技术等尚感到陌生。本文将就这一问题做简要的综述。
1 卵圆孔的胚胎学
心脏的发育始动于胚胎第18~19天,而心房的分隔起始于胚胎第4~5周,此时,从心房的后上部发生出一个由上皮、胶原纤维和心肌组织构成的薄层隔膜,称为原发隔,此隔朝向位于下方的房室间的心内膜垫呈镰刀状生长[2](图1A),在两个结构融合之前,由于细胞凋亡和组织重构的发生,在原发隔的后上部先后出现一些小孔,并且这些小孔逐渐融合为一个较大的孔,称为第二孔(融合以前,原发隔与心内膜垫之间的空隙则称为第一孔)(图1A~C)[2-3]。几乎在第二孔出现的同时,心房的前上方壁向心腔内折叠并紧贴于原发隔的右侧向后下方生长,此较厚的隔膜被称为继发隔,继发隔于胚胎第7周末停止生长并在心房的后下方遗留一个卵圆形区域,称为卵圆窝,左右心房在此区域仅由原发隔分离;此时,原发隔和继发隔的绝大多数区域互相融合为一体,而仅在卵圆窝的上缘存在一小间隙,胎儿右心房内富含氧气的血液经此间隙及第二孔进入到左心房,该通道被称为卵圆孔(图1D)。出生后,由于左心房压力的升高,大多数人的卵圆孔逐渐闭合,2岁以后仍未闭合者则称为PFO[4]。
2 卵圆孔未闭的解剖及相关变异结构
人群中PFO的发生率为25%~30%,随着年龄的增长,PFO的发生率呈下降的趋势,但大小却呈增大的趋势[5]。尽管有1/4的人存在着PFO,但罹患反常性栓塞(paradoxical embolism,PE)的人数却相对较少,PE的发生与否以及病变的严重程度,除了与静脉系统栓子以及心房间的压力差相关以外,还与PFO的大小以及心腔的其他某些结构异常相关[6]。研究显示,PFO较大、合并房间隔瘤者容易发生PE,有人认为右心房内的Chiari网状结构(Chiari’s networks)和较大的下腔静脉瓣,也是PE发生的危险因素。
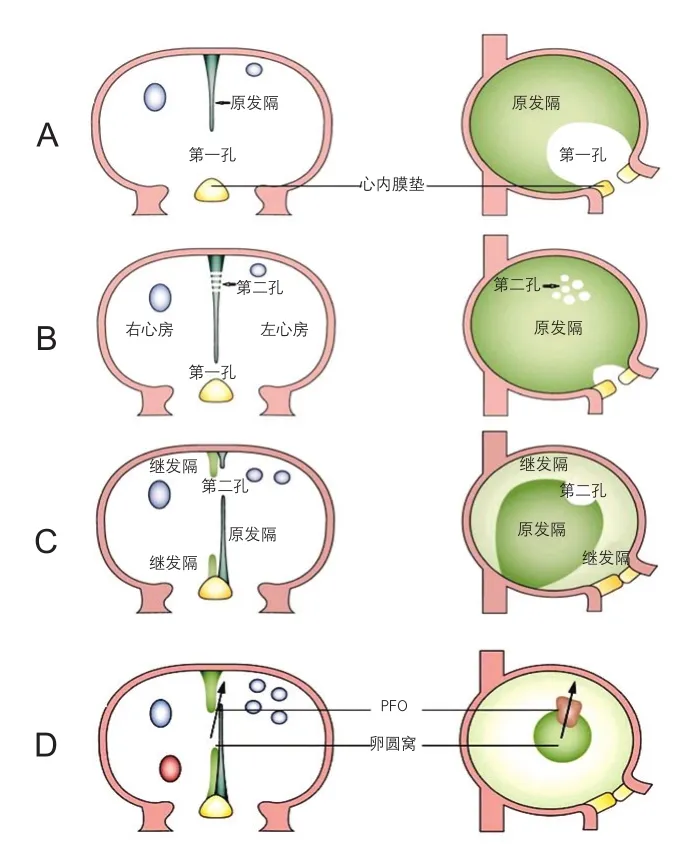
图1 卵圆孔的胚胎发育过程[3]
2.1 卵圆孔未闭的形态和大小 PFO实为一隧道样结构,其入口为卵圆窝上缘原发隔和继发隔之间的空隙,出口为原发隔上的第二孔,入口和开口之间的通道由原发隔和继发隔包裹而成[3-4](图2、图3)。多数研究显示,PFO的大小及右向左分流量的多少,与PE的发生风险和脑梗死体积的大小呈正相关,中等以上大小(直径2.0~3.0 mm以上)和中度以上分流量(左心房出现10~20个以上微泡)的PFO,发生PE的风险明显较高[7-9];但也有研究表明,PFO的大小及分流量的多少与PE的风险无关,小PFO也可造成严重脑梗死[10]。
按其形态的不同,PFO又可分为单纯型和复杂型,前者是指PFO的隧道长度不超过8 mm、未合并房间隔瘤(atrial septal aneurysm,ASA)、卵圆窝没有其他缺损、继发隔厚度不超过10 mm以及无异常的下腔静脉瓣,复杂型则与此相反[11]。需要强调的是,PFO大小及形态的确定与多个因素相关,患者是否使用瓦氏动作及其动作的充分程度、检测医生对PFO的认识及其技术是否熟练等均会影响PFO测量的准确性[12]。

图2 二维经食管超声显示的PFO形态[12]
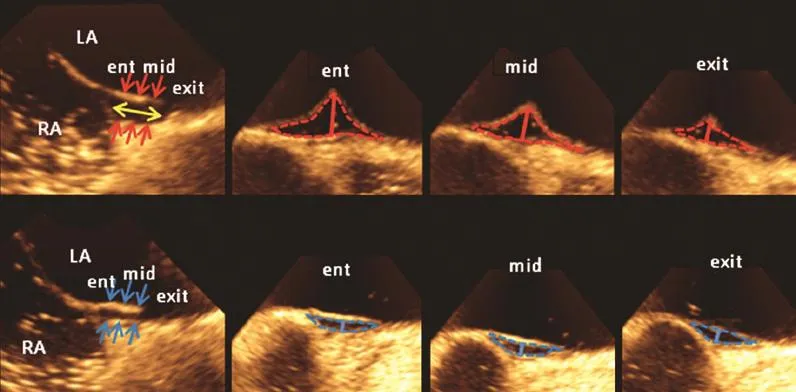
图3 三维经食管超声显示的PFO形态[12]
2.2 卵圆孔未闭合并房间隔瘤 继发性房间隔一般较厚,而原发性房间隔相对较薄;卵圆窝处的原发隔厚度一般为0.5~1.5 mm,部分人中,该部位随心动呼吸运动而出现明显的左右摆动,此现象被称为ASA。研究者多将ASA定义为,心动周期中原发隔向左或右摆动偏离中线10 mm以上且基底部宽度超过15 mm者[3](图4)。多数研究结果显示,PFO合并ASA发生PE的比率明显高于单纯的PFO,人群中ASA的发病率为2%~4%,而缺血性卒中患者ASA的发生率却达8%~15%,ASA合并PFO的比率高达30%~60%[4,13-14],房间隔大幅的摆动不仅增加了右向左的分流量,而且增加了血栓的发生率[3,15]。
2.3 异常下腔静脉瓣与Chiari网状结构 与PFO合并ASA相比,PFO合并异常下腔静脉瓣或Chiari网状结构导致PE发生的概率并不很高,后者与PE的关系,不同的研究之间存在争论[4,7]。下腔静脉瓣又称欧氏瓣(eustachian valve),呈扁平状位于下腔静脉与卵圆窝之间,在胎儿期,欧氏瓣能使来自下腔静脉富含氧气的血液顺利地流向卵圆窝而非进入三尖瓣,成年后欧氏瓣逐渐萎缩,长度超过2 cm时被视为异常[16],异常欧氏瓣与PE的关系存在争论[17]。Chiari网状结构是静脉窦右角的残留,功能尚不清楚,常起自欧氏瓣和冠状窦瓣区域而附着于右心房上壁或房间隔,有研究显示PFO合并Chiari网状结构发生PE的风险相对较高[4,17]。
3 卵圆孔未闭的检测
3.1 经胸超声 受到自身条件的限制,经胸超声(transthoracic echocardiogram,TTE)显示PFO的效果不佳。近年来,随着经验和技术的提高,一些研究也发现,静脉注射激活的生理盐水,可以明显提高TTE发现PFO的阳性率[15,18],但总体来说一些较小的PFO还是有可能被遗漏[4,18]。
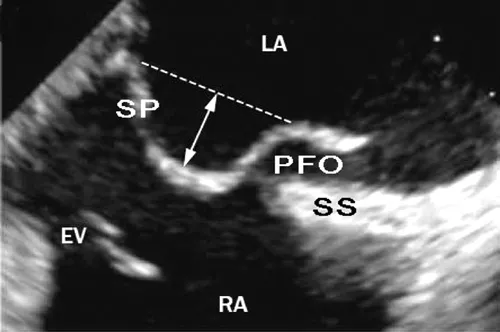
图4 二维经食管超声显示的PFO合并ASA[3]
3.2 经食管超声检查 目前PFO检测的金标准仍为经食管超声(transoesophageal echocardiography,TEE),静脉注射激活的生理盐水可增强检测的效果。PFO患者一般在静脉内注射后的3个心动周期末,于左心房内出现微气泡,根据微泡数量的多少,确定右向左分流(right-to-left-shunt,RLS)的多少;如果在静脉注射的5个心动周期后才在左心房内检测到微气泡,则应怀疑存在肺动静脉畸形[7,19],TEE可以对PFO做出准确的定性和部分定量测量,一般来说,3个心动周期后在左心房出现10个以下的微气泡,则为小量RLS,10个以上为中等量分流,左心房微泡很多且难以计数则属于大量分流[20]。
近年来,国内一些大型医疗教学机构已基本普及了二维TEE,对推动研究PFO与PE关系的发展会起到积极的作用。然而,对于行卵圆孔封堵治疗的术者而言,准确了解患者PFO的形态对于提高手术成功率,降低并发症具有重要意义,下列内容均需要仔细的检测:PFO的入口和出口大小、PFO的隧道长度、继发隔的厚度、是否合并ASA及其尺寸、有无房间隔缺损或异常欧氏瓣等其他异常[11],此时,二维TEE往往难以达到理想的效果,而使用三维经食管超声(three-dimensional transesophageal echocardiography,3D-TEE)则会做出清晰且准确的测量[11-12],遗憾的是,目前国内拥有3D-TEE和使用经验的单位较少。
3.3 经颅多普勒微泡试验 经颅多普勒超声微泡试验(transcranial Doppler ultrasound bubble test),也称经颅多普勒超声增强对比试验(contrast transcranial Doppler ultrasound,cTCD),显示RLS的敏感性极高且易于操作,是筛查PFO和评估封堵术后是否存在残余分流的最常用手段,除了定性之外,cTCD更重要的作用是对RLS做出半定量的判断[3,4,21]。行瓦氏动作并持续10 s,当屏气开始约5 s时立即从肘静脉快速团注10 ml激活的生理盐水,若注射5~10 s后在大脑中动脉或基底动脉监测到栓子信号,则可确定患者存在RLS。目前文献中有很多关于分流量大小的判断标准,不同的分级方法之间有些区别较大,需要仔细比对其内容。一般而言,栓子数目10个以下为小量分流,10~25个属于中度分流,栓子数达到25个以上则属于大量分流[22]。鉴于70%以上的RLS来自于PFO,所以cTCD检查结果阳性者,PFO的可能性最大,但需要TEE或血管成像除外肺动静脉畸形等[23]。目前,在国内的许多地市级医院,cTCD的检查已得到普及,医生普遍关注微泡试验的安全性。美国4个医疗中心在2008年共行微泡试验3300余例,结果仅5例发生了缺血性卒中[24],总体而言,操作cTCD的安全性很高,检查者需要将这一事实告知患者和家属并视情况决定是否签署知情同意书。
3.3 其他检查技术 有报道应用磁共振成像和多排螺旋计算机断层扫描检测PFO,但其敏感性和特异性均较差,目前仍无法代替超声检测[25-26]。有人应用心脏内超声检测PFO,但需要借助介入导管技术,属于有创操作且费用较为昂贵,目前主要用于介入手术中了解心脏的内部结构[27]。
近年,随着国内对PFO相关性疾病认识的逐步提高,临床针对PFO的检测增长迅速,许多医院已将cTCD和TEE作为偏头痛和隐源性卒中的常规检测手段,开展PFO介入封堵术的医院常依赖cTCD判断术后残余RLS的大小。普及以超声技术为主的PFO检查方法,将有助于提高我国反常性脑栓塞的诊断率,提高部分偏头痛患者病因诊断的准确性,为这些患者的个体化防治方案提供重要依据。
1 Amarenco P, Bogousslavsky J, Caplan LR, et al. New approach to stroke subtyping:the A-S-C-O (phenotypic)classification of stroke[J]. Cerebrovasc Dis, 2009,27:502-508.
2 Abdulla R, Blew GA, Holterman MJ. Cardiovascular embryology[J]. Pediatr Cardiol, 2004, 25:191-200.
3 Calvert PA, Rana BS, Kydd AC, et al. Patent foramen ovale:anatomy, outcomes, and closure[J]. Nat Rev Cardiol, 2011, 8:148-160.
4 Hara H, Virmani R, Ladich E, et al. Patent foramen ovale:current pathology, pathophysiology, and clinical status[J]. J Am Coll Cardiol, 2005, 46:1768-1776.
5 Hagen PT, Scholz DG, Edwards WD. Incidence and size of patent foramen ovale during the fi rst 10 decades of life:an autopsy study of 965 normal hearts[J]. Mayo Clin Proc, 1984, 59:17-20.
6 Johnson BI. Paradoxical embolism[J]. J Clin Pathol,1951, 4:316-332.
7 Goel SS, Tuzcu EM, Shishehbor MH, et al. Morphology of the patent foramen ovale in asymptomatic versus symptomatic (stroke or transient ischemic attack)patients[J]. Am J Cardiol, 2009, 103:124-129.
8 Jung JM, Lee JY, Kim HJ, et al. Patent foramen ovale and infarct volume in cryptogenic stroke[J]. J Stroke Cerebrovasc Dis, 2013, 22:1399-1404.
9 Steiner MM, Di Tullio MR, Rundek T, et al. Patent foramen ovale size and embolic brain imaging fi ndings among patients with ischemic stroke[J]. Stroke, 1998,29:944-948.
10 Akhondi A, Gevorgyan R, Tseng CH, et al. The association of patent foramen ovale morphology and stroke size in patients with paradoxical embolism[J].Circ Cardiovasc Interv, 2010, 3:506-510.
11 Rana BS, Shapiro LM, McCarthy KP, et al. Threedimensional imaging of the atrial septum and patent foramen ovale anatomy:defining the morphological phenotypes of patent foramen ovale[J]. Eur J Echocardiogr, 2010, 11:i19-i25.
12 Tanaka J, Izumo M, Fukuoka Y, et al. Comparison of two-dimensional versus real-time three-dimensional transesophageal echocardiography for evaluation of patent foramen ovale morphology[J]. Am J Cardiol,2013, 111:1052-1056.
13 Agmon Y, Khandheria BK, Meissner I, et al. Frequency of atrial septal aneurysms in patients with cerebral ischemic events[J]. Circulation, 1999, 99:1942-1944.
14 Piechowski-Jozwiak B, Bogousslavsky J. Stroke and patent foramen ovale in young individuals[J]. Eur Neurol, 2013, 69:108-117.
15 Cotter PE, Martin PJ, Belham M. Toward understanding the atrial septum in cryptogenic stroke[J]. Int J Stroke, 2011, 6:445-453.
16 Schrem SS, Freedberg RS, Gindea AJ, et al. The association between unusually large eustachian valves and atrioventricular valvular prolapse[J]. Am Heart J,1990, 120:204-206.
17 Homma S, Di Tullio MR. Patent foramen ovale and stroke[J]. J Cardiol, 2010, 56:134-141.
18 Maffè S, Dellavesa P, Zenone F, et al. Transthoracic second harmonic two-and three-dimensional echocardiography for detection of patent foramen ovale[J]. Eur J Echocardiogr, 2010, 11:57-63.
19 Kutty S, Sengupta PP, Khandheria BK. Patent foramen ovale:the known and the to be known[J]. J Am Coll Cardiol, 2012, 59:1665-1671.
20 Soliman OI, Geleijnse ML, Meijboom FJ, et al. The use of contrast echocardiography for the detection of cardiac shunts[J]. Eur J Echocardiogr, 2007, 8:S2-S12.
21 Caputi L, Butera G, Anzola GP, et al. Residual shunt after patent foramen ovale closure:preliminary results from Italian patent foramen ovale survey[J]. J Stroke Cerebrovasc Dis, 2013, 22:e219-e126.
22 Yang Y, Guo ZN, Wu J, et al. Prevalence and extent of right-to-left shunt in migraine:a survey of 217 Chinese patients[J]. Eur J Neurol, 2012, 19:1367-1372.
23 Meacham RR 3rd, Headley AS, Bronze MS, et al.Impending paradoxical embolism[J]. Arch Intern Med,1998, 158:438-448.
24 Romero JR, Frey JL, Schwamm LH, et al. Cerebral ischemic events associated with 'bubble study' for identification of right to left shunts[J]. Stroke, 2009,40:2343-2348.
25 Hamilton-Craig C, Sestito A, Natale L, et al. Contrast transoesophageal echocardiography remains superior to contrast-enhanced cardiac magnetic resonance imaging for the diagnosis of patent foramen ovale[J].Eur J Echocardiogr, 2011, 12:222-227.
26 Kim YJ, Hur J, Shim CY, et al. Patent foramen ovale:diagnosis with multidetector CT--comparison with transesophageal echocardiography[J]. Radiology,2009, 250:61-67.
27 Vigna C, Marchese N, Zanchetta M, et al.Echocardiographic guidance of percutaneous patent foramen ovale closure:head-to-head comparison of transesophageal versus rotational intracardiac echocardiography[J]. Echocardiography, 2012, 29:1103-1110.
【点睛】
本文简要回顾了卵圆孔的胚胎发育,概述其解剖特征,重点综述了卵圆孔未闭的超声学评估方法。
