缬沙坦对血管平滑肌细胞增殖、迁移及p-ERK1/2、p-P38表达的影响
2014-03-04陈宗建张延斌
陈宗建,张延斌
(江苏省昆山市第二人民医院,江苏昆山215300)
冠心病是威胁人类身体健康的一类重大疾病。经皮冠状动脉介入治疗(PCI)是目前冠心病介入治疗的重要方法,主要包括经皮腔内冠状动脉成形术和支架植入术[1]。但是,PCI术后的近期效果理想,而远期效果并不理想,术后再狭窄是人类面临的又一难题。血管平滑肌细胞(vascular s mooth muscle cell,VSMCs)的异常增殖和迁移是动脉粥样硬化和血管成形术后再狭窄的主要病理基础[2]。研究发现,血管紧张素Ⅱ(AngⅡ)与支架术后再狭窄的发展过程密切相关,AT1受体的激活可促进VSMCs的增殖与迁移,故ARB(常用高血压一线治疗药)可能会降低支架植入后的再狭窄率。目前,AngⅡ通过p-ERK1/2促分裂原活化蛋白激酶(MAPK)的激活促进VSMCs增殖与迁移的机制已被证实[3],但缬沙坦(Val)对AngⅡ诱导VSMCs增殖与迁移的影响以及与p-ERK1/2、p-P38 MAPK表达关系的研究并不多。
本研究观察了Val对AngⅡ刺激下离体大鼠胸主动脉VSMCs的增殖与迁移及p-ERK1/2、p-P38 MAPK表达的影响,现报道如下。
1 材料与方法
1.1 主要材料与试剂 Sprague-Dawley大鼠,雄性,体质量150~200 g,由徐州医学院实验动物中心提供;Val(常州四药有限公司惠赠),AngⅡ(Sig ma,美国),PD98059(ERK1/2上游激酶的特异性抑制剂)(Sigma,美国),SB23015(P38上游激酶的特异性抑制剂)(Sig ma,美国),胎牛血清(FBS)(杭州四季青生物材料有限公司),DMEM培养基(Gibco,美国);噻唑蓝(MTT)(Sig ma,美国),兔抗鼠ERK1/2、p-ERK1/2-抗(北京中杉金桥生物技术有限公司,美国原装进口分装),兔抗鼠P38、p-P38-抗(北京中杉金桥生物技术有限公司,美国原装进口分装)。
1.2 VSMCs的培养与鉴定 取雄性Sprague-Dawley大鼠1只,10%水合氯醛2 mL腹腔注射麻醉,75%乙醇浸泡消毒5 min。移入超净工作台,解剖分离出大鼠心肺组织与胸主动脉,剪下胸主动脉放于培养皿,用磷酸盐缓冲液(PBS)冲洗数次。眼科剪纵行剖开血管,眼科弯镊自上而下轻刮内膜2~3遍去除单层的内皮细胞,镊子剥离外膜。更换培养皿,加入少量20%FBS的DMEM培养液,眼科剪反复剪碎血管中膜组织成11 mm2×1 mm2大小(剪切10 min左右)。用弯头吸管将血管组织小块移入一次性塑料培养瓶内,均匀种植于培养瓶底,盖好瓶盖,平躺放入培养箱内。3~4 h后加入3~5 mL含20%FBS的DMEM培养基,使植块刚好浸入培养液中。培养箱内静置培养3 d后,换新鲜培养液,以后根据具体情况更换培养基,初期尽量少动,以免影响细胞贴壁和生长。待植块周围生长晕的细胞融合成片时,即可传代。相差显微镜观察细胞生长形态,采用第2代细胞行α-actin单克隆抗体进行免疫细胞化学染色鉴定,取第3~5代VSMCs。
1.3 实验分组 对照组:1%FBS的DMEM;AngⅡ组:AngⅡ(10-6mol/L);Val1+AngⅡ组:Val(10-3mol/L)+AngⅡ(10-6mol/L);Val2+AngⅡ组:Val(10-4mol/L)+AngⅡ(10-6mol/L);Val3+AngⅡ组:Val(10-5mol/L)+AngⅡ(10-6mol/L);PD+AngⅡ组:PD98059(10-5mol/L)+AngⅡ(10-6mol/L);SB+AngⅡ组:SB23015(10-5mol/L)+AngⅡ(10-6mol/L);Val组:Val(10-3mol/L)。
1.4 MTT法检测细胞增殖 取3~5代对数生长期的细胞,消化、离心,10%FBS的DMEM培养液稀释细胞成5×104/mL的密度,接种于96孔板,200μL/孔,培养24 h。换用0.5%FBS的DMEM培养液,200μL/孔,培养24 h,使细胞同步于静止生长期(G0/G1期)。换用1%FBS的DMEM培养液,200 μL/孔,并进行药物干预,Val1+AngⅡ组、Val2+AngⅡ组、Val3+AngⅡ组、Val组提前加入Val干预30 min,PD+AngⅡ组、SB+AngⅡ组提前分别加入PD98059,SB23015干预30 min,继续培养24 h。MTT分析检测:细胞培养20 h时每孔加入MTT(5 mg/mL)20μL,继续培养4 h,吸净培养液,每孔加入二甲基亚砜150μL,微量振荡器振荡约10 min,酶标仪检测吸光度OD值。
1.5 细胞划痕试验测定VSMCs迁移距离 选择第3~5代生长良好的VSMCs,胰蛋白酶制备细胞悬液,调整细胞密度为1.0×105/mL,均匀接种于6孔板中。在铺板前,在板的背面用记号笔划5~6道平行的横线。待细胞贴壁生长至70%~80%汇合时,吸弃原含10%血清的培养液,换用含0.5%血清的DMEM培养液继续培养24 h,使VSMCs同步化,处于G0/G1期。用无菌的200μL枪头划痕移液管尖(约0.7 mm)在各培养板细胞生长单层相同位置划垂直或平行直线,与以上的横线要垂直,造成几条“伤口”。PBS洗2次,去除被移液管尖破坏而脱落的细胞,加1%FBS的DMEM培养液。根据实验分组先分别加入Val(10-3mol/L)、Val(10-4mol/L)、Val(10-5mol/L)、PD98059(10-5mol/L)、SB23015(10-5mol/L)与细胞孵育1 h,然后再加入AngⅡ继续作用。倒置显微镜下观察细胞迁移。于24 h时观察各组细胞迁移情况,超过划线的细胞最远距离,即实际迁移距离。照相,测距离3次,计算均值。
1.6 Val、PD98059、SB23015、AngⅡ对VSMCs ERK1/2、p-ERK1/2、P38、p-P38蛋白表达的影响 选择第3~5代生长良好的VSMCs,待细胞贴壁生长至60%~70%汇合时,换用含0.5%胎牛血清的DMEM培养液继续培养24 h,使VSMCs同步化,处于G0/G1期。换用1%FBS的DMEM培养液5 mL/瓶,各实验组加入相应药物干预,对照组不处理,放入培养箱中继续培养,在30 min结束培养。每瓶加入裂解液与酶抑制剂的混合液300μL,细胞刮刀刮下瓶底的细胞,迅速移入1.5 mL EP管中。离心12 000 r/min,4℃,20 min。吸取上清液,于-20℃冰箱中短期保存。按BCA蛋白测定试剂盒说明书检测蛋白浓度。按常规方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),2.5 mA/c m2,50 min转膜(NC膜),取出NC膜,加入5%脱脂奶粉封闭液中置摇床轻轻摇动封闭3 h,置 于ERK1/2、p-ERK1/2、P38、p-P38一 抗 工 作 液(1∶1 000),室温下振摇2 h,4℃冰箱过夜,洗涤缓冲液清洗5 min×3遍,加入山羊抗兔二抗工作液(1∶1 000),室温下振摇2 h,用洗涤缓冲液清洗5 min×3遍,双蒸馏水洗5 min。10 mL AP底物缓冲液中先后加入66 L氯化硝基四氮唑蓝和33 L-溴-4-氯-3-吲哚基-磷酸盐(现配现用),将清洗好的NC膜放入AP显色液中,摇床上边摇边观察显色情况,可见棕黑色的条带。取出NC膜,避光晾干,将条带扫描入电脑,采用Image J软件分析灰度值。
1.7 统计学处理 采用SPSS17.0软件进行统计分析,计量资料以±s表示,组间比较采用单因素方差分析,进一步组间两两比较采用SNK-q检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 VSMCs的鉴定 VSMCs鉴定:细胞质内呈棕黄色丝状条纹者为阳性。随机挑取5个以上高倍视野,计数100个细胞中阳性细胞占95%以上方可用于实验。
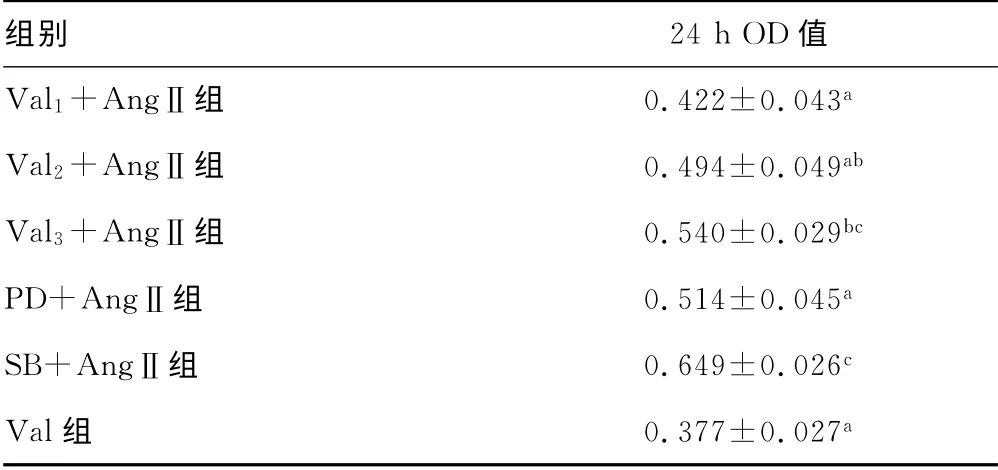
2.2 Val、PD98059和SB23015对AngⅡ促进VSMCs增殖的影响 与对照组相比,AngⅡ能明显促进VSMCs的增殖(P<0.01);Val在浓度为10-5~10-3mol/L时,呈浓度依赖性抑制VSMCs对AngⅡ的增殖(P<0.01)。PD98059能抑制AngⅡ的促VSMCs增殖作用(P<0.01);而SB23015能明显促进AngⅡ的促VSMCs增殖作用(P<0.01)。同时,与对照组相比,Val单独作用于VSMCs时,对细胞增殖的影响,差异无统计学意义(P>0.05)。表见1。
表1 Val、PD98059和SE23015干预后的MTT 结果±s,n=6)

表1 Val、PD98059和SE23015干预后的MTT 结果±s,n=6)
组别 24 h OD值对照组 0.379±0.033 a AngⅡ组0.598±0.051
续表1 Val、PD98059和SE23015干预后的MTT 结果(±s,n=6)
续表1 Val、PD98059和SE23015干预后的MTT 结果(±s,n=6)
a:P<0.01,与AngⅡ组比较;b:P<0.01,与Val 1+AngⅡ组比较;c:P<0.05,与AngⅡ组比较。
组别 24 h OD值Val 1+AngⅡ组 0.422±0.043 a Val 2+AngⅡ组 0.494±0.049 ab Val 3+AngⅡ组 0.540±0.029 bc PD+AngⅡ组 0.514±0.045 a SB+AngⅡ组 0.649±0.026 c Val组 0.377±0.027 a
2.3 Val和PD98059对AngⅡ促进VSMCs迁移的影响 VSMCs经AngⅡ作用后,迁移活性明显增加,AngⅡ作用于细胞24 h,VSMCs迁移活性是对照组的1.29倍(P<0.01);Val及PD98059抑制AngⅡ诱导大鼠VSMCs的迁移(P<0.05),但SB23015作用与之相反(P<0.05)。同时,与对照组相比,Val单独作用于VSMCs时,对细胞迁移的影响,差异无统计学意义(P>0.05)。见表2。
表2 Val、PD98059和SE23015干预后的VSMCs 迁移距离(±s,n=3)
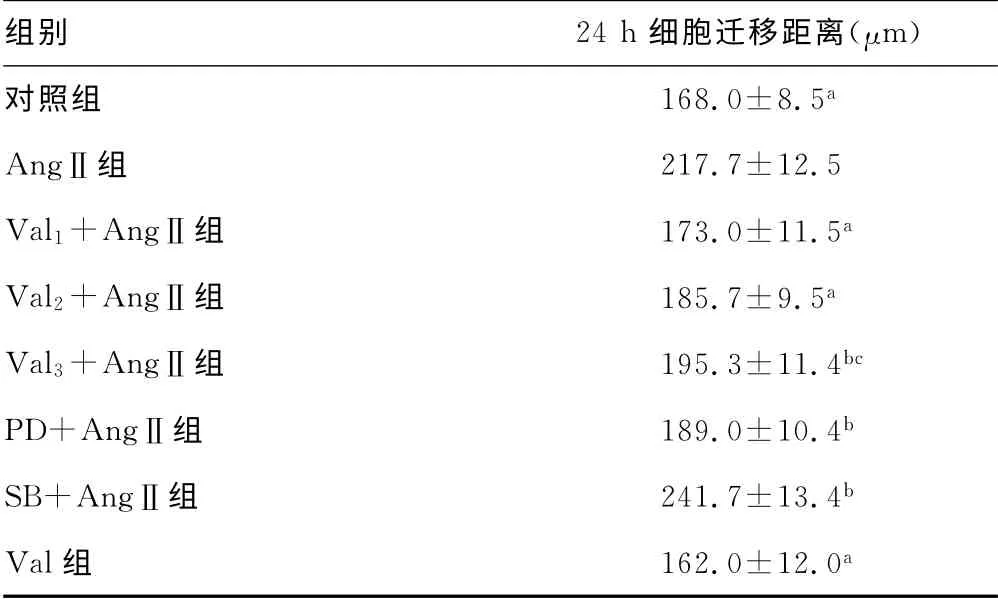
表2 Val、PD98059和SE23015干预后的VSMCs 迁移距离(±s,n=3)
a:P<0.01,与AngⅡ组比较;b:P<0.05,与AngⅡ组比较;c:P<0.05,与Val 1+AngⅡ组比较。
组别 24 h细胞迁移距离(μm)对照组 168.0±8.5 a AngⅡ组 217.7±12.5 Val 1+AngⅡ组 173.0±11.5 a Val 2+AngⅡ组 185.7±9.5 a Val 3+AngⅡ组 195.3±11.4 bc PD+AngⅡ组 189.0±10.4 b SB+AngⅡ组 241.7±13.4 b Val组 162.0±12.0 a
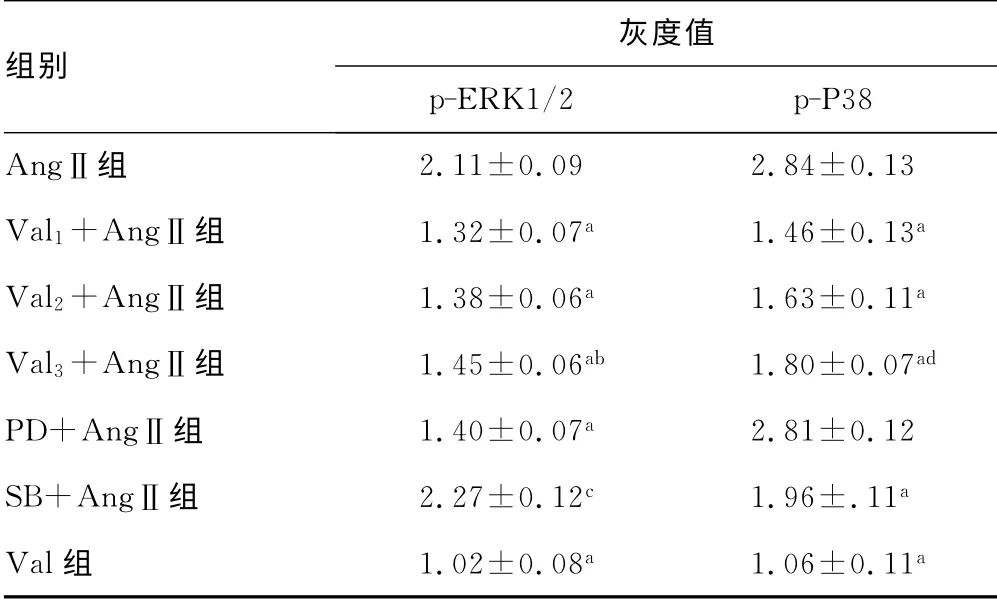
2.4 Val、PD98059、SB23015对AngⅡ促进VSMCs胞内p-ERK1/2、p-P38表达的影响 与对照组相比,AngⅡ能促进VSMCs胞内p-ERK1/2、p-P38的表达,Val能抑制AngⅡ的促VSMCs胞 内p-ERK1/2、p-P38表 达 的 作 用(P<0.01);PD98059能抑制AngⅡ的促VSMCs胞内p-ERK1/2表达的作用(P<0.01);但对AngⅡ促进VSMCs胞内p-P38的表达的影响,差异无统计学意义(P>0.05);SB23015能促进AngⅡ的促VSMCs胞内p-ERK1/2表达的作用(P<0.05)。同时,与对照组相比,Val单独作用于VSMCs时,对胞内p-ERK1/2、p-P38表达的影响,差异无统计学意义(P>0.05),见表3、图1。
表3 Val、PD98059和SE23015干预后的p-ERK1/2、 p-P38的表达(±s,n=3)

表3 Val、PD98059和SE23015干预后的p-ERK1/2、 p-P38的表达(±s,n=3)
组别灰度值p-ERK1/2 p -P38对照组 1.00±0.00a 1.00±0.00 a
续表3 Val、PD98059和SE23015干预后的p-ERK1/2、 p-P38的表达(±s,n=3)
续表3 Val、PD98059和SE23015干预后的p-ERK1/2、 p-P38的表达(±s,n=3)
a:P<0.01,与AngⅡ组比较;b:P<0.05,与Val 1+AngⅡ组比较;c:P<0.05,与AngⅡ组比较;d:P<0.01,与Val 1+AngⅡ组比较。
组别灰度值p-ERK1/2 p-P38 AngⅡ组2.11±0.09 2.84±0.13 Val 1+AngⅡ组 1.32±0.07 a 1.46±0.13 a Val 2+AngⅡ组 1.38±0.06 a 1.63±0.11 a Val 3+AngⅡ组 1.45±0.06 ab 1.80±0.07 ad PD+AngⅡ组 1.40±0.07a 2.81±0.12 SB+AngⅡ组 2.27±0.12 c 1.96±.11 a Val组 1.02±0.08 a 1.06±0.11 a
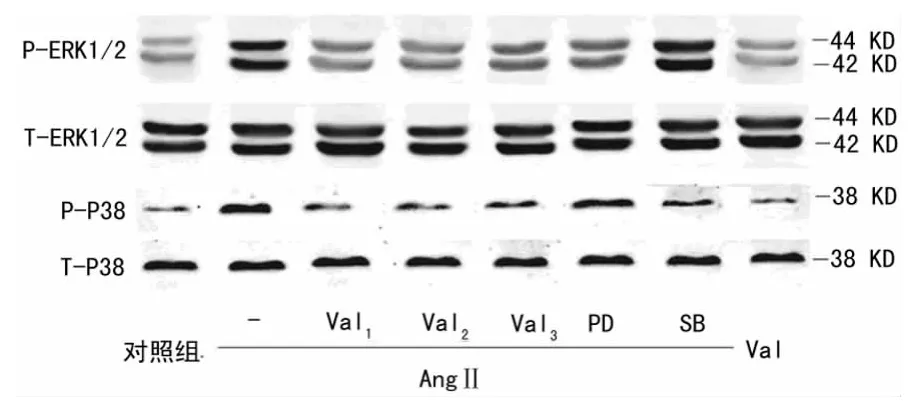
图1 不同干预组作用后ERK1/2、P38蛋白印迹条带
3 讨 论
AngⅡ是肾素-血管紧张素-醛固酮系统的重要产物,AT1R、AT2R是AngⅡ的2个特异性受体,在细胞生长和增殖方面显示出相反的效果[4-9]。研究发现,AT1R的激活增加了再狭窄过程中的各种损伤反应[10-13]。AngⅡ拮抗剂Val在预防支架术后再狭窄方面是可行的。2007年,Iwata等[6]进行了Val与氯沙坦预防支架术后再狭窄的比较研究,发现支架术后治疗6个月,生理剂量的Val可明显降低支架血管的再血管化率,且Val组冠状动脉造影显示的靶血管管腔缩小的程度明显低于氯沙坦组。2005年,Peters等[7]进行的临床试验,发现支架术后治疗6个月,Val组的再狭窄率低于血管紧张素转换酶抑制剂组(P<0.05)。
本实验应用MTT分析法评估了VSMCs的增殖状况,在AngⅡ(10-6mol/L)的刺激下,Val(10-5~10-3mol/L)呈浓度依赖性抑制VSMCs的增殖,与AngⅡ组相比差异有统计学意义(P<0.05)。而Val单独作用于VSMCs时,与对照组相比,差异无统计学意义(P>0.05),表明Val能明显拮抗AngⅡ的促增殖作用。另外,作者发现AngⅡ(10-6mol/L)能明显刺激VSMCs的迁移,这一作用被Val(10-5~10-3mol/L)呈剂量依赖性地抑制,且差异具有统计学意义(P<0.05)。而Val单独作用时,对VSMCs的迁移无明显影响,表明Val能明显拮抗AngⅡ的促迁移作用。
AngⅡ激活AT1R后促进VSMCs的增殖、迁移与细胞外信号通路ERK1/2 MAPK的表达上调有关[8]。目前关于Val对AngⅡ诱导VSMCs的增殖与迁移的影响以及与p-ERK1/2、p-P38 MAPK表达关系的研究并不多。在本实验应用MTT分析法和划痕试验评估了ERK1/2的特异性抑制剂PD98059(10-5mol/L)、P38特异性抑制剂SB23015(10-5mol/L)对AngⅡ诱导VSMCs的增殖与迁移的影响。实验结果显示,PD98059能显著抑制AngⅡ诱导的VSMCs的增殖与迁移,而SB23015能显著促进AngⅡ诱导的VSMCs的增殖与迁移,提示AngⅡ诱导的细胞增殖、迁移与磷酸化ERK1/2 MAPK表达上调有关,且磷酸化P38在此过程中起负性调节作用。实验还应用蛋白质印迹法评估了Val、PD98059及SB23015对AngⅡ诱导的VSMCs内磷酸化ERK1/2、P38 MAPK表达上调的影响。作者选择30 min作为观察时间,Val(10-5~10-3mol/L)和SB23015(10-5mol/L)明显抑制了AngⅡ诱导的磷酸化P38 MAPK的表达,PD98059(10-5mol/L)则对此过程无明显影响,说明磷酸化ERK1/2 MAPK则对AngⅡ诱导的磷酸化P38 MAPK的表达无调节作用。这与Kintscher等[9]研究结果相一致。
综上所述,Val预防支架术后再狭窄的机制可能与其抑制AngⅡ诱导的VSMCs的增殖与迁移及ERK1/2 MAPK表达有关,而磷酸化P38 MAPK则对AngⅡ诱导的磷酸化ERK1/2 MAPK的表达起负性调节作用。这为今后临床应用Val预防支架植入术后再狭窄提供了依据。
[1]李拥军,常亮.2012年中国经皮冠状动脉介入治疗指南解读[J].中国循证心血管医学杂志,2012,4(4):294-296.
[2]Segev A,Nili N,Qiang B,et al.Inhibition of intimal hyperplasia after stenting by over-expression of p15:a mem-ber of the INK4 family of cyclin-dependent kinase inhibitors[J].J Mol Cell Cardiol,2011,50(3):417-425.
[3]Orlandi A,Bennett M.Progenitor cell-derived smoothmuscle cells in vascular disease[J].Biochem Pharmaecol,2010,79(12):1706-1713.
[4]首云锋,陈明.血管紧张素受体AT2及AT4研究进展[J].心血管病学进展,2010,1(1):58-61.
[5]Mitra AK,Agrawal DK.In stent restenosis:bane of thestent era[J].J Clin Pathol,2006,59(3):232-239.
[6]Iwata A,Miura S,Imaizumi S,et al.Do valsartan andlosartan have the same effects in the treatment of coronary artery disease?[J].Circ J,2007,71(1):32-38.
[7]Peters S,Trümmel M,Meyners W,et al.Valsartan versusACE inhibition after bare metal stent implantation--results of the VALVACE trial[J].Int J Cardiol,2005,98(2):331-335.
[8]Sharma V,Sharma A,Kansal L,et al.The effect oforal administration of Allium sativum extracts on lead nitrate induced toxicity in male mice[J].Food Chem Toxicol,2010,48(3):928-936.
[9]Kintscher U,Bruemmer D,Blaschke F,et al.p38 MAP kinase negatively regulates angiotensinⅡ-mediated effectson cell cycle molecules in human coronary smooth musclecells[J].Biochem Biophys Res Commun,2003,305(3):552-556.
[10]Abd Alla S,Lother H,el Missiry A.Angiotensin II AT2receptor oligomers mediate G-protein dysfunction in ananimal model of Alzheimer disease[J].J Biol Chem.2009,284(10):6554-6565.
[11]Lee JC,Kumar S,Griswold DE.Inhibition of p38 MAPkinase as a therapeutic strategy[J].Immunopharmacology,2000,47(2/3):185-201.
[12]Kumar S,Boehm J,Lee JC.p38 MAP kinases:key signalling molecules as therapeutic targets for inflammatorydiseases[J].Nat Rev Drug Discov,2003,2(9):717-726.
[13]Blaschke F,Leppanen O,Takata Y.Liver X receptor agonists suppress vascular smooth muscle cell proliferationand inhibit neointima formation in balloon-injured rat carotid arteries[J].Circ Res,2004,95(12):e110-123.
