响应面分析法优化紫薯花青素提取工艺
2014-03-03施鹏飞肖海峻罗红霞孟利前杨新建王伟青
施鹏飞,肖海峻,罗红霞,孟利前,田 璐,杨新建,王伟青
(北京农业职业学院食品与生物工程系,北京 102442)
响应面分析法优化紫薯花青素提取工艺
施鹏飞,肖海峻*,罗红霞,孟利前,田 璐,杨新建,王伟青
(北京农业职业学院食品与生物工程系,北京 102442)
以紫甘薯花青素为原料,采用柠檬酸水溶液为提取剂,分别研究提取剂浓度、浸提温度、浸提时间和料液比对花青素提取率的影响。在此基础上,采用3因素3水平响应面分析法,以吸光度为响应值,探讨浸提温度、浸提时间和料液比对紫薯花青素提取的影响并对提取工艺进行优化。紫薯花青素在波长为524nm处有最大吸收峰。单因素实验证明当柠檬酸浓度为5%、浸提温度为50℃、浸提时间为4h、料液比为1∶20g/mL时花青素提取率达到最大。响应面分析证明对花青素提取率影响大小的顺序为料液比、提取温度和提取时间。响应面分析法确定紫薯花青素最佳提取工艺参数为:提取温度46℃,提取时间6h,料液比1∶23g/mL,在此条件下花青素含量为159mg/100g。
紫甘薯,花青素,响应面分析法,最佳提取工艺
花青素主要是一类花色素糖苷类化合物的水溶性色素,在自然状态下,与植物体内的各种单糖结合形成糖苷,又称花色苷[1]。花青素颜色的深浅与其含量呈正相关,由于其优越的着色能力,已作为食品添加剂应用于果酱、糕点等产品中[2-3]。目前用溶剂提取法提取紫薯花青素的研究主要有:吕跃东等[4]对紫薯花青素的乙醇浸提工艺进行了优化;樊婷等[5]采用柠檬 酸 - 乙 醇 法 提 取 花 青 素 ;Gongjian Fan等[6]以HCL -乙醇为提取剂。但是提取花青素的提取剂乙醇、HCL等的残留对花青素的应用会产生负面影响。然而紫甘薯花青素在酸性条件下可在破坏紫甘薯细胞膜的同时溶解水溶性的紫甘薯花色素,而柠檬酸作为食用酸类,在某些食品中添加柠檬酸,不仅可以改善食品的感官性状、增强食欲,而且还可以促进体内钙、磷物质的消化吸收,能够避免其他提取剂带来的不良反应,因此本研究中以柠檬酸作为提取剂对紫甘薯花青素提取工艺进行优化,筛选出最佳参数,为紫薯深加工奠定基础。
1 材料与方法
1.1 材料与仪器
紫甘薯 大兴区庞各庄镇农业技术推广站提供;柠檬酸 分析纯。
FW80高速万能粉碎机 天津市泰斯特仪器有限公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;GL-88B旋涡混合器 海门市其林贝尔仪器制造有限公司;HH-4数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;Eppendorf离心机5804R 北京博仪恒业科技发展有限公司;SHB-Ⅲ真空循环水势多用泵 郑州长城科工贸有限公司;UV2550紫外-可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 紫薯粉的制备 将紫色甘薯洗净、切成(刀)3mm薄片,在烘箱45℃下烘干至恒重。粉碎后过60目筛,避光保存备用。
1.2.2 紫薯花青素提取工艺流程 紫薯粉→提取剂悬浮→恒温水浴提取→离心→抽滤→花青素提取液→定容→测吸光度。
1.2.3 测试方法 采用比吸光度法:我国食品添加剂标准 化 委 员 会 建 议采用 比 吸 光 度E(λmax)表 示 色 素含量[7]:
E=A/m
式中:A为样品稀释至100mL时,用1cm比色皿测得最大吸收波长下的吸光度;m为样品质量g。
由上式可以看出,当样品质量相同时,花青素的比吸光度与吸光度成正比,为方便起见,直接用吸光度值分析比较不同提取条件下花青素的提取率大小。
以紫外-可见分光光度计测得的吸光度值计算紫薯花青素含量公式[8]:
C=1/958×V/100×1/M×ABS×100000。
其 中 :C:花 青 素 含 量 ,单 位 为 mg/100g(鲜 薯);958:ABS转换为质量体积比的经验系数;V:定容体积(mL);M:样品质量(g);ABS:分光光度计的吸光度值;100000:单位转换系数。
1.3 实验设计
1.3.1 紫甘薯花青素光谱特性研究 准确称取已粉碎并过60目筛的紫薯粉末0.5g,加入提取剂10mL(5%柠檬酸为提取剂),于60℃恒温水浴下浸提2h,抽滤,将滤液稀释100倍后,取花青素稀释液在400~700nm波长下进行波谱扫描,以筛选紫薯花青素的最大吸收波长。
1.3.2 紫甘薯花色苷提取的单因素实验
1.3.2.1 柠檬酸浓度的筛选 准确称取1g紫薯粉各7份,分别加入浓度为0.5%、1%、2%、3%、4%、5%、6%的柠檬酸提取剂,料液比为1∶10,于60℃恒温水浴下浸提6h,提取液3500r/min离心10min,然后将上清液抽滤,滤液用相应的提取剂稀释至100mL,分别于最大吸收峰处测定其吸光值,重复3次。
1.3.2.2 提取温度的筛选 准确称取1g紫薯粉各6份,按照料液比为1∶10加入5%柠檬酸,分别于30、40、50、60、70、80、90℃恒温水浴下浸提6h,提取液3500r/ min离心10min,然后将上清液抽滤,滤液用5%柠檬酸稀释至100mL,分别于最大吸收峰处测定其吸光值,重复3次。
1.3.2.3 提取时间的筛选 准确称取1g紫薯粉各5份,按照料液比为1∶10加入5%柠檬酸,于60℃恒温水浴下分别浸提2、4、6、8、10h,提取液3500r/min离心10min,然后将上清液抽滤,滤液用5%柠檬酸稀释至100mL,分别最大吸收峰处测定其吸光值,重复3次。1.3.2.4 料液比的筛选 准确称取1g紫薯粉各6份,然后分别按照不同的料液比1∶5、1∶10、1∶15、1∶20、1∶25、1∶30加入5%柠檬酸提取剂,于60℃恒温水浴下浸提6h,提取液3500r/min离心10min,将上清液抽滤,滤液用5%柠檬酸提取剂稀释至100mL,分别于最大吸收峰处测定其吸光值,重复3次。
1.3.3 响应面分析实验设计表 应用响应面法,根据Box-Behnken中心组合实验设计原理,采用3因素3水平的响应面分析方法,在单因素实验基础上,自变量的实验水平分别以-1、0、1进行编码表,共设计17个实验点,其中12个为析因点,5个零点实验用以估计实验误差[9-11]。以吸光度为响应值进行实验设计,因素水平设计见表1。
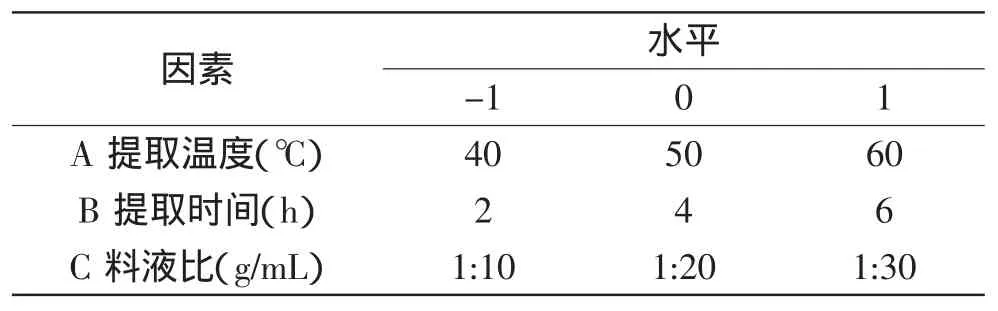
表1 响应面实验设计因子及水平表Table 1 Factors and levels results of RSD (response surface design)
2 结果与分析
2.1 紫薯花青素最大吸收峰值的筛选
制得紫薯花青素的粗提液后,用紫外可见分光光度计在400~700nm波长范围内,每隔2nm对紫薯花青素的吸收光谱进行扫描,结果见图1,由图1可知,紫薯花青素粗提液在524nm处有最大吸收峰。

图1 紫甘薯花青素在400~700nm可见光下的吸收光谱Fig.1 Visible absorbance spectrum(400~700nm)of the purple sweet potato anthocyanin
2.2 单因素实验结果及分析
2.2.1 柠檬酸水溶液浓度对吸光度的影响 柠檬酸是一种有机酸,目前已广泛的应用到食品、医药和日化等行业,用柠檬酸作为提取剂,可避免其他有机提取剂带来的负面影响。为进一步探索柠檬酸水溶液的最佳提取浓度,本实验按料液比为1∶10加入不同浓度的柠檬酸提取剂,在60℃恒温水浴下浸提6h,分别测定其吸光度,结果见图2。由图2可知,吸光度随柠檬酸浓度的增加呈现先增加后减小的趋势,当柠檬酸浓度为5%时达到最大值,表明此时花青素的提取率最大。花青素的结构和稳定性受不同柠檬酸浓度的影响很大,但是二者间的相互关系尚不明确。
2.2.2 提取温度对吸光度的影响 按照料液比为1∶10加入5%柠檬酸,在不用水浴温度下浸提6h,然后测定其吸光度变化,测定结果如图3所示。由图3可以看出,在水浴温度为30~50℃范围内,随着温度的升高,比吸光值呈增加趋势,表明提取液中花青素的含量在增加,当水浴温度达到50℃时花青素提取率达到最高;当水浴温度超过50℃之后,花青素的提取率随温度的升高而降低,这可能与过高的温度破坏花青素的结构有关。

图3 提取温度对吸光度的影响Fig.3 Effects of extraction temperature on absorbance of anthocyanin
2.2.3 提取时间对吸光度的影响 按照料液比为1∶10加入5%柠檬酸,在水浴温度为50℃下浸提2、4、6、8、10h,然后测定其吸光度变化,测定结果如图4所示。由图4可以看出,吸光度随着浸提时间的延长呈现先增加后减小的趋势,当浸提取时间为4h时吸光度达到最高,表明此时花青素提取率达到最大值。出现这种情况的原因是:在刚开始时,花青素随时间的延长而不断被溶解出,在短时间内即可溶解的较为完全,此后,随着浸提时间的延长,由于花青素由于受到温度的影响,其结构和稳定性受到影响,其含量出现下降趋势。

图4 提取时间对吸光度的影响Fig.4 Effects of extraction time on absorbance of anthocyanin
2.2.4 料液比对吸光度的影响 分别加入料液比为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30的柠檬酸提取剂,于60℃恒温水浴下浸提6h,分别测定其吸光度,测定结果如图5所示。由图5可以看出,吸光度随溶剂量的增加而增加,当料液比为1∶20时达到最大值,之后随溶剂量的增加吸光度有增大的趋势,但趋于平缓。为了节约成本,在实验中选择料液比为1∶20。出现这种情况的原因可能是随着提取剂用量的增加,花青素溶解到溶液中的速度加快,但当提取剂的量达到一定程度时,花青素溶解趋于完全,这时即使再增加提取剂的量,花青素可溶解的量不再增多。
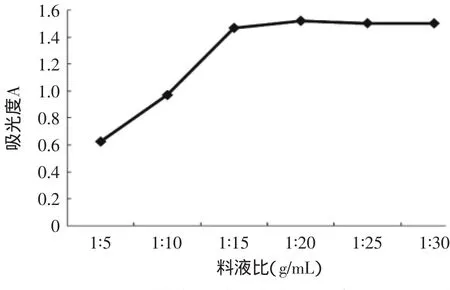
图5 料液比对吸光度的影响Fig.5 Effects of ratio of material to liquid on absorbance of anthocyanin
2.3 响应面法优化紫薯花青素提取的实验结果与分析
采用响应面法(RSM)优化紫薯花青素提取实验结果见表2 。对表2中的实验结果进行统计分析,得到回归方程方差分析见表3。
利用Design Expert软件,通过对表2中吸光度实验数据进行多元回归拟合,获得紫甘薯花青素吸光度对编码自变量提取温度(A)、提取时间(B)和料液比(C)的二次多项回归方程:Y=1.55145-0.02709A-0.01228B+0.10481C - 0.02706AB+0.00075BC+ 0.00269BC-0.06798A2-0.05535B2-0.18116C2。
在实验范围内,水浴浸提对紫甘薯花青素吸光度的影响,一次项的偏回归方程系数的绝对值C>A>B,说明料液比对紫薯花青素的吸光度影响最大,其次是提取温度,最小是提取时间。

表2 响应面实验设计方案及结果Table 2 Design and results of RSD(response surface design)tests
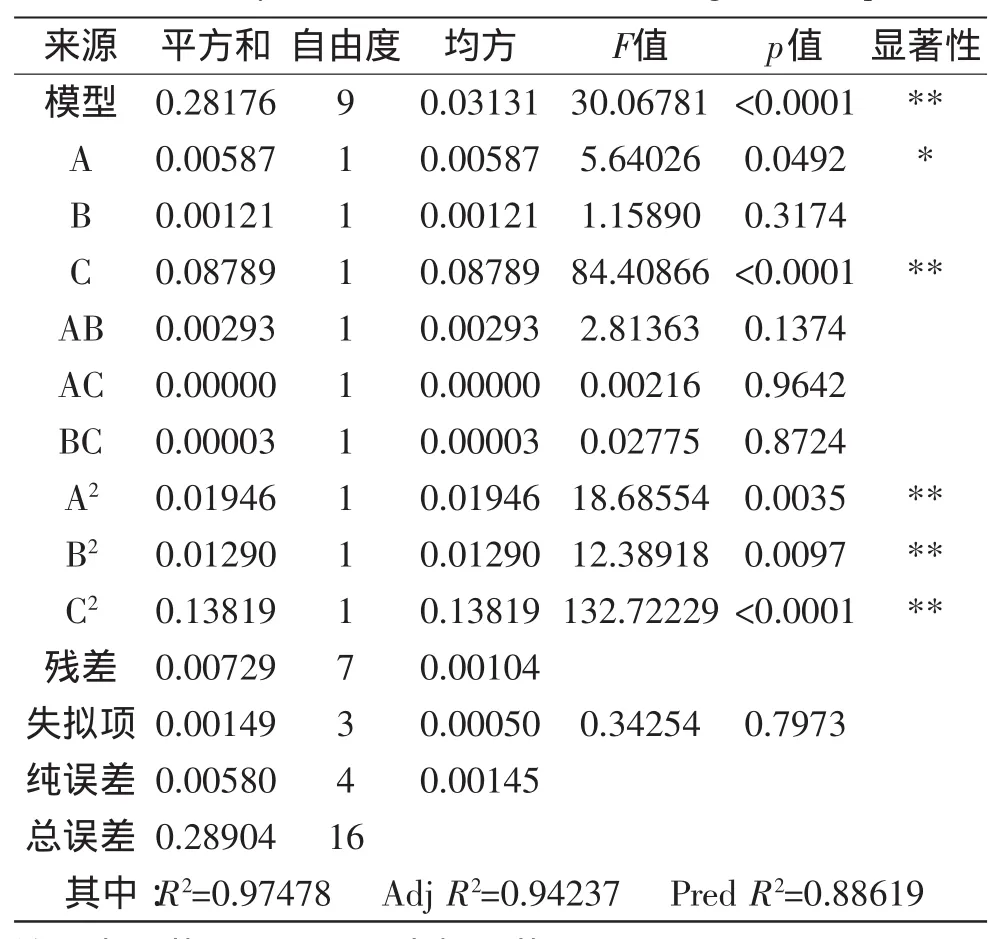
表3 回归模型的方差分析Table 3 Analysis of variance for items of regression equation
从该模型的方差分析(表3)可以看出,本实验所选用的二次多项模型极显著性(p<0.0001),失拟项不 显 著(p=0.7973 >0.05),回 归 模 型 的 相 关 系 数 为0.97478,说明该模型能够解释97.478%的响应值变化,模型拟合程度较好,对实践具有指导意义,可以用此模型对紫薯花青素的吸光度进行分析和预测。
一次项中,料液比对响应值影响极显著,提取温度对响应值影响显著,提取时间对响应值影响不显著;二次项中,提取温度、提取时间和料液比和对响应值影响都极显著;交互项中,提取温度和提取时间,提取温度和料液比以及提取时间和料液比对响应值影响都不显著。
为了观察某个因素及其交互作用同时对吸光度的影响,将其他因素条件保持不变,获得每个因素及其交互作用对吸光度影响的一组动态响应曲面图(图6~图8),从而确定因素的最佳参数范围。
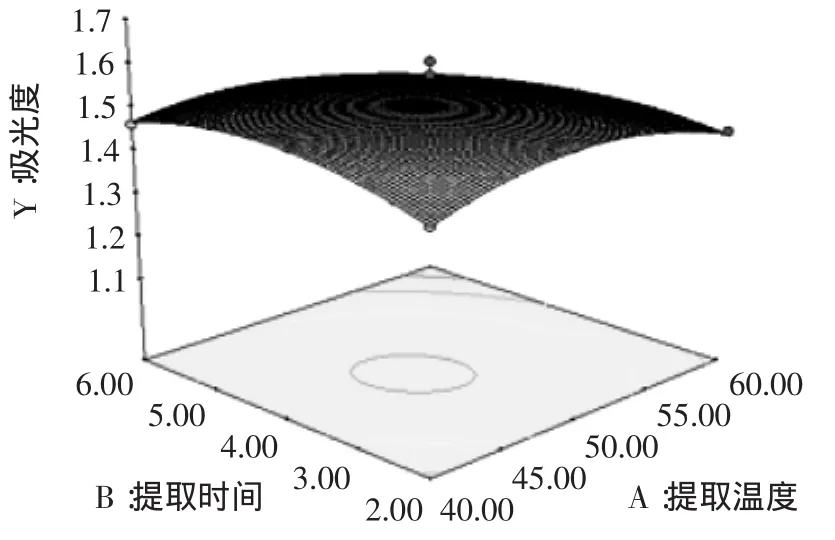
图6 提取温度和提取时间对吸光度交互影响的曲面图Fig.6 Response surface of extraction temperature and extraction time on absorbance of anthocyanin
从提取温度和提取时间对吸光度的响应曲面(图6)可以看出,当料液比在最佳值时,随着提取温度的增加,吸光度先增大后减小;随着提取时间的延长,吸光度先增大后减小。由图6可以确定最佳水平范围即提取温度为46~49℃,提取时间为3.5~3.9h。

图7 提取温度和料液比对吸光度交互影响的曲面图Fig.7 Response surface of extraction temperature and ratio of material to liquid on absorbance of anthocyanin
从提取温度和料液比对吸光度的响应曲面(图7)可以看出,当提取时间在最佳值时,随着提取温度的增加,吸光度先增大后减小;随着料液比的增加,吸光度先增大后减小。由图7可以确定最佳水平范围即提取温度为47~50℃,料液比为1∶21~1∶24。
从提取时间和料液比对吸光度的响应曲面(图8)可以看出,当提取温度在最佳值时,随着提取时间的延长,吸光度先增大后减小,因为在刚开始时,花青素随时间的延长而不断被溶解出,在短时间内即可溶解的较为完全,此后,随着浸提时间的延长,花青素的稳定性受到影响,其含量出现下降;随着料液比的增加,吸光度先增大后减小,由于随着提取剂用量的增加,花青素溶解到溶液中的速度加快,但当提取剂的量达到一定程度时,花青素溶解趋于完全,这时即使再增加提取剂的量,花青素可溶解的量不再增多。由图8可以确定最佳水平范围即提取时间为3.8~4.2h,料液比为1∶22~1∶25。
2.4 最优提取工艺参数优化结果
通过Design-Expert软件进行分析,得到回归方程的最大值点是:提取温度46.05℃,提取时间6.00h,料液比1∶22.95,预期的吸光度为1.51046。考虑到实际操作中遇到问题,将提取工艺条件修正为:提取温度46℃,提取时间6h,料液比1∶23,按此工艺参数做3次平行实验,吸光度的平均值为1.52773,与理论预测值1.51046相比,相对误差为1.143%,证明了方程的可靠性与响应面分析法的有效性。此条件下,花青素含量为159mg/100g。

图8 提取时间和料液比对吸光度交互影响的等高线图和曲面图Fig.8 Response surface of extraction time and ratio of material to liquid on absorbance of anthocyanin
3 结论
通过一系列实验,建立了水浴浸提紫薯花青素的数学模型,以比吸光度为响应值,各因素影响的主次顺序为:料液比>浸提温度>提取时间>。通过提取工艺响应面研究,确定了水浴浸提紫薯花青素的最佳工艺参数是:提取温度46℃,提取时间6h,料液比1∶23,在此条件下紫甘薯花色苷比吸光度达到1.52773,计算得花青素含量为159mg/100g。综上所述,利用响应曲面法对紫甘薯花色苷的提取工艺进行优化,可获得最优的工艺参数,可以减少工艺操作的盲目性,为进一步的实验研究奠定一定基础。
[1]赵宇瑛,张汉锋.花青素的研究现状及发展趋势[J].安徽农业学报,2005,33(5):904-905,907.
[2]凌关庭.食品添加剂手册[M].北京:化学工业出版社,1997:543-545.
[3]KONGJM , CHIALS , GOHNK ,et al.Analysisandbio-Logicalactivities of anthocyanins[J].Phytochemistry,2003 ,64(5):923-933.
[4]吕跃东,王勇,张文革,等.响应面法优化紫甘薯花青素的提取工艺[J]. 食品研究与开发,2012,33(12):64-69.
[5]樊婷,何建军,陈学玲,等.柠檬酸-乙醇法提取紫甘薯花青素工艺的优化[J].湖北农业科学,2012,51(23):5448-5451.
[6]Gongjian Fan,Yonbin Han,Zhenxin Gu,et al.Optimizing conditions for anthocyanins exteaction from purple sweet potato using response surface methodology(RSM)[J].LWT-Food Science and Technology,2008,41(1):155-160.
[7]段纯明,董海洲.膨化玉米黄粉中天然黄色素的制取工艺研究[J]. 食品与发酵工业,2007,33(3):128-132.
[8]刘桂玲,李海霞,郭宾会,等.不同提取方法对甘薯花青素含量测定的影响[J]. 中国农学通报,2007,23(4):91-94.
[9]Gary Woodward,PauL Kroon,Aedin Cassidy.Anthocyanin stability and recovery:implications for the analysis of clinical and experimental samples[J].Agric Food Chem,2009,57(12):5271-5278.
[10]唐军虎,康玮丽,任志艳,等.响应面法玉米蛋白肽锌制备条件的优化[J]. 食品工业科技,2011(3):294-300.
[11]CorraLes M,Toepf LS,Butz P,et al.Extraction of anthocyanins from grape by-products assisted by ultrasonics high hydrostatic pressure or pulsed lectric fields:A Comparison[J].Innov Food Sci Emerg TechnoL,2008,9(1):85-91.
Optimization of extraction water bath for anthocyanins from purple sweet potato by response surface method
SHI Peng-fei,XIAO Hai-jun*,LUO Hong-xia,MENG Li-Qian,TIAN Lu,YANG Xin-jian,WANG Wei-qing
(Department of Food and Bioengineering,Beijing Vocational College of Agriculture,Beijing 102442,China)
Confirm parameter optimization of extraction process of anthocyanins from purple aweet potato.Some factors affecting the ratio of extraction of proanthocyanidins such as extraction concentration , extraction temperature,extraction time and ratio of material to liquid were respectively studied used citric acid as extractant,the preparation process of anthocyanins from purple sweet potato was optimized according to Box-Behnken central composition design principle on foundation of single factor experiment,the method of response surface methodology ( RSM ) with 3 factors and 3 levels combined with Design-Expert data analysis software was adopted with the extraction yield of anthocyanins from purple sweet potato as the absorbance.The anthocyanins extraction yield would respectively reach the maximum when some parameters as follows:extraction concentration was 5% ,extraction temperature was 50℃ ,extraction time was 4h,ratio of material to liquid was 1∶20g/mL,and RSM also confirmed that affecting the ratio of extraction of proanthocyanidins in turns as follows:ratio of material to liquid,extraction temperature and extraction time.The optimum preparation conditions were obtained as follows :extraction temperature 46℃ , extraction time 6h ,ratio of material to liquid 1 ∶23g/mL.The anthocyanin extraction amount was 159mg/100g under these condition.
purple sweet potato;anthocyanins;response surface methodology(RSM);optimum extraction process
TS255.1
B
1002-0306(2014)20-0322-05
10.13386/j.issn1002-0306.2014.20.062
2013-09-27
施鹏飞(1987-),男,大学本科,助教,研究方向:微生物与食品检测。
* 通讯作者:肖海峻(1966-),女,博士,教授,研究方向:植物种质资源的开发与利用。
北京农业职业学院博士基金项目——紫甘薯花青素提取工艺研究;北京市职业院校教师素质提高工程。
