糖基化处理对绿豆分离蛋白功能特性的影响
2014-03-03江连洲王中江
王 晓,江连洲,李 杨,王中江,梁 婧,陈 勇
(东北农业大学食品学院,黑龙江哈尔滨 150030)
糖基化处理对绿豆分离蛋白功能特性的影响
王 晓,江连洲*,李 杨,王中江,梁 婧,陈 勇
(东北农业大学食品学院,黑龙江哈尔滨 150030)
为探讨糖基化处理对绿豆分离蛋白的功能特性影响,通过测定接枝度,红外光谱分析,以及对溶解性,乳化性和乳化稳定性,起泡性和起泡稳定性进行了探究。结果表明:相比于麦芽糖,采用葡萄糖与绿豆分离蛋白反应所得产物的接枝度较高,更易于反应;红外光谱显示有蛋白和糖的共价复合物生成,且α-螺旋和β-转角结构含量升高,其他两种二级结构组成降低;糖基化后的绿豆分离蛋白溶解度得到改善,且葡萄糖优于麦芽糖;糖基化后绿豆分离蛋白的乳化活性和乳化稳定性均得到提高,且麦芽糖效果更好;糖基化后绿豆分离蛋白的起泡性和泡沫稳定性均得到提高,且葡萄糖效果更明显。
糖基化,绿豆分离蛋白,接枝度,红外光谱,功能特性
绿豆在我国资源较丰富,在大部分的地区都有生产,目前国内的绿豆加工主要以淀粉利用为主,淀粉生产中产生的绿豆蛋白等副产物尚未得到充分利用,其中它的蛋白含量高达19.15%~33.11%,包含各种氨基酸种类,特别是赖氨酸含量丰富,接近在鸡蛋中的含量[1]。尽管绿豆蛋白具有一定的功能性质,但其较低的溶解性限制了它在食品生产中的应用,而且其乳化性等性质与某些动物源蛋白质相比有较大差距,因此需要对绿豆蛋白进行改性,以期获得优良的功能特性。
国内外有对绿豆蛋白的研究报道,Adsuale对绿豆分离蛋白营养品质作了全面综述[1],曾志红等对绿豆分离蛋白的功能性质进行初步研究[2],但对改性绿豆分离蛋白营养品质与功能特性的研究仍非常欠缺。常用的改性方法包括物理改性[3],化学改性和酶法改性[4],其中糖基化修饰是一种较为理想的改性方法,具有自发进行、无需添加化学试剂、加热即可加速反应等优点,可以有效提高蛋白质的功能特性。Sun等将还原糖与乳清蛋白进行糖基化反应后,其功能性质显著提高[5]。Groubet等将多种还原糖与β-酪蛋白进行反应后,接枝产物的溶解性得到了一定改善[6]。苏志光等将甘露聚糖与大豆分离蛋白糖基化生成糖蛋白,其溶解性显著提高[7]。但由于经糖基化处理后许多氨基酸失去了原有功能,是营养流失的主要原因,并且其过程产生了杂环胺等有害中间产物,产生极大安全隐患,所以产物在应用于食品加工前,应对安全性和营养性进行进一步研究。前人研究了糖基化改性对蛋白质功能特性的影响,但多数都是运用干热法制备多糖与蛋白复合物而进行研究。本实验通过测定经湿热法在不同时间和温度制得的葡萄糖和麦芽糖与绿豆分离蛋白糖基化产物的溶解性、乳化性等,分析糖基化温度和时间对其功能性质的影响,为采用糖基化处理提高其功能特性提供理论依据,并寻找出广泛应用于食品中的高性能食品添加剂。
1 材料与方法
1.1 材料与仪器
绿小豆 黑龙江北大荒集团;Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;SDS Sigma公司;TNBS 上海宝曼生物科技有限公司。
JZ7114型粉碎机 上海朝阳微电机厂;AL204型分析天平 梅特勒-托利多仪器(上海)有限公司;HH-4型数显恒温水浴锅 江苏金坛市荣华仪器制造有限公司;FD5-3型冷冻干燥机 美国SIM公司;Allegra64R型台式高速冷冻离心机 美国贝克曼公司;TU-1800型紫外可见分光光度计 北京普析通用仪器有限责任公司;磁力搅拌器、高速乳化均质机 广州仪科实验仪器有限公司;MAGNA-IR560傅立叶变换红外光谱系统 美国尼高力公司。
1.2 实验方法
1.2.1 绿豆分离蛋白的提取 绿豆经除杂后,采用碱溶酸沉法提取绿豆分离蛋白[8],提取流程参见图1。

图1 绿豆分离蛋白的制备Fig.1 Preparation of mung bean protein isolates
1.2.2 糖基化蛋白的制备 将5g绿豆分离蛋白和10g葡萄糖(10g麦芽糖),混合均匀后,溶于400mL的蒸馏水中,搅拌,用NaOH溶液调节pH至8并定容至500mL,得到蛋白质浓度为10mg/mL的溶液。将溶液转移到烧杯中,置于60℃(70℃)水浴中加热,每隔1h取样30mL,放于离心管中,用冷水快速冷却后待测[9]。
1.2.3 接枝度的测定 取125μL的反应液与2.0mL pH为8.2的磷酸缓冲液混合,并加入1.0mL 0.01%的TNBS,使其充分混合,避光条件下50℃水浴加热30min,加入2.0mL的0.1mmol/L的亚硫酸钠终止反应,在室温下放置15min,在相同操作条件下采用蒸馏水代替反应液作为空白对照。用紫外可见分光光度计测定在420nm的吸光值。根据L-亮氨酸含量的标准曲线来确定自由氨基含量[10]。
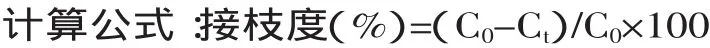
式中:C0:未反应时自由氨基含量,Ct:反应时间t时自由氨基含量。
1.2.4 傅里叶红外光谱检测 将冻干样品置于干燥器内充分干燥,称取样品1mg,与100mg溴化钾研磨混匀压片测定FTIR。在数据采集期间,为了减少水蒸汽IR吸收的干扰,持续用干燥的N2淋洗测量室。在与样品测定完全相同的条件下在室温敞开状态收集空气背景。测定在波数范围为4000~400cm-1的吸收光谱,分辨率4cm-1,波数精度0.01cm-1,扫描次数64次,环境温度25℃。
1.2.5 溶解度的测定 称取100mg蛋白样品分散于10mL的去离子水中,磁力搅拌30min,在20℃下12000×g离心20min。上清液经适度稀释,采用Lowry法测定蛋白质含量,以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比[11]。
1.2.6 乳化性和乳化稳定性的测定 取10mL蛋白质反应液与2mL大豆油混合,放入离心管中,在机械乳化机中乳化2min,迅速将乳化液倒入25mL的烧杯中。在距烧杯底部0.5cm处取样,取50μL的乳化液,迅速与10mL 0.1%的SDS混合,在500nm处测定吸光度,空白对照用0.1%的SDS[12]。

式中,N:稀释倍数;C:乳化液形成前蛋白质水溶液中蛋白质浓度(g/mL);Φ:乳化液中油的体积分数(L/L)。
1.2.7 起泡性和泡沫稳定性的测定 称取1g样品溶于100mL去离子水,置于500mL量筒中,均质40s,连续3次共计2min,记录均质后液面高度为V0(mL),静置30min后记录为V30min(mL)[13]。

1.3 数据统计分析
实验中所有数据都是三次测定的平均值,利用一维方差分析的LSD比较样品平均值之间的差异显著性。
2 结果与分析
2.1 糖基化反应对接枝度的影响
为表征绿豆分离蛋白与还原糖的反应程度,分别测定了绿豆分离蛋白与葡萄糖和麦芽糖反应后接枝度的变化。随着加热时间的增加,不同温度反应体系的接枝度均显著提高(p<0.05),且葡萄糖与绿豆分离蛋白的接枝度高于麦芽糖。从图2可以看出,在240min时,接枝程度最大,其相差也较大,可能是由于在相同质量的情况下,单糖羰基含量更高,增加了羰基和氨基的结合率,有利于反应的进行,跟前人的研究发现一致,糖基化反应中,糖基的分子质量越大,反应进行的程度越低,而分子质量越小,反应量越大[14]。随着时间的延长,蛋白质与糖的接枝反应程度增加变缓,这可能因为长时间的蛋白质与糖的发生接枝反应的同时,蛋白质分子之间出现不同程度的 热 聚 集[15],使 得 反 应 体 系 中 的 不 溶 性 组 分 大 大 增加,抑制接枝反应的进行。
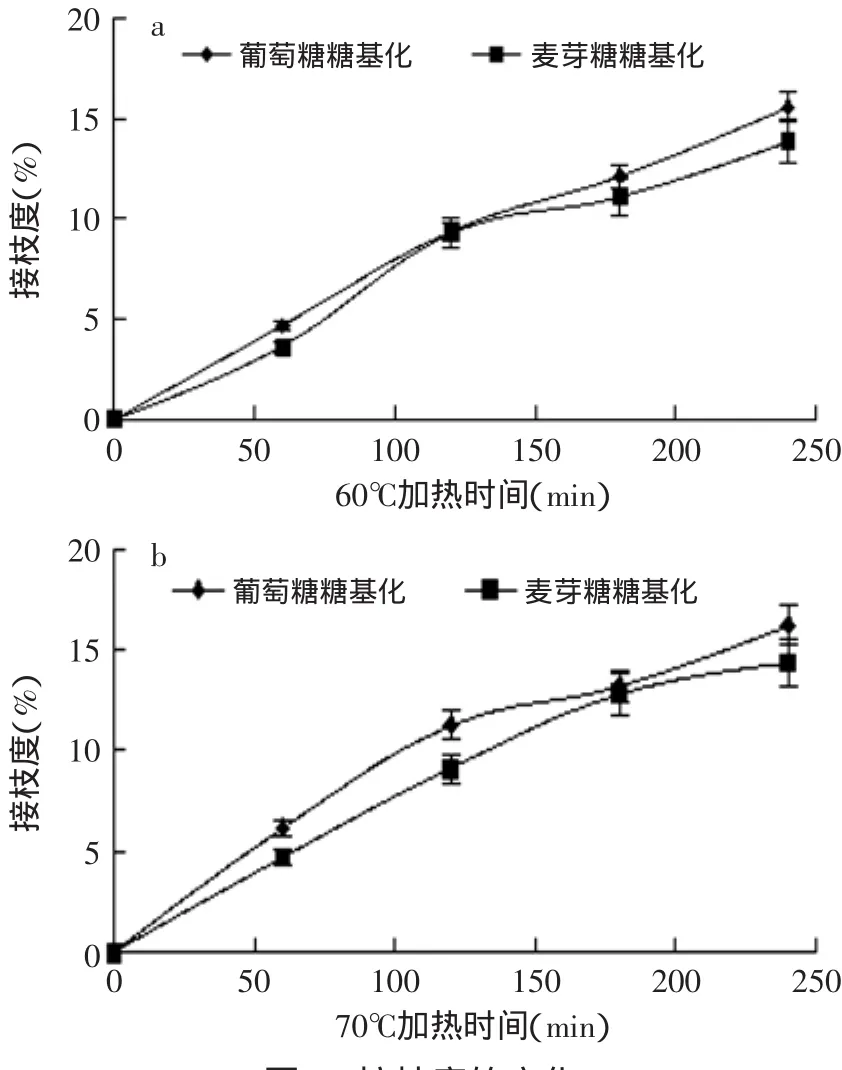
图2 接枝度的变化Fig.2 Changes of the degree of grafting
2.2 傅里叶红外光谱分析
傅里叶红外光谱是一种目前常用的分析蛋白质结构的方法,可灵敏地反映出肽链结构的一些变化[16]。经过4h的糖基化反应,确定红外光谱图3,表明不同糖基化处理,呈现不同的糖基化程度。在3500~3200cm-1之间的宽峰是O-H和N-H的伸缩振动,说明存在分子间和分子内的氢键,3000~2800cm-1的峰是糖类C-H伸缩振动,表明此物质为糖类复合物[17]。
其次选取了红外光谱的酰胺I带来分析绿豆蛋白的二级结构组成,采用Peakfit软件对蛋白质酰胺I带进行傅立叶变换去卷积,进行二阶导数峰拟合,得到 子 峰 数 目 在9 ~13之 间 ,其 残 差(r2)大 于0.96,确 认峰位归属,计算各子峰面积的相对百分含量,测定3次,取平均值。各子峰与二级结构对应关系的指认为 :1615~1640cm-1和1670~1690cm-1β-折 叠 ;1650 ~1660cm-1为α-螺旋;1640~1650cm-1为无规则卷曲;1660~1700cm-1为β-转角[18-19]。如表1所示,通过红外光谱酰胺I带分析可知,经糖基化处理后绿豆蛋白的α-螺旋结构含量有所升高,β-折叠结构含量有所降低,β-转角结构含量小幅升高,无规卷曲结构含量小幅降低。推测α-螺旋结构含量升高主要是由多肽链上羰基(-CO)和氨基(NH-)之间的氢键被破坏,蛋白质的聚集使β-折叠结构含量减少,β-转角比例增加可能是加热作用下α-螺旋结构内部氢键作用被破坏,无规卷曲结构这种转变表明蛋白质的结构重组,可能是亚基解离和聚合。
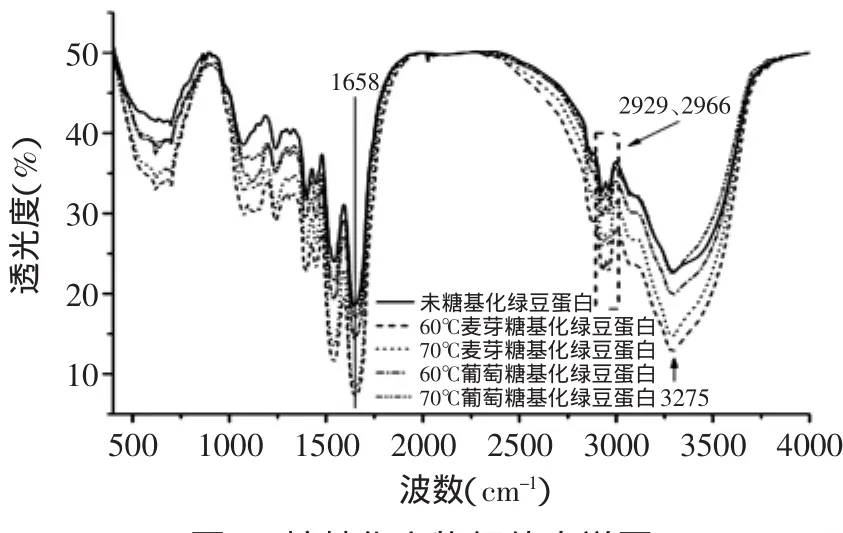
图3 糖基化产物红外光谱图Fig.3 FT-IR spectrum of glycosylation products

表1 糖基化绿豆分离蛋白质酰胺Ⅰ带拟合结果Table 1 Fitting results of secondary structure of glycosylation protein by amide I band
2.3 糖基化反应对溶解度的影响
不同反应时间反应产物的溶解性分别如图4所示,随着糖基化反应时间的延长,溶解度得到改善,不同温度反应体系的溶解度均显著提高(p<0.05),反应2h后趋于平缓,且葡萄糖高于麦芽糖。这与Achouri等[20]的研究结果一致,表明大豆球蛋白(11S)与葡萄糖发生接枝反应后,在一定时间内其产物溶解性随时间增加逐渐变大。可能原因是在反应初期,由于绿豆蛋白分子引入了糖链,为其增加了亲水性羟基,增加了蛋白质分子的亲水性,而且加热处理有助于蛋白质溶解度的提高,随着反应的进行,亲水性羟基增加的效果不显著,在反应后期,溶解度增加平缓,可能是随着反应时间的延长,造成部分蛋白分子的热聚集,使其溶解度增加变缓。葡萄糖糖基化产物的溶解性要高于麦芽糖糖基化产物。蛋白质具有特定的空间结构,接上糖链之后,空间结构被破坏,使蛋白质分子极性增强,其次多羟基的亲水特性也可使得整个分子的溶解性明显提高[21]。但由于糖链长度不同,产生了不同的空间位阻效应,糖链越长,效应越明显,进而阻止糖蛋白的空间展开,使蛋白质分子发生聚集,致使溶解度降低,出现葡萄糖优于麦芽糖的现象。

图4 接枝产物溶解度的变化Fig.4 Changes on the solubility of the graft products
2.4 糖基化反应对乳化性和乳化稳定性的影响
将绿豆分离蛋白分别与葡萄糖和麦芽糖在水浴条件下进行反应,不同反应时间反应产物的乳化活性和乳化稳定性分别如图5和图6所示。随着糖基化反应时间的延长,乳化活性和乳化稳定性得到改善,均显著提高(p<0.05),且整体上麦芽糖要高于葡萄糖。刘燕等研究也表明糖基化后的大豆蛋白乳化活性和乳化稳定性有不同程度的提高[22]。对乳化活性而言,麦芽糖要强于葡萄糖,当反应到一定程度后,乳化活性达到最高,但出现糖基化产物乳化活性增加的幅度不断减小,甚至出现下降的现象。前人在研究大豆分离蛋白和半乳甘露聚糖的糖基化反应产物的乳化性时[23],同样出现随着反应时间的增加,复合物的乳化活性将经历上升和下降两个过程,开始糖与蛋白质发生共价交联,由于糖的亲水性使产物的表面活性增加,从而乳化性得到提高,但当反应达到一定程度后,其交联程度越来越高,使产物过于亲水而失去界面活性,从而降低了产物的乳化性。对于乳化稳定性而言,随着反应时间的延长,分子间空间位阻增大,更加有效地阻止了油滴的聚集和乳化状态的破坏,从而提高了蛋白分子的乳化稳定性,相同反应时间下,麦芽糖与绿豆分离蛋白的糖基化产物的乳化稳定性比葡萄糖好,说明麦芽糖比葡萄糖更有利于改善绿豆分离蛋白质的乳化稳定性。

图5 接枝产物乳化活性的变化Fig.5 Changes on the emulsifying activity of graft products
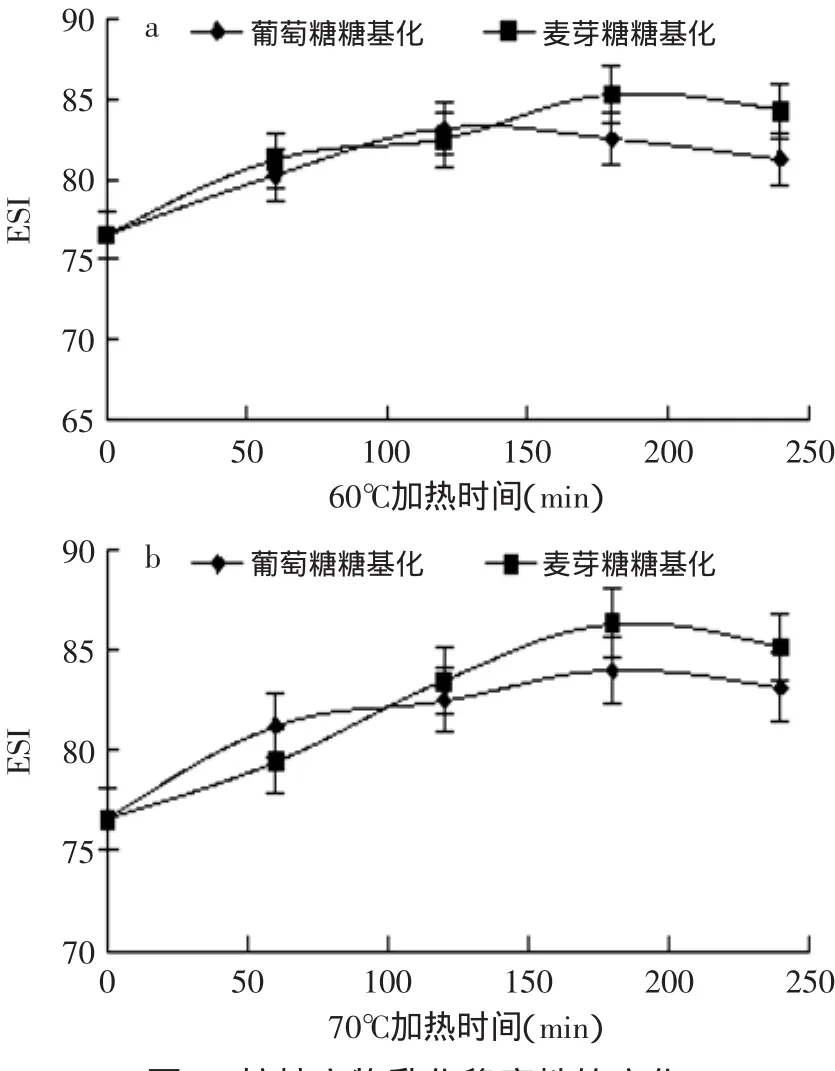
图6 接枝产物乳化稳定性的变化Fig.6 Changes on the emulsion stability of graft products
2.5 糖基化反应对起泡性和泡沫稳定性的影响
蛋白质能作为起泡剂主要取决于蛋白质的表面活性和成膜性,水溶性蛋白质可被起泡吸附以降低表面张力,使蛋白质逐渐凝固在气液界面间形成有一定刚性和弹性的薄膜[24]。将绿豆分离蛋白分别与葡萄糖和麦芽糖在水浴条件下进行反应,不同反应时间反应产物的起泡性和起泡稳定性分别如图7和图8所示。随着时间的增长,糖基化蛋白的起泡性和蛋白质的起泡性和起泡稳定性都得到了改善,均显著提高(p<0.05),起泡性呈现先增加后减小的趋势,起泡稳定性稳步升高,且葡萄糖要高于麦芽糖。鲁倩等研究也表明糖基化修饰可有效提高起泡性[25]。加热时间延长,起泡能力先升高再降低,这是可能因为当糖链接入到蛋白分子上,其亲水基团会增加蛋白的水溶性,增加起泡能力,随后所发生的起泡力下降的可能原因是交联后的蛋白质分子量会明显增大,蛋白质分子的空间位阻以及糖链所引起的强烈电荷效应导致接枝物的起泡力随时间的延长呈下降趋势。起泡稳定性的稳定升高,可能由于分子引入了羟基,使得分子间的静电作用增强,分子间的静电吸引力增加了在空气与水界面上蛋白质膜的厚度和硬度,从而使的接枝物的泡沫稳定性增强。相比较而言,葡萄糖效果要明显,这可能由于分子量和粘度的不同决定了它们起泡性能间的差异。

图7 接枝产物起泡性的变化Fig.7 Changes on the foaming capability of graft products

图8 接枝产物泡沫稳定性的变化Fig.8 Changes on the foam stability of graft products
3 结论
采用碱溶酸沉法提取绿豆分离蛋白,通过水浴加热制得糖基化产物,并对其功能特性进行了测定。经测定四种糖基化产物的接枝度随时间的延长逐渐上升,葡萄糖的接枝程度大于麦芽糖,红外光谱也验证了蛋白质和糖共价结合成了聚糖分子,且二级结构都产生了变化,α-螺旋结构含量有所升高,β-折叠结构含量有所降低,β-转角结构含量小幅升高,无规卷曲结构含量小幅降低,溶解度呈现上升的趋势,葡萄糖糖基化产物的溶解性要高于麦芽糖糖基化产物,乳化活性和乳化稳定性逐渐得到提高,且麦芽糖改善效果较好,起泡性和起泡稳定性都得到了改善,葡萄糖效果较明显,为充分利用绿豆蛋白这一植物蛋白提供了基本的理论和方法。
[1]Adsuale R N.Chemistry and technology of greengrain[J].CRC Critical Review Food Science and Nutrition,1986,25(1):73-105.
[2]曾志红,王强,林伟静,等.绿豆蛋白营养及功能特性分析[J]. 中国粮油学报,2012,27(6):51-55.
[3]董新红,赵谋明,蒋跃明. 花生 蛋白改性的 研究进展[J]. 中国粮油学报,2011,26(12):109-117.
[4]李文静,尚永彪,夏杨毅.糖基化反应改进肌原纤维蛋白质功能特性的研究进展[J]. 食品科学,2011,32(5):306-309.
[5]SUN Yuanxia,HAYAKAWA S,PUANGMANEE S,et al. Chemical properties and antioxidative activity of glycated α -lactalbumin with a rare sugar,D-allose,by Maillard reaction[J]. Food Chemistry,2006,95:509-517.
[6]GROUBET R,CHOBERT J M,HAERTLE T.Functional properties of milk proteins glycated in mild conditions[J].Science des Aliments,1999,19:423-438.
[7]苏志光,郭顺堂.大豆蛋白的甘露聚糖糖基化研究[J].大豆科学,2010,29(3):486-489.
[8]易建华,朱振宝.绿豆分离蛋白界面特性影响因素研究[J].食品科技,2009,34(8):114-118.
[9]Diftis N,Kiosseoglou V.Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry,2003,81(1):1-6.
[10]Lertittikul W,Benjakul S,Tanaka M.Characteristics and antioxidative activity of maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J]. Food Chemistry,2007,100(2):669-677.
[11]Samoto M,Maebuchi M,Miyazaki C,et al.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry,2007,102(1):317-322.
[12]Ramirez-Suarez J C,Xiong Y L.Rheological properties of mixed muscle/nonmuscle protein emulsions treated with transglutaminase at two ionic strengths[J].International Journalof Food Science & Technology,2003,38(7):777-785.
[13]T Croguennec,A Renault,S Bouhallab,et al.Interfacial and foaming properties of sulfydryl-modified bovine β -lactoglobulin [J].Colloid and Interface Science,2006,302:32-39.
[14]郭兴凤,胡婷婷,王延青,等.大豆蛋白-海藻酸钠共价复合物功能特性研究[J]. 粮食与油脂,2011(3):17-20.
[15]袁德保,李芬芳,杨晓泉,等.大豆蛋白的热处理改性及热聚 集 行 为 研 究 进 展[J]. 现 代 食 品 科 技 ,2012,28(12):1829-1833.
[16]赵瑶兴,孙祥玉. 有机分子结 构光谱鉴定[M].北 京:科 学出版社,2003:8.
[17]张惟杰. 糖复合物生物化学研究[M]. 杭州:浙江大学出版社,2003:193-201.
[18]高红艳,蒋士龙,莫蓓红,等.涂抹再制干酪中蛋白质的二级结构及其对质构的影响[J].中国乳品工业,2009,37(1):36-39.
[19]闫洁,马晓军.不同干燥方式对大豆蛋白二级结构的影响[J]. 食品工业科技,2008,29(5):131-136.
[20]Achouri A,Boye j I,Yaylayan V A,et al.Functional properties of glycated soy 11Sglycinin[J].Journal of Food Science,2005,70(4):269-274.
[21]Babiker E ,Hiroyuki A ,Matsudomi N,et al.Effect of polysaccharide conjugation or transglutaminnase treatment on the allergenicity and functional properties of soy protein[J].Journal of Agricultural&Food Chemistry,1998,46:868-871.
[22]刘燕,裘爱泳.大豆蛋白与多糖的接枝改性[J].中国油脂,2006,31(1):39-41.
[23]胡坤,余晓玲,郑翀.大豆蛋白-半乳甘露聚糖共聚物乳化剂制备条件的优化[J]. 食品与发酵工业,2010,36(6):40-44. [24]王盼盼. 食品中蛋白质的功能特性综述[J]. 肉类研究,2010(5):62-71.
[25]鲁倩,林亲录,梁盈.糖基化修饰对大米蛋白功能性质影响[J]. 粮食与油脂,2013,26(4):11-14.
Effect of glycosylated processing on functional properties of mung bean protein isolate
WANG Xiao,JIANG Lian-zhou*,LI Yang,WANG Zhong-jiang,LIANG Jing,CHEN Yong
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
In order to explore functional properties of mung bean protein isolate by glycosylated processing ,the degree of grafting,infrared spectroscopy,as well as solubility,emulsification and emulsion stability,foaming and foaming stability were investigated.The results demonstrated that compared to maltose ,the grafting degree of the resulting reaction product by using glucose was higher than the maltose,and it was easier to react.Infrared spectroscopy showed sugar and protein covalent complexes were generated.The content of α -helix and β-turn structure increased,while the other two structures decreased.The solubility of mung bean protein isolate after glycosylation was improved,and the result with glucose was better than that with maltose.The emulsifying activity and emulsion stability of mung bean protein isolate after glycosylation were improved,and the reaction with maltose had better results.The foaming and foam stability of mung bean protein isolate after glycosylation were improved,and the effect of glucose was more pronounced.
glycosylation;mungbeanproteinisolate;degreeofgrafting;infraredspectroscopy;functionalproperties
TS214.9
A
1002-0306(2014)20-0097-06
10.13386/j.issn1002-0306.2014.20.012
2014-04-08
王晓(1989-),男,硕士研究生,研究方向:食品工程。
* 通讯作者:江连洲(1960-),男,博士,教授,研究方向:粮食,油脂及植物蛋白工程。
国家自然科学青年科学基金项目(31301501)。
