应用微电极芯片技术评价抗心房颤动药物对兔右心房快速起搏模型的影响*
2014-03-03孙娟黄焰张玲马嵋郭新贵焦昌安郭玉君刘海利李天奇徐文莉马依彤
孙娟 ,黄焰,张玲,马嵋,郭新贵,焦昌安,郭玉君,刘海利,李天奇,徐文莉,马依彤
应用微电极芯片技术评价抗心房颤动药物对兔右心房快速起搏模型的影响*
孙娟 ,黄焰,张玲,马嵋,郭新贵,焦昌安,郭玉君,刘海利,李天奇,徐文莉,马依彤
目的:应用微电极芯片技术筛选和评价抗心房颤动(房颤)药物对兔右心房快速起搏模型的影响。
心房快速起搏;微电极芯片;场电位时程;胺碘酮
(Chinese Circulation Journal, 2014,29:639.)
心房颤动(房颤)是临床上最常见的一种快速性心律失常[1],其发病率随人群年龄的增长而增加。ATRIA研究报道房颤患病率为 0.4%~1%[2]。胡大一等[3,4]的流行病学研究结果显示:中国房颤的患病率为0.77%。其发病率和病死率随着年龄的增长而显著增长。由于房颤发生的确切分子基础和电生理机制仍不清楚,建立与临床具有相似病理生理特点的动物模型,是认识和治疗房颤的有效措施。同时药物筛选模型是发现新药的重要条件,新模型的建立将会带动新型药物的出现。尽管药物筛选模型的研究主要集中在分子细胞水平和转基因动物模型方面,组织水平的筛选模型可以反映生理条件下的抗房颤药物作用,观察药物对病理条件下心脏组织的作用。本文应用微创技术建立快速起搏兔右心房致房颤模型,结合微电极芯片技术,建立组织水平筛选和评价抗房颤药物模型。
1 材料和方法
实验动物及分组:2009-01至2009-06 选择新西兰大白兔32只,体重2.5~3 kg,雌雄不拘,由新疆医科大学动物实验中心提供,动物质量属于一级标准[许可证号:SCXK(新)2003-01]。随机分为4组, 钾离子通道阻断剂Tetraethylammonium组(TEA组,n=8):取24小时快速心房起搏(RAP)后的右心耳切片组织,置入到微电极芯片记录盘中,用改良台式液恒速灌流心脏标本,选择刺激电极施加电压2V,脉宽0.5 ms的脉冲连续刺激30 min。用含有20 mmol/L TEA的改良台式液表面灌流以阻断延迟整流型钾通道( IK )。钾离子通道阻断剂氯化钡组(BaCl2组,n=8):用含有1×10-4mol/L BaCl2的改良台式液灌流心脏标本10 min以阻断内向整流钾通道(Kir)。钾离子通道阻断剂氯化镉组(CdCl2组,n=8): 用含有1 mmol/L CdCl2的改良台式液表面灌流标本10 min后以阻断L-型钙电流(ICa,L )。胺碘酮组(n=8):用含有2×10-6mmol/L 胺碘酮的改良台式液恒速灌流标本10 min。
主要试剂、溶液成分和仪器:改良台式液成分(mmol/L): NaCl 144.0; KCl 5.0; CaCl21.8; MgCl21.0; NaH2PO40.33; Glucose 10.0; HEPES 5.0; pH 7.4。TEA(批号:045K0175), 胺碘酮 (批号:126K1585)均为美国Sigma公司产品,其余试剂均为国产分析纯。微电极芯片(德国),Stimulus Generator刺激仪(德国)。
快速心房起搏致房颤模型建立:用3%戊巴比妥钠(30 mg/kg)经兔耳缘静脉注射麻醉后,静脉推注肝素1000 U抗凝。将兔仰位固定于兔台上,颈部正中切口,分离右侧颈内静脉并切开,近头端结扎,近心端置入一根6 F两极电极(电极间距5 mm),在B超指引下定位,B超纵切引导,保持B超和电极平行,纵切观察电极尖端位置是否正确;再以B超横切引导,观察到电极尖端在右心房内。应用LEAD-2000电生理仪(四川锦江电子科技)记录心内电图,以心内电生理图出现高大A波小V波为理想记录图,固定电极导管。以600 次/分的固定频率进行快速心房起搏24小时,脉宽 0.5 ms,强度 4V。起搏诱发房颤判断标准:心脏电刺激时,记录体表Ⅱ导联心电图,诱发房颤后同步记录左、右心房电图。持续时间> 5min的房颤为持续性房颤。当实验动物生命体征不平稳,如出现心率缓慢、呼吸频率不稳定时结束实验。 快速起搏致房颤动物模型制作过程中,3只新西兰大白兔死于电极尖端穿透心房游离壁心脏破裂,2只因呼吸衰竭死亡,补充同体重量的5只大白兔。其余实验动物均在实验时间完成实验检查。制作模型成功率75%,房颤持续时间5~10 s,给予冷盐水敷于心脏可终止房颤的持续。
心房组织标本制备:新西兰大白兔快速心房起搏24小时后,迅速开胸取心脏剪下右心耳切片,组织厚度500 μm,用银丝圈将标本固定在微电极芯片记录系统,改良台式液恒速(3 ml/min)灌流心房组织30 min,温度保持在37℃。Stimulus Generator刺激仪发出刺激强度在阈上二倍,波宽0.5 ms,频率1 HZ的脉冲做驱动刺激,设置27号和36号电极分别为刺激电极的正负极。标本稳定30 min后开始记录钾通道阻断剂和抗心律失常药物对心房场电位时程的影响。
微电极芯片记录场电位时程:微电极芯片是以8×8阵列的形式镶嵌入60个氮化钛电极,电极尖端直径10 μm,相邻电极间隔100μm。植于芯片底部的微电极记录心脏组织切片电活动得到的原始信号,经放大器MEA1060(增益1200倍)调制后,由模数转换卡MC-card数字化,使用软件MCRack处理心肌组织场电位各项参数:第一个正向峰值( FPpre)、第一个最大负向峰值( FPmin)、最后正向最大峰值( FPmax)以及场电位时程( FPdur,从FPmin到FPmax的时间)。
统计学分析:所有数据均采用SPSS 16.0软件处理,计量资料以均数±标准差表示,两组间比较采用给药前、后配对样本的t检验,P<0.05为差异有统计学意义。
2 结果
TEA和BaCl2对快速心房起搏兔右心耳场电位时程的影响: TEA组用TEA改良台式液灌流心房组织10 min后,右心耳场电位时程由(176.67±8.66)ms延长到(196.11±10.76)ms,场电位时程延长了10.55 ms,差异有统计学意义(P=0.012)。BaCl2组用BaCl2改良台式液灌流后兔右心耳场电位时程由(182.22±12.87)ms延长到(191.11±13.09)ms,场电位时程延长了8.89 ms,差异有统计学意义(P=0.039)。图1
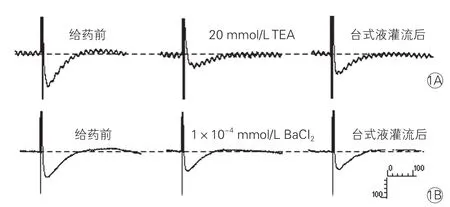
图1 给予TEA和BaCl2前后兔右心耳场电位时程变化
CdCl2对快速心房起搏兔右心耳场电位时程的影响:CdCl2组给与CdCl2改良台式液灌流后兔右心耳场电位时程由(178.33±7.85)ms延长到(206.67±9.70)ms,差异有统计学意义(P=0.0015)。图2

图2 给予CdCl2前后兔右心耳场电位时程变化
胺碘酮对快速心房起搏兔右心耳场电位时程的影响:胺碘酮组用胺碘酮改良台式液灌流后兔右心耳场电位时程由(167.38±13.67)ms延长到(185±15.14)ms,场电位时程延长了17.62 ms,差异有统计学意义(P=0.002)。图3

图3 给予胺碘酮前后兔右心耳场电位时程变化
3 讨论
心肌细胞在药物作用下,可对心肌细胞的细胞膜上蛋白、受体、细胞内的线粒体、微管等产生作用,这些变化可以综合地体现在细胞的电生理功能的变化上。微电极阵列(MEA)能检测各种离子通道在兴奋水平时的离子运动、细胞间的信号传递等。由于检测时,细胞和电极紧密藕合,微电极阵列能灵敏地检测到药物对细胞电生理信号的影响,并且传感器具有稳定性,因此可发展成一个基于生物电生理信号分析的可靠的药物毒性评估平台,根据心肌细胞的电生理功能变化来对分析药物毒性等。目前国内资料显示人们已建立众多房颤模型,如以犬等大型动物为代表的房颤模型,包括药物房颤模型和电刺激模型。以中型动物兔为代表的房颤模型,如兔急性心房颤动模型,兔慢性心房颤动模型,离体兔心房颤动模型。其缺点是兔心房过小难以容纳多折返环,不易模拟房颤的发生和维持。本实验与之对应的微电极芯片评价电生理指标为场电位时程。实验建立快速起搏右心房致房颤模型与临床观测的房颤具有一定共性,包含结构和功能两方面的异常;模型能被诱导出房颤并能维持,房颤不会自行终止,而干预手段能有效终止。
理想的抗心律失常药物应对诱发心律失常的多个靶点有作用;应对诱发心律失常的最佳靶点作用强调整动作电位时程恢复正常或略延长。通道蛋白水平分子的重构对房颤患者心房动作电位和有效不应期的缩短有重要意义,而多离子通道阻滞剂对心脏Na+、K+、Ca2+等多个离子通道有不同程度的调控作用,可使失调的离子通道功能恢复平衡,具有较低的致心律失常副作用[5,6]。有研究证实,房颤时心房有效不应期缩短除了与ICa,L、Ito、INa等电流减弱有关外,还与钾离子通道基因表达及活性改变有关[7,8]。IK有三种类型:快速延迟整流钾电流(IKr)、缓慢延迟整流钾电流(IKs)和超快延迟整流钾电流(IKur)。本实验给予TEA作用右心耳组织致场电位时程延长。依据结果推测,IK 参与了房颤电重构中的钾通道重构。给予BaCl2阻断Kir,右心耳场电位时程延长。结果提示,快速起搏兔右心耳可能导致心房肌Kir减少,进而参与心房有效不应期(AERP)的缩短和房颤的维持,使用Kir特异性阻断剂后,场电位时程延长,相应电重构的电生理指标心房有效不应期延长,阻止房颤的进一步发生。实验给予CdCl2作用于心房组织,微电极芯片记录中表现为场电位时程延长。以具有多离子通道阻滞效果的胺碘酮为代表的复合型Ⅲ类药物成为近年来抗心律失常药物研究的热点。胺碘酮为多通道阻滞剂,对于包括钠通道、L 型钙通道以及钾通道 IKr、IKs在内的多个心肌细胞膜离子通道均有阻滞作用[9],可延长动作电位时程和有效不应期,延长心肌复极化时间。胺碘酮是目前唯一无逆频率依赖性延长动作电位时程、心房有效不应期的药物。在心肌细胞对开放和关闭状态的IKs均有阻滞作用,但主要抑制开放状态的IKs,这可能是其在快速心率时维持场电位时程延长作用的重要原因。本实验给予胺碘酮显示,右心耳场电位时程延长。抗心律失常药物筛选评价指标包括动作电位时程延长,钾、钠、钙电流的减少。本实验中微电极芯片记录指标场电位时程与动作电位时程均可客观评价生理、病理状态下心脏组织电生理改变和反映离子电流的变化。目前国内外文献尚未报道有关应用微电极芯片技术测量病理状态下和病理模型后心房组织场电位时程的可靠、真实的实验数据。本实验应用微电极芯片技术在接近房颤病理条件下,给予钙和钾通道阻断剂记录其对场电位时程变化的影响。通过区分药物对不同观测指标的作用及影响程度可直接判断在抗房颤药物中的分类。根据药物对场电位时程的作用,可初步预测到该药抗房颤可能存在的不良反应。由于各离子通道在不同病理进程中的变化并不是同步的,故以怎样的程度和比例阻断不同的离子通道才能成为理想的抗心律失常药。
多离子通道阻滞剂是人们研究Ⅲ类抗心律失常药物时提出的。临床上,Ⅲ类抗心律失常药物的致心律失常作用具有明显差异。随着临床研究复杂性的增加, 临床信息和基础药物研究之间鸿沟也在不断加深,转化医学作为致力于克服这种困难的新型研究模式,加快候选药物从实验室走向临床研究的步伐。随着人们对抗心律失常药物致心律失常机制的不断深入认识,新的抗心律失常药物概念的提出,以及更加完善的药物安全评价指标的发现,人们会找到更加安全、有效的抗心律失常药物。
[1] Furberg CD, Psaty BM, Manolio TA, et al. Prevalence of atrial fibrillation in elderly subjects(the Cardiovascular Health Study). Am J Cardiol, 1994, 74: 236-241.
[2] Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fbrillation in adults: National implications for rhythm management and stroke precaution: The Auticoagulation and Risk Factors in Atrial Fibrillation(ATRIA) study. J Am Med Assoc, 2001, 285 : 2370-2375.
[3] 周自强, 胡大一, 陈捷, 等. 中国心房颤动现状的流行病学研究.中华内科杂志, 2004, 43: 491.
[4] 胡大一, 杨进刚. 心房颤动的现代观点. 中国循环杂志, 2004, 19: 323-324.
[5] 张建成, 黄从新, 邓玉莲, 等. 心房颤动患者离子通道蛋白质重构的研究. 中国循环杂志, 2002, 17: 297-299.
[6] Johnson DM, de Jong MM, Crijns HJ, et al. Reduced ventricular proarrhythmic potential of the novel combined ion-channel blocker AZD1305 versus dofetilide in dogs with remodeled hearts. Circ Arrhythm Electrophysiol. 2012, 5: 201-209.
[7] Bosch RF, Scherer CR. , Rüb N, et al. Molecular mechanisms of early electrical remodeling: transcriptional downregulation of ion channel subunits reduces ICa, L and Itoin rapid atrial pacing in rabbits. J Am Coll Cardiol, 2003, 41: 858 - 869.
[8] Brundel BJ, Van Gelder IC, Henning RH, et al. Alterations in potassium channel gene expression in atria of patients with persistent and paroxysmal atrial fibrillation: differential regulation of protein and mRNA levels for K+channels. J Am Coll Cardiol, 2001, 37: 926-932.
[9] Xu CQ, Dong DL, Du ZM, et al. Comparison of the anti-arrhythmic effects of matrine and berbamine with amiodarone and RP58866. Acta Pharm Sin, 2004, 39: 691-694.
Evaluation of Anti-atrial Fibrillation Drug With Multi Ion Channel Targets by Micro-electrode Chip Technology in Experimental Rabbit Model
SUN Juan, HUANG Yan, ZHANG Ling, MA Mei,GUO Xin-gui, JIAO Chang-an, GUO Yu-jun, LIU Hai-li, LI Tianduo, XU Wen-li, MA Yi-tong.
Department Cardiology, Xinjiang Medical University, Urumqi (830011), Xinjiang, China
MA Yi-tong, Email: myt-xj@163.com
Objective: To evaluate and screen the anti-atrial fi brillation drug with multiion channel targets by micro-electrode chip technology in a rapid atrial pacing (RAP) rabbit model.Methods: A total of 32 rabbits were randomly divided into 4 groups, n=8 in each group. Potassium channel blocker (TEA) group, Potassium channel blocker (BaCl2) group, Potassium channel blocker (CdCl2) group and Amiodarone group.The electrode was inserted into right atrium via internal jugular vein with rapid right atrial pacing (600 beat/min) and the effect of each anti-atrial fi brillation drug on fi eld action potential (fAPD) were measured in different groups.Results: With 24 hour RAP, the fAPD was prolonged from (176.67 ± 8.66) ms to (196.11 ± 10.76) ms, P=0.012 in TEA group; from (182.22 ± 12.87) ms to (191.11 ± 13.09) ms, P=0.039 in BaCl2group; from (178.33±7.85) ms to (206.67 ± 9.70) ms, P=0.0015 in CdCl2group; from (167.38 ± 13.67) ms to (185 ± 15.14) ms, P=0.002 in Amiodarone group.Conclusion: RAP induced atrial fibrillation in experimental rabbit model is a simple and feasible method for screening the anti-atrial fibrillation drugs, combining with micro-electrode chip technology, it might be used for developing the new product.
Atrial rapid pacing; Micro-electrode chip; Field action potential duration; Amiodarone
2013-08-28)
(编辑:汪碧蓉)
新疆维吾尔自治区科技支疆项目(2013911119)
830011 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第一附属医院 临床博士后流动站(孙娟),心脏中心(张玲、马嵋、郭玉君、刘海利、马依彤) ;复旦大学附属华东医院(黄焰、郭新贵、焦昌安、李天奇、徐文莉)
孙娟 主治医师 博士 研究方向:心脏电生理 Email: sunjuandee@126.com 通讯作者:马依彤 Email: myt-xj@163.com
R445.1
A
1000-3614( 2014) 08-0639-04
10.3969/ j. issn. 1000-3614. 2014.08.020
方法:兔32只随机分为4组:钾离子通道阻断剂 Tetraethylammonium组(TEA组,n=8),钾离子通道阻断剂氯化钡组(BaCl2组,n=8),钾离子通道阻断剂氯化镉组(CdCl2组,n =8),胺碘酮组(n=8)。经颈内静脉将电极置入右心房,以600次/分行心房快速起搏(RAP),给予TEA、BaCl2、CdCl2和胺碘酮观察抗房颤药物作用的离子通道对电生理指标场电位时程(fAPD)的影响。
结果: 24小时快速起搏后,20 mmol/L TEA 使场电位时程由(176.67±8.66)ms延长到(196.11±10.76) ms(P=0.012)。1×10-4mol/L BaCl2使 场电位时程由(182.22±12.87)ms延长到(191.11±13.09)ms(P=0.039)。CdCl2使场电位时程由(178.33±7.85)ms延长到(206.67±9.70)ms(P=0.0015)。2×10-6mmol/L 胺碘酮灌流心脏组织, 场电位时程由(167.38±13.67)ms延长到(185±15.14)ms(P=0.002),差异有统计学意义。
结论:快速起搏兔右心房致房颤模型是一种简单可行的抗房颤药物筛选模型,结合微电极芯片技术有可能用于抗房颤药物开发的早期快速筛选。
