氯沙坦影响大鼠心肌梗死后心室重塑的机制研究*
2014-03-03崔贞玉韩素霞冯磊董晓光郭李平常建梅
崔贞玉,韩素霞,冯磊,董晓光,郭李平,常建梅
氯沙坦影响大鼠心肌梗死后心室重塑的机制研究*
崔贞玉**,韩素霞,冯磊,董晓光,郭李平,常建梅
目的:探讨血管紧张素转换酶(ACE)2对大鼠心肌梗死(MI)后心肌组织中血管紧张素Ⅱ(AngⅡ)的表达与心肌重塑的影响,进一步阐明氯沙坦对大鼠MI后心肌重塑的作用机制。
血管紧张素转换酶2;心肌梗死;血管紧张素Ⅱ;心肌重塑;氯沙坦
(Chinese Circulation Journal, 2014,29:629.)
心血管疾病严重危害着人类健康,据《中国心血管病报告》我国心血管疾病患者已达2.3亿,每年约300万人死于心血管病,位居死亡原因首位,发病率不断增加。统计资料显示,全球每年有1700万人死于心血管疾病,其中一半以上死于急性心肌梗死(AMI)。近十年来,我国AMI的发病率呈明显上升趋势,已接近国际平均水平。AMI起病突然,急性期死亡率约为30%[1]。众所周知,血管紧张素转化酶-血管紧张素Ⅱ-血管紧张素Ⅱ1型受体(ACE-AngⅡ-AT1)受体轴可使全身微动脉和静脉收缩,动脉血压增高,回心血量增加,AngⅡ是已知最强的缩血管活性物质之一。AngⅡ与AT1结合,介导了心室重塑过程中一系列生物化学反应[2]。2000 年欧洲Donoghue 等[3]报道了一种新发现的与人类ACE相关的羧肽酶, 称之为血管紧张素转换酶 (ACE) 2,ACE2 在结构上有42%的成分与ACE 保持一致。自发现ACE2 以来,越来越多的证据显示,ACE2在调节心脏和血管生理功能方面发挥重要作用。本文探讨ACE2对大鼠心肌梗死(MI)后心肌组织中AngⅡ的表达与心肌重塑的影响,进一步阐明氯沙坦对大鼠MI后心肌重塑的作用机制。
1 材料与方法
材 料:2012-03至2013-12选 取SPF级、 体 重(200±20) g、雄性SD大鼠32只(购自新疆医科大学实验动物研究中心;伦审号:IACUC-20121127010);氯沙坦钾片(杭州默沙东制药有限公司生产)。
大鼠心肌梗死(MI)模型的建造:将大鼠采用随机数字表法随机分为4组:假手术组、MI组、MI+氯沙坦小剂量组和MI+氯沙坦大剂量组,每组8只。术前禁食12 h。将氯胺酮、阿托品、地西泮各1支混合后稀释一倍,按4 ml/kg腹腔内麻醉,固定,记录心电图。经口腔行气管插管,接呼吸机。消毒切口,铺无菌单,在左侧2、3肋间开胸,于左心耳右下缘1 mm、肺动脉圆锥左缘处用6号带针缝线结扎冠状动脉前降支,心电图显示不同肢体导联QRS波增宽增高,ST段弓背向上抬高0.2 mV以上。肉眼观察结扎后梗死区变苍白,则提示结扎成功。结扎成功后关胸。假手术组在心脏相应部位挂线,不结扎。4组术后24 h内给予吗啡4 mg/(kg.6 h)肌注镇痛,术后3天连续给予青霉素50万IU/(kg.d)肌注预防感染。于术后24 h开始灌胃给药,给药期1个月。假手术组和MI组给予蒸馏水等量灌胃,MI+氯沙坦小剂量组给予氯沙坦10 mg/(kg.d),MI+氯沙坦大剂量组给予氯沙坦20 mg/(kg.d)。
超声心动图检查:心肌取材前,各组大鼠行超声心动图检查,测量指标有:左心室收缩末期容积(LVESV)、左心室舒张末期容积(LVEDV)。计算左心室射血分数(LVEF)。
左心室重量指数测定及取材:完成血流动力学测定后,将大鼠称重,腹腔内麻醉后腹主动脉放血致死,迅速打开胸腔,在心脏未停跳之前注入10% KCl液2~3 ml,使心脏于舒张末期停跳,取出心脏置于冰盐水中,冲洗干净,沿室间隔剪去右心室,滤纸吸干后称取左心室(包括室间隔)重量,计算左心室重量指数(LVMI)。最后,将左心室即心尖部心肌组织纵剖为二,分别置于液氮和4%多聚甲醛中保存。
心肌组织形态学观察:组织于4%多聚甲醛中固定,24 h后换一次液,48 h后进行石蜡包埋,切片。行苏木素伊红(HE)染色,光镜下观察心肌组织梗死后心肌细胞肿胀、坏死和炎症细胞浸润情况。
定量逆转录—聚合酶链反应(RT-PCR):用Trizol试剂盒(瑞士roche公司)按说明书抽提心肌组织总RNA,逆转录试剂盒(瑞士roche公司)将1 μg RNA按其说明书逆转录为cDNA,最后以cDNA为模板进行PCR扩增。引物设计参考文献,由上海生工公司合成并纯化,ACE2引物: 上 游 5'-GTGGAGCACTGACTGGAGC-3',下 游 5'-GACAGGAGGCTCGTAAGGTG-3',扩 增 片 段 长: 403 bp;AngⅡ 引 物: 上 游5'-TTGGGTGCTGAGGCAAATCT-3', 下 游5'-TTGGGTGCTGAGGCAAATCT-3', 扩 增 片段长:244 bp;β肌动蛋白(β-actin)引物:上游 5’-CCCTGTGCTGCTCACCGA-3’, 下 游5’-ACAGTGTGGGTGACCCCGTC-3’,扩增片段长度:186 bp。β-actin的反应体系为40μl,AngⅡ和ACE2的反应体系为25 μl。目的基因的扩增条件:95℃下预变性5 min后,95℃变性30 s,最适退火温度30 s,72℃延伸30 s,35个循环后,72℃延伸7 min。其中AngⅡ、ACE2和β-actin的退火温度分别为60℃、55℃、57℃。取5 μl PCR产物于2%琼脂糖凝胶85 V电泳30 min。凝胶用全能型凝胶成像分析仪(美国Bio-Rad公司)摄像,录入计算机,用凝胶成像分析系统分析电泳条带的面积和平均灰度,计算样本的灰度值(面积×平均灰度),以各组β- actin灰度值为内参照,计算各指标的mRNA的相对表达量(相对灰度%)。
蛋白印迹(Western blot)法:用Western blot法检测心肌组织内ACE2和AngⅡ的蛋白表达量。提取心肌蛋白:取冷冻待用的心肌组织,加入10倍体积的蛋白裂解液+蛋白酶抑制剂,组织匀浆器匀浆,冰上裂解30 min后,超声粉碎机超声2 min,13000 r/min离心收集上清。用BCA蛋白定量试剂盒(北京天根公司)测定总蛋白含量,操作方法按照试剂盒说明书进行。确定电泳上样量50 μg,行聚丙烯酰氨凝胶电泳,积层胶电压80 V 15 min,分离胶电压120 V 1 h。电泳后用湿转法转膜5 h,将蛋白转移NC膜上。3%脱脂牛奶封闭1 h。膜用ACE2(1:1000,多克隆鼠抗)、AngⅡ(1:200,多克隆兔抗)抗体于4℃孵育过夜。以β-actin(1:500,多克隆鼠抗)作为内参对照。0.05%TBST洗液洗膜3次,每次5 min。分别以对应二抗常温孵育2 h。再用0.05%TBST洗膜3次,每次5 min。底物二氨基联苯胺(DAB)呈色法显色。各蛋白表达水平经全能型凝胶成像分析仪检测分析其吸光度值(A值),并以其内参的比值作为半定量指标进行各组间的比较。
统计学方法:所有统计数据均采用Excel软件及统计软件SPSS 16.0处理。数据采用表示,两组间比较采用t检验。多组间差异采用方差分析。多组间两两比较采用q检验。以 P<0.05为差异有统计学意义。
2 结果
大鼠心肌梗死前后心电图结果:大鼠MI后与MI前相比, ST段抬高,QRS波增宽显著。图1

图1 大鼠心肌梗死前、后心电图结果
超声心动图结果:①MI组与假手术组比较,左心室重量指数升高、左心室射血分数降低,差异均有统计学意义(P<0.05);②MI+小剂量氯沙坦组与MI组比较,左心室重量指数降低、左心室射血分数升高,差异均有统计学意义(P<0.05);③ MI+大剂量氯沙坦组与MI+小剂量氯沙坦组比较,左心室重量指数降低、左心室射血分数升高,差异均有统计学意义(P<0.05)。表1
表1 各组大鼠超声心动图结果比较

表1 各组大鼠超声心动图结果比较
注:与假手术组比较*P<0.05;与MI组比较ΔP<0.05;与MI+小剂量氯沙坦组▲P<0.05。MI:心肌梗死
MI+大剂量氯沙坦组 (n=8)体重 (g) 305.3±11.4 268.3±18.8 282.9±16.7 284.8±17.1左心室重量 (mg) 667.3±65.8 795.7±86.3 752.8±78.4 721.9±80.2左心室重量指数 (mg/g) 2.15±0.39 3.12±0.22* 2.79±0.26Δ 2.46±0.21▲左心室收缩末容积 (ml) 0.26±0.56 0.67±0.29 0.57±0.27 0.41±0.24左心室舒张末容积 (ml) 0.92±0.21 1.26±0.52 1.23±0.43 1.03±0.29左心室射血分数 (%) 69.34±2.3 44.83±2.6* 52.20±3.9Δ 60.21±4.1▲参数 假手术组(n=8) MI组(n=8) MI+小剂量氯沙坦组 (n=8)
病理形态变化:HE染色显示MI组梗死区心肌细胞肿胀、变形、破裂、排列杂乱,细胞质流入细胞间隙,几乎没有明显的残存心肌细胞,细胞间质增生,炎症细胞浸润明显;MI+氯沙坦大剂量组心肌细胞坏死少见,细胞肿胀减轻,心肌纤维排列紊乱,部分肌纤维断裂,伴少量炎性细胞浸润;MI+氯沙坦小剂量组居中;假手术组心肌纤维排列规则,无病理改变(图2)。
RT-PCR结果(PCR条带灰度值):①心尖部心肌组织ACE2/β-actin的表达量:MI组高于假手术组;MI+小剂量氯沙坦组和MI+大剂量氯沙坦组均高于MI组,且MI+大剂量氯沙坦组较MI+小剂量氯沙坦组升高更显著,组间比较差异均有统计学意义(P均<0.05)。②心尖部心肌组织AngⅡ/β-actin的表达量:MI组高于假手术组;MI+小剂量氯沙坦组和MI+大剂量氯沙坦组均低于MI组,且MI+大剂量氯沙坦组较MI+小剂量氯沙坦组降低更显著,组间比较差异均有统计学意义(P均<0.05)。表2、图3、4
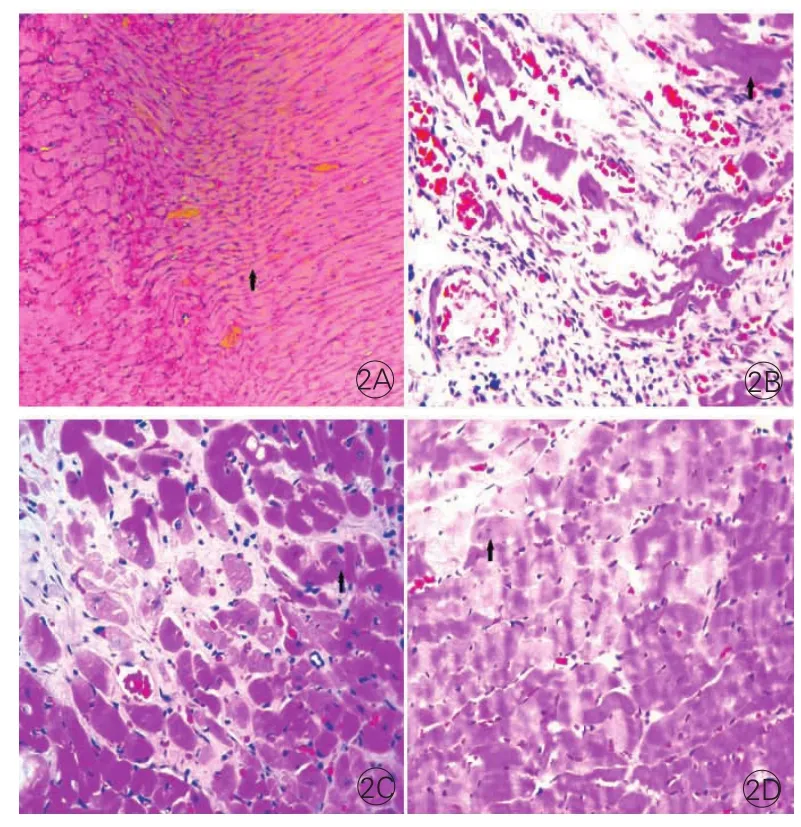
图2 各组大鼠心肌组织苏木素伊红染色结果(×400)
表2 逆转录-聚合酶链反应条带灰度值及蛋白印迹条带灰度值(n=8,
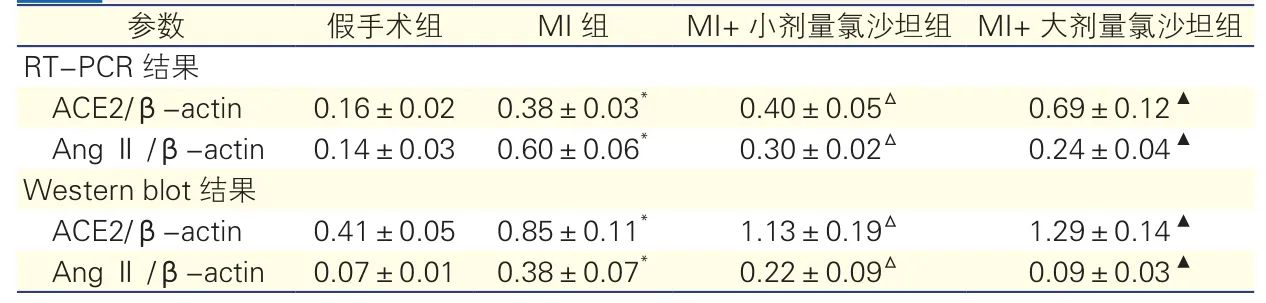
表2 逆转录-聚合酶链反应条带灰度值及蛋白印迹条带灰度值(n=8,
注:与假手术组比较*P<0.05;与MI组比较ΔP<0.05;与MI+小剂量氯沙坦组比较▲P<0.05。RT-PCR:逆转录-聚合酶链反应 Western bolt:蛋白印迹 ACE2/β-actin:血管紧张素转换酶2/ β肌动蛋白 AngⅡ/β-actin:血管紧张素II/β肌动蛋白 MI:心肌梗死
参数 假手术组 MI组 MI+小剂量氯沙坦组 MI+大剂量氯沙坦组RT-PCR结果ACE2/β-actin 0.16±0.02 0.38±0.03* 0.40±0.05Δ 0.69±0.12▲AngⅡ/β-actin 0.14±0.03 0.60±0.06* 0.30±0.02Δ 0.24±0.04▲Western blot结果ACE2/β-actin 0.41±0.05 0.85±0.11* 1.13±0.19Δ 1.29±0.14▲AngⅡ/β-actin 0.07±0.01 0.38±0.07* 0.22±0.09Δ 0.09±0.03▲

图3 各组大鼠血管紧张素转换酶2的逆转录—聚合酶链反应结果

图4 各组大鼠血管紧张素Ⅱ的逆转录—聚合酶链反应结果
Western blot结果(Western blot条带灰度值):心尖部心肌组织ACE2/β-actin的表达量:MI组高于假手术组;MI+小剂量氯沙坦组和MI+大剂量氯沙坦组均高于MI组,且MI+大剂量氯沙坦组较MI+小剂量氯沙坦组升高更显著,组间比较差异均有统计学意义(P均<0.05)。心尖部心肌组织AngⅡ/ β-actin的表达量:MI组高于假手术组;MI+小剂量氯沙坦组和MI+大剂量氯沙坦组均低于MI组,且MI+大剂量氯沙坦组较MI+小剂量氯沙坦组降低更显著,组间比较差异均有统计学意义(P均<0.05)。表2、图5、6

图5 各组大鼠血管紧张素转换酶2的蛋白表达结果
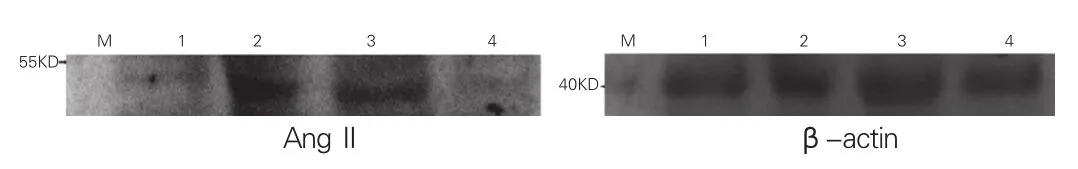
图6 各组大鼠血管紧张素‖的蛋白表达结果
3 讨论
AMI后心室重塑主要表现为梗死区膨展和非梗死区失代偿性肥厚,严重影响了心脏的收缩和舒张功能。本研究以左心室收缩末期容积、左心室舒张末期容积和左心室射血分数来反映心功能,以左心室重量和左心室重量指数反映心肌肥厚程度,以病理结果反映心肌细胞损伤程度。结果提示AMI导致了明显的心室重塑和心脏功能损害。以往研究提示AngⅡ在心肌梗死后心室重塑中起重要的作用。AMI后,心肌局部AngⅡ增加,可导致胶原合成增加,加速心肌纤维化的进程[4]。本研究中,MI组心肌组织AngⅡ水平明显高于假手术组,ACE2表达量较假手术组略有增加,进一步证实了急性MI后心室重塑和心功能受损与心肌组织中 肾素-血管紧张素系统(RAS)的激活有关。根据以往研究推测MI组ACE2升高是由心肌梗死后慢性长期的组织修复导致[5]。
近年来研究发现了RAS系统中一些新成员,如肾素受体、Ang 1-7及其受体Mas、Ang2-7、Ang3-7、AngⅢ、AngⅣ等。在这些新发现的成员中,ACE2、Ang1-7及其受体MAS构成了一个新的RAS分支:ACE2-Ang1-7-MAS受体轴,该轴是与ACE-AngⅡ-AT1受体轴这一作用明确的途径相抗衡的生物学分支,ACE2是降解AngⅡ产生Ang1-7的主要效应酶[6],发挥着拮抗AngⅡ的作用,舒张血管、抑制心肌细胞增殖、逆转心室重塑、改善心脏功能、抗炎抗凝和抗心律失常[7-9]。因此ACE2成为备受关注的热点。近年来的研究工作还提出了“局部RAS”的新概念,即RAS不仅存在于循环系统中,还存在于其他组织器官,如心脏、血管平滑肌、脑、肾脏、肾上腺、骨骼肌、性腺等。心脏不仅是RAS的重要靶器官,而且是合成RAS的重要场所,已经证实心肌组织可以自身合成RAS的大部分成员。ACE基因表达广泛分布于全身循环系统和局部组织器官中,而ACE2的表达具有高度的组织特异性, 主要局限在心脏和肾脏内皮细胞、远端肾小管上皮细胞和睾丸, 也可在消化等其他一些有限的器官。并且有研究表明,这种相对独立的局部RAS通过旁分泌和自分泌的方式调节心血管活动,比循环RAS在心血管活动的调解中起着更直接、更重要的生理与病理作用[10]。
氯沙坦是第一个AT 1受体拮抗剂类的抗高血压药物。本研究结果显示,氯沙坦的药物作用使得各组大鼠心肌组织中ACE2表达量产生了梯度差异,呈剂量依赖性增加,而AngⅡ表达量则呈剂量依赖性减少,我们推测氯沙坦通过增加大鼠MI后心肌组织中ACE2的表达量来抑制AngⅡ的表达,进一步抑制心肌重塑。Kassiri等[11]研究均证实,在ACE2基因敲除MI小鼠体内,表现出早期的心肌肥厚和严重的心室重塑,可以通过厄贝沙坦治疗来减少NADPH氧化酶活性、MI面积、心肌细胞炎症等来增加MI后的心功能。Sukumaran等[12]分别从蛋白和基因水平印证了替米沙坦通过增加ACE2/Ang1-7的表达量来抑制实验性自身免疫性心肌炎性大鼠的心室重塑。Burrell等[5]研究结果发现小鼠梗死边缘与未梗死交界区和梗死后存活心肌中ACE2 基因表达显著增加,提示ACE2与心肌重塑的关系。王江等[13]研究发现心衰大鼠心肌组织ACE2表达上调,贝那普利可进一步刺激ACE2表达增强。徐晤等[14]研究发现猪心房颤动结构重构与ACE2表达失衡密切相关,替米沙坦可明显增加ACE2的表达量。本研究结果与以往研究结果一致。
本试验通过观察AT 1受体拮抗剂氯沙坦对MI后大鼠纤维化心肌组织中ACE2表达的影响,探讨并证实了氯沙坦对大鼠MI后心肌组织的可能作用机制,为阐明疾病的发病提供新机制,对疾病的治疗提供新思路。
[1] Moran A, Gu D, Zhao D, et a1. Future cardiovascular disease in china: markov model and risk factor scenario projcottons from the coronary heart disease policy model-china. Circ Cmdiovasc Qual Outcomes, 2010, 3: 243-252.
[2] Villarreal FJ, KimNN, Ungab GD, et a1. Identification of functional angiotensin II receptors on rat cardiac fibroblasts. Circulation, 1993, 88: 2849-2861.
[3] Donoghue M, Hsieh F, Baronas E, et a1. A novel angiotensin converting enzyme related carboxypeptidase(ACE2) converts angiotensinⅠ to angiotensin 1-9. Circ Res, 2000, 87: E1-9.
[4] Nomoto T, Nishina T, Miwa S, et a1. Angiotensin converting enzyme Inhibitor helps prevent late remodeling after left ventficular aneurysm repairin rats. Circulation, 2002, 106: 1115-1119.
[5] Burrell LM, Risvanis J, Kubota E, et a1. Myocardial infarction increases ACE2 expression in rat and humans. Eur Heart J, 2005, 26: 369-375.
[6] Der Sarkissian S, Huentelman MJ, Stewart J, et a1. ACE2: a novel therapeutic target for cardiovaJcular disease. Mol Biol, 2006, 91: 163-198.
[7] Zhao YX, Yin HQ, Yu QT, et a1. ACE2 Overexpression Improves Left Ventricular Remodeling and Function in Rats model of Myocardial Infarction. Hum Ceme Ther, 2010, 21: 1545-1554.
[8] Ferreira AJ, Castro CH, Guatimosim S, et a1. Attenuation of isoproterenol induced cardiac fibrosis in transgenic rats harboring an angiotensin-(1-7)-producing fusion protein in the heart. Ther Adv Cardiovasc Dis, 2010, 4: 83-96.
[9] Tallant EA, Ferrario CM, Gallagher PE, et a1. Angiotensin-( 1-7) inhibits growth of cardiacmyocytes through activation of the mas receptort. Am J Physiol Heart Circ Physiol, 2005, 289:1560-1566.
[10] Turner AJ, Tipnis SR, Jodie L, et a1. ACEH/ACE2 is a novel mammalian metallocarboxypeptidase and a homologue of angiotensin-converting enzyme insensitive to ACE inhibitors. Cam J Pharmacol, 2002, 80: 346-353.
[11] Kassiri Z, Zhong J, Guo D, et a1. Loss of angiotensin-converting enzyme 2 accelerates maladaptive left ventricular remodeling in response to myocardial infarction. Circ Heart Fail, 2009, 2: 446-455.
[12] Sukumaran V, Veeraveedu PT, Gurusamy N, et a1. Cardioprotective effects of telmisartan against heart failure in rats induced by experimental autoimmune myocarditis through the modulation of angiotensin-converting enzyme-2/angiotensin 1-7/mas receptor axis. Int J Biol Sci, 2011, 7: 1077-1092.
[13] 王江, 宋熔. 田颖, 等. 贝那普利对心肌梗死后心力衰竭大鼠心肌组织血管紧张素转换酶2表达的影响. 中国循环杂志, 2008, 23: 135-138.
[14] 徐晤, 王志荣, 李思召, 等. 猪实验性心房颤动模型心房重构及替米沙坦干预的影响. 中国循环杂志, 2013, 28: 144-147.
Effect of Losartan on Myocardial Remodeling in Myocardial Infarction Rats’ Model
CUI Zhen-yu***, HAN Su-xia, FENG Lei, DONG Xiao-guang, GUO Li-ping, CHANG Jian-mei.
Department of Cardiology, The Fifth Aff i liated Hospital of Xinjiang Medical University, Urumqi (830054), Xinjiang, China
HAN Su-xia, Email: Email:hxs0016@163.com
Objective: To investigate the effect of losartan on angiotensin II (Ang II) expression and myocardial remodeling in myocardial infarction (MI) rats’ model.Methods: A total of 32 SD male rats were divided into 4 groups, Sham operation group, MI group, MI with losartan 10mg/(kg.d) group and MI with losartan 20mg/(kg.d). n=8 in each group. MI model was established and the electrocardiogram changes before and after MI were recorded, hemodynamic indexes were detected at 4 weeks after MI, pathological changes of myocardial tissue were examined by HE staining. The myocardial mRNA and protein expressions of ACE2 and Ang II were detected by RT-PCR and Western Blot analysis.Results: Compared with Sham operation group, MI group showed increased LVMI and decreased LVEF P<0.05; the above changes were getting better in both MI with losartan groups in a dose-dependent manner. The pathological examination presented that MI group had myocardial cell swelling, fracture, hyperplasia and inflammatory cell infiltration, those damages were less in MI with losartan groups in a dose-dependent manner, Sham operation grouphad no pathological changes. Compared with Sham operation group, the mRNA and protein expressions of Ang II were obviously higher in MI group, P<0.05 and the expressions were decreased in MI with losartan groups in a dosedependent manner; the mRNA and protein expressions of ACE2 were slightly increased in MI group and the expressions were further increased in MI with losartan groups in a dose-dependent manner.Conclusion: Losartan could increase ACE2 expression and therefore, inhibit Ang II expression and improve the ventricular remodeling in MI rats’ model.
Angiotensin converting enzyme2; Myocardial infarction; Angiotensin II; Myocardial remodelling; Losartan
2013-11-29)
(编辑:梅平)
国家自然科学基金(项目批准号:81060023,申请代码:H0207)
830054 新疆维吾尔自治区乌鲁木齐市,新疆医科大学第五附属医院 心血管内科
崔贞玉 住院医师 硕士研究生 研究方向:ACE2、ARB类药物与心肌梗死后心室重塑的关系 Email:616366039@qq.com 通讯作者:韩素霞Email: hxs0016@163.com**现在河南省安阳市人民医院 心内科(455000)***Now working at Department of Cardiology, The People's Hospital of Anyang, Anyang (455000), China
R541
A
1000-3614(2014)08-0629-05
10.3969/j.issn.1000-3614.2014.08.018
方法:将32只健康雄性SD大鼠随机分为假手术组、MI组、MI+氯沙坦小剂量组[MI+10 mg/(kg.d)]和MI+氯沙坦大剂量组[MI+20 mg/(kg.d)],各组均8只,随后将MI组和氯沙坦组大鼠建立心尖部MI模型。术中检测梗死前后心电图变化情况。术后24 h开始灌胃给药,给药期1个月,给药结束后测大鼠的血流动力学指标,并取大鼠心尖部心室肌组织,测其重量,随后组织固定切片,苏木素伊红(HE)染色观察心肌组织病理改变情况,逆转录-聚合酶链反应(RT-PCR)法和蛋白印迹(Western Blot)法检测心肌组织ACE2和AngⅡ的mRNA和蛋白表达量。
结果:MI组左心室重量及左心室重量指数(LVMI)均明显高于假手术组(P<0.05),左心室射血分数(LVEF)明显低于假手术组(P<0.05),差异均有统计学意义;氯沙坦各组的上述指标均有所改善,呈剂量依赖性。病理结果显示,MI组大鼠梗死区域可见心肌细胞肿胀、破裂,间质增生,炎症细胞浸润明显;MI+氯沙坦大剂量组心肌细胞坏死少见,肿胀减轻;MI+氯沙坦小剂量组居中;假手术组心肌纤维排列规则,无病理改变。MI组心肌内AngⅡ的mRNA和蛋白表达量显著高于假手术组(P<0.05),给予氯沙坦后,表达量呈剂量依赖性下降。MI组心肌内ACE2的mRNA和蛋白的表达量均略高于假手术组(P<0.05),氯沙坦各组继续升高,呈剂量依赖性。
结论:氯沙坦可增加大鼠ACE2表达量,进而通过抑制心肌组织内AngⅡ表达来改善MI后的心室重塑。
