心肌缺血预适应作用对老年大鼠心肌的影响及其机制的研究
2014-03-03韩劲松王辉山韩宏光尹宗涛汪曾炜
韩劲松,王辉山,韩宏光,尹宗涛,汪曾炜
基础与实验研究
心肌缺血预适应作用对老年大鼠心肌的影响及其机制的研究
韩劲松*,王辉山,韩宏光,尹宗涛,汪曾炜
目的: 本研究探索心肌缺血预适应 (IPC)对老年大鼠心肌缺血再灌注(I/R)后的影响及机制。
老年;缺血预适应;缺血再灌注;过氧化物酶体增生激活受体γ协同刺激因子1α
(Chinese Circulation Journal, 2014,29:624.)
心肌缺血预适应 (IPC) 是一种最为有效的内源性保护措施,IPC可以明显改善心肌线粒体的超微结构,能有效地减轻心肌缺血再灌注损伤(I/R)[1],但IPC对于老年大鼠心脏的作用如何观点不一致[2]。目前较为公认的IPC机制是细胞内信号传导途径[3],涉及转录基因的调控等复杂过程。对于大多数生物过程的转录调控仍集中在对转录因子数目和活性变化的研究上[4,5],虽然这是转录调控的主要模式,但转录共同激活蛋白比转录因子本身有更高的被调控性,当转录因子以序列特异性的方式结合到DNA上时,由于缺乏染色体修饰、DNA解链和招募RNA聚合酶Ⅱ的酶促活性,它并不能单独启动基因表达的发生,而启动这一生化反应的往往是一些共同调节因子,转录因子的转录调节功能是通过与特异性共同激活因子或共同抑制因子结合来实现的,转录共同激活蛋白才可能是激素调节和信号传导途径的主要调控对象[6]。
过氧化物酶体增生激活受体γ协同刺激因子1α(PGC-1α)就是其中的一个典型代表,由染色体4p15.1区域基因编码的一种核受体协同刺激因子。St-Pierre等[7]发现,在心肌细胞中PGC-1α强表达可激活线粒体生物合成、氧化磷酸化及呼吸作用。Leone等[8]证实,敲除PGC-1α的裸鼠,其体内组织中氧化代谢功能有明显的缺陷,心肌收缩功能下降,心率异常及左心室功能受损。PGC-1α与心脏的能量代谢以及与心脏能量代谢紊乱所致病变的关联研究开始引起人们的极大关注[9]。我们前期研究也发现,IPC对心肌线粒体有保护作用,可能与PGC-1α激活及高表达有关[1]。但老年大鼠心肌经IPC后PGC-1α如何变化,鲜有文献报道。本研究通过观察IPC对老年大鼠心肌有无明显的心肌保护作用,并观察老年大鼠心肌PGC-1α表达的变化,以期探讨IPC对老年大鼠心肌的影响及可能机制。
1 材料与方法
动物与材料:2013-05至2013-10期间进行实验。21~23月龄老年Wistar大鼠32只(购自中国医科大学实验动物中心)。肌酸激酶MB同工酶(CKMB)及乳酸脱氢酶试剂盒 (美国Beckman)。丙二醛和超氧化物歧化酶试剂盒 (南京建成生物工程研究所)。心功能检测采用BIOPAC 16导生理记录仪(CBI-8000,美国)。全自动生化分析仪 (美国Beckman)。Langendorff灌注装置和恒温冰冻切片机(英国Thermo Shandon),Olympus光学显微镜、-70℃冰箱(日本Siemenon),MetaMorph/DP10/ BX41显微图像分析系统(生产厂:UIC/OLYMPUS,US/ JP),JEM-1200EX透 射 电 镜。95%O2-5%CO2混合气体(大连大特气体有限公司)。PGC-1α(sc-13067)购自美国Santa Cruz 公司,二抗(EnVisionTM)购自丹麦Dako公司,OCT液(Tissue-Tek 4583) 购自日本Sakura公司。
离体心脏Langendorff灌注模型建立:麻醉采用腹腔内注射戊巴比妥 (5 mg/kg), 开胸前5 min腹腔注射肝素500 U/ kg ,开胸后迅速取出心脏, 置于4℃改良Krebs-Henseleit (K-H)液中洗净血液, 迅速转移、固定于Langendorff灌流装置。结扎双侧肺静脉,以改良K-H液行常规恒压 (80 mmHg) 灌流。改良K-H 液成分 (mmol /L ):NaCl 118.0、KCl 4.7、K2PO41.2、MgSO41.2、NaHCO325.0、CaCl21.25、葡萄糖10.0, pH 7.3~7.4, 以95% O2-5%CO2饱和, 维持灌流液温度37℃。
动物分组:将32只大鼠分为4组(每组8只):对照组、I/R组、IPC组、强化IPC组。对照组采用全心灌流180 min,不做任何处理。I/R组采用心脏平衡灌流30 min后,缺血30 min,再复灌120 min。IPC组采用心脏平衡灌流10 min,经两次缺血5 min再灌注5 min后,缺血30 min,再复灌120 min。强化IPC组采用心脏平衡灌流10 min,经四次缺血5 min再灌注5 min后,缺血30 min,再复灌120 min。缺血期间关闭气体。
左心功能恢复率:切开左心耳,将充水乳胶囊由左心耳插入至左心室,囊内压力经特氟纶管传递至压力传感器,通过压力换能器输入BIOPAC16导生理记录仪。记录缺血前的左心室发展压及左心室内压最大上升速率 (+dp/dtmax)和左心室内压最大下降速率 (-dp/dtmax),主动脉流量和冠状动脉(冠脉)流量分别通过收集主动脉和冠脉流出液来获得,并计算心排血量 (主动脉流量+冠脉流量)作为正常对照,复灌30 min、60 min、90 min、120 min再次记录以上指标,并与心脏缺血前数值进行比较。心功能恢复率(%) = 复灌后值/缺血前值×100%。
冠状动脉流出液CK-MB、乳酸脱氢酶活性:取缺氧前和复灌30 min后的冠脉流出液,12 h内用全自动生化分析仪测定CK-MB、乳酸脱氢酶的活性,按使用说明书操作。
心肌丙二醛含量和超氧化物歧化酶活性测定:实验完毕取0.5 g心室肌制成10%组织匀浆,丙二醛采用硫代巴比妥酸比色法[10],超氧化物歧化酶采用黄嘌呤氧化酶法[11],具体操作步骤按丙二醛和超氧化物歧化酶测试盒说明书进行。
心肌PGC-1α的免疫组织化学染色:各组均取心尖部约5 mm×5 mm×5 mm 组织, 用锡箔纸包裹,放入-70℃冰箱保存,标本取齐后做冰冻切片:OCT液包埋→恒温冰冻切片机(-20℃)切成6 μm薄的冰冻切片。采用链霉素抗生物素蛋白—过氧化物酶(SP法)进行。以0.01 mol/L磷酸盐缓冲液(pH 7.4)替代一抗作为每次染色的阴性对照。Olympus光学显微镜400倍条件下观察:随机选取6个高倍视野,将图像输入MetaMorph/DP10/BX41显微图像分析系统,计算出平均积分吸光度。
统计学分析:采用SPSS 17.0软件分析。计数资料用率表示,计量资料数据以表示,使用方差结合post-Hoc检验,不同时间点应用重复方差检验。P<0.05 为差异有统计学意义。
2结果
左心功能恢复率:各组缺血前基线值经方差分析,差异无统计学意义(P>0.05)。I/R组和IPC组各时间点与对照组比较,心排血量、左心室发展压及+dp/dtmax、-dp/dtmax均明显降低(P<0.01),差异有统计学意义。而强化IPC组与对照组比较,心排血量仅在复灌30 min和60 min明显降低(P<0.05);左心室发展压仅在复灌30 min、60 min和90 min明显降低(P<0.05);+dp/dtmax和-dp/dtmax在复灌30 min明显下降(P<0.05),差异均有统计学意义。强化IPC组与I/R组和IPC组各时间点比较,左心室发展压及+dp/dtmax、-dp/dtmax均明显升高(P<0.05),差异均有统计学意义(表1)。通过公式计算,左心功能恢复率的比较:IPC组与I/R组比较差异无统计学意义(P>0.05),而强化IPC组与I/R组和IPC组比较差异有统计学意义(P<0.01)。
冠状动脉流出液CK-MB、乳酸脱氢酶活性:各组缺血前基线值经方差分析差异无统计学意义(P>0.05)。复灌后IPC组和I/R组较对照组均明显增高(P<0.01),差异有统计学意义。但两组间比较差异无统计学意义(P>0.05),对照组和强化IPC组较IPC组和I/R组明显减少(P<0.01),差异有统计学意义。图 1
心肌组织中丙二醛含量、超氧化物歧化酶活性的变化: I/R组和IPC组较对照组均明显变化(丙二醛:P<0.05,超氧化物歧化酶: P<0.01),差异有统计学意义。但两组间比较差异无统计学意义(P>0.05)。而对照组和强化IPC组与IPC组和I/R组比较,丙二醛含量明显降低(P<0.05)、超氧化物歧化酶活性明显增加(P<0.01),差异均有统计学意义。
PGC-1α的 表 达: PGC-1α在 强 化IPC组(11.89±5.21)明显增高,与对照组(3.50±2.24)、I/R组(3.89±1.72)、IPC组(3.99±0.98)比较差异有统计学意义(P<0.01),但IPC组及I/R组两组间比较差异无统计学意义(P>0.05)。图2
表1 缺血预适应对老年大鼠左心功能的影响(n=8,

表1 缺血预适应对老年大鼠左心功能的影响(n=8,
注:与对照组比较*P<0.05 **P<0.01;与 I/R 组比较△P<0.05 ;与IPC组比较▲P<0.05。I/R:缺血再灌注 IPC:缺血预适应。1 mmHg= 0.133 kPa
复灌30 min 60 min 90 min 120 min心排血量(ml/min)对照组 28.0±3.8 28.1±4.4 27.9±4.0 28.1±4.2 28.0±3.5 I/R 组 29.9±2.1 6.4±3.0** 8.4±2.6** 12.4±3.0** 15.6±2.3**IPC 组 27.6±2.2 6.8±2.1** 8.8±3.5** 12.8±2.9** 16.0±3.2**强化IPC组 28.0±6.1 9.5±2.2*△▲ 14.5±3.0*△▲ 21.5±4.2△▲ 23.6±3.5△▲左心室发展压(mmHg)对照组 81.5±9.7 81.4±8.8 81.4±6.7 81.5±7.5 81.4±6.5 I/R 组 84.1±5.7 28.4±2.1** 38.5±2.4** 49.2±2.0** 58.3±2.1**IPC 组 82.2±5.3 29.3±1.0** 39.2±1.5** 50.4±3.3** 59.2±1.2**强化IPC组 81.6±8.3 45.7±2.2*△▲ 55.6±3.1*△▲ 67.8±2.6*△▲ 70.8±3.8△▲左心室内压最大上升速率(mmHg/s)对照组 2272.0±335.1 2272.3±334.9 2271.9±335.0 2271.6±320.7 2271.5±305.5 I/R 组 2205.9±204.3 1385.9±214.9** 1485.7±204.3** 1595.6±205.4** 1699.9±203.1**IPC 组 2199.3±202.2 1388.3±202.3** 1499.3±220.5** 1609.3±213.0** 1701.3±202.2**强化IPC组 2201.9±313.6 1602.8±283.2*△▲ 1805.9±299.6△▲ 1901.6±303.2△▲ 2009.9±310.1△▲左心室内压最大下降速率(mmHg/s )对照组 1910.3±225.1 1910.6±226.2 1909.9±224.8 1911.3±237.5 1910.0±224.0 I/R 组 1918.0±324.3 1308.0±304.2** 1381.0±314.1** 1429.0±304.6** 1508.0±313.4**IPC 组 1898.7±350.4 1311.7±330.3** 1390.6±340.2** 1422.3±275.1** 1501.5±348.2**强化IPC组 1900.3±268.3 1600.3±254.2*△▲ 1696.7±268.3△▲ 1750.5±301.5△▲ 1798.3±246.1△▲缺血前
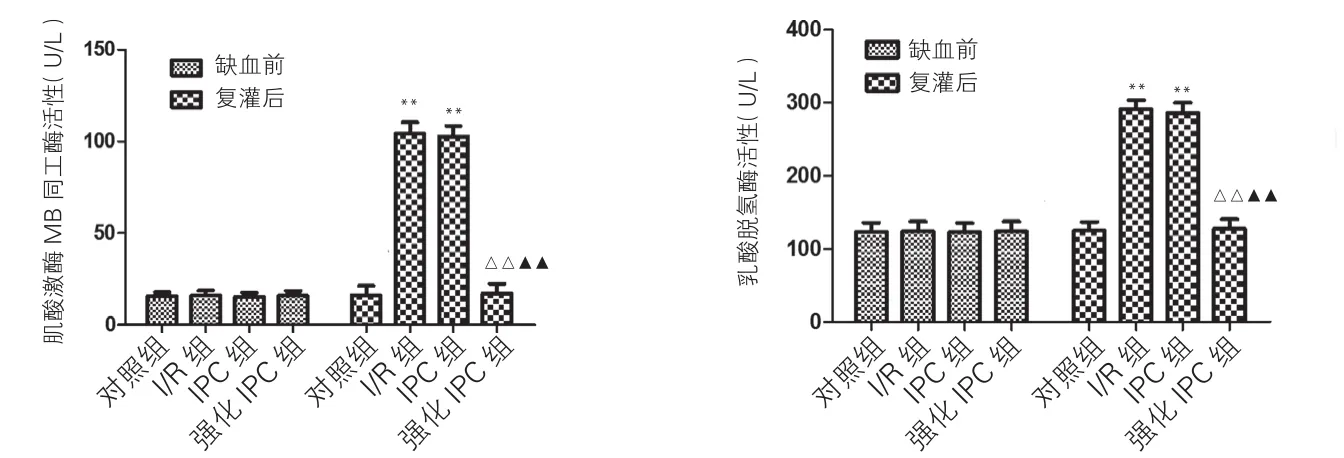
图1 缺血预适应对离体老年大鼠心脏灌流液中肌酸激酶MB同工酶活性和乳酸脱氢酶活性的影响

图2 缺血预适应对老年大鼠心肌过氧化物酶体增生激活受体γ协同刺激因子1α的影响(SP,×400)
3 讨论
正常情况下,体内氧自由基和脂质过氧化物的产生与清除保持动态平衡[12]。心肌I/R发生后,氧自由基通过攻击生物膜中的不饱和脂肪酸而引发脂质过氧化作用,导致生物膜损伤而引发细胞组织的病理改变[13],表现为氧自由基清除系统受损,超氧化物歧化酶等活性下降,细胞内钙超负荷以致细胞膜受损,氧自由基生成增多,可使膜脂质过氧化产物丙二醛产生增加,加重细胞损伤、心肌细胞肿胀、线粒体产能障碍[14]。心肌中丙二醛含量升高、超氧化物歧化酶活性下降常用来衡量细胞损伤的程度。通过测定冠脉流出液CK-MB、乳酸脱氢酶活性可客观地评价心肌梗死范围,因为坏死的心肌将CK-MB、乳酸脱氢酶释放, 其将随灌流液而流失, 冠脉流出液CK-MB、乳酸脱氢酶活性可间接反映坏死心肌组织的多少,从而避免了染色法分离心肌梗死与非梗死部分的主观性。
本研究结果显示:在老年大鼠中,IPC未使I/R后的心肌损伤减轻,而强化IPC使I/R后的老年大鼠心肌损伤明显减轻,表现为冠脉流出液CK-MB、磷酸脱氢酶生成明显减少, 心肌丙二醛含量明显降低, 超氧化物歧化酶活性明显增加。左心功能恢复率也得出类似结果,即反映心脏收缩功能指标心排血量、+dp/dtmax,反映心脏舒张功能左心室发展压、-dp/dtmax,在再灌注后各自的恢复率比较,IPC组与I/R组比较差异无统计学意义,而强化IPC组与I/R组比较明显增加。提示IPC对老年大鼠I/R心肌无明显的保护作用,与Fenton等[15]和 Schulman等[16]的研究结论一致。本研究还提示强化IPC可恢复IPC对老年大鼠I/R心肌的保护作用,Lee等[17]的研究结果与本研究结果类似。本研究还观察到:老年大鼠IPC组与I/R组比较,PGC-1α未见明显增加,有趣的是,强化IPC组PGC-1α明显增加。因此,老年大鼠心肌IPC作用不明显,可能与老年心肌PGC-1α基因表达降低有关,而强化IPC可恢复老年大鼠IPC的心肌保护作用,其机制可能与强化IPC后激活PGC-1α基因的表达有关。
随着年龄增加,线粒体生成氧自由基增加,已导致线粒体氧化损伤[18]。PGC-1α可保护心脏功能,在治疗心力衰竭等心脏疾病中起重要作用[19]。PGC-1α促进线粒体氧化表达,提高线粒体的氧化功能[20]。PGC-1α可保护心脏免受氧化应激反应[21]。本研究发现,老年大鼠心肌IPC后,PGC-1α表达未见明显增加。因此,我们推测老年大鼠心肌PGC-1α表达降低可能使老年大鼠心肌调节超氧化物歧化酶的作用下降,进而影响心肌对应激反应的防护能力,使IPC对老年大鼠心肌不能发挥应有的保护作用。而强化IPC使老年大鼠心肌PGC-1α表达增加,恢复了老年大鼠心肌对超氧化物歧化酶活性的调节能力,进而恢复了IPC对老年大鼠心肌的保护作用。
当然,影响老年心肌IPC的机制很复杂,虽然本研究显示强化IPC可激活老年心肌PGC-1α的表达,并推测PGC-1α降低与老年心肌IPC心肌保护作用减弱有关,而强化IPC由于PGC-1α被激活继而使老年心肌IPC的心肌保护作用恢复,但尚不能确定PGC-1α的这些变化是老年心肌IPC心肌保护作用减弱的独立因素,需进一步研究PGC-1α信号通路与其他信号通路的关系及相互影响。但是,PGC-1α毕竟在代谢调控中具有重要的地位和全能性,因为其处于许多代谢通路网络调节的中上游,并且是以“结点”的方式将其“多功能”的转录增强作用发散至下游诸多能量相关的代谢线路中。对PGC-1α的信号途径的研究可以为心肌保护的治疗提供新的靶点。
[1] Han JS, Wang HS, Yan DM, et al. Myocardial ischaemic and diazoxide preconditioning both increase PGC-1α and rduce mitochondrial damage. Acta Cardiol, 2010, 65: 639-644.
[2] Juhaszova M, Rabuel C, Zovov DB, et al. Protection in the aged heart: Preventing the heart-break of old age? Cardiovasc Res, 2005, 66: 233-244.
[3] Murphy E. Primary and secondary signaling pathways in early preconditioning that converge on the mitochondria to produce cardioprotection. Circ Res, 2004, 94: 7-16.
[4] 薛庆华, 昌克勤, 史碳勇, 等. 蛋白激酶A在缺血预处理抑制心肌细胞核因子-gB-DNA结合活性中的作用. 中国循环杂志, 2009, 24: 141-144.
[5] 崔传珏, 魏英杰, 张秀芳, 等. 乳鼠心肌细胞中C反应蛋白对基质金属蛋白酶-10表达调控的研究. 中国循环杂志, 2010, 25: 476-479.
[6] Spiegelman B, Heinrich R. Biological control through regulated transcriptional coactivators. Cell, 2004, 119: 157-167.
[7] St-Pierre J, Lin J, Krauss S, et al. Biogenergetic analysis of peroxisome proliferator-activated receptor gamma coactivators 1 apha and 1beta (PGC-1 alpha and PGC-1 beta) in muscle cells. J Biol Chem, 2003, 278: 26597-26603.
[8] Leone TC, Lehman JJ, Finck BN, et al. PGC-1 alpha deficiency causes multi-system energy metabolic derangements: muscle dysfunction, abnormal weight I/R and hepatic steatosis. PLoS Biol, 2005, 3: e101.
[9] Van den Bosch BJ, van den Burg CM, Schoonderwoerd K, et al. Reginal absence of mitochondria causing energy depletion in the myocardium of muscle LIM protein knockout mice. Cardiovasc Res, 2005, 65: 411-418.
[10] 陈顺志, 金有余, 李常淳, 等. 过氧化脂TBA显色的三种方法比较(B法). 临床检验杂志, 1984, 2: 8-10.
[11] 张凤翔. 黄嘌呤氧化酶法测定血清中超氧化物歧化酶活力的影响因素. 云南医药, 2001, 22: 473- 474.
[12] Horstkotte J, Perisic T, Schneider M, et al. Mitochonrial thioredoxin reductase is essential for early postischemic myocardial protection. Circulation, 2011, 124: 2892-2902.
[13] Raedschelders K, Ansley DM, Chen DD. The cellular and molecular origin of reactive oxygen species generation during myocardial ischemia and reperfusion. Pharmacol Ther, 2012, 133: 230-255.
[14] Bandyopadhyay D, Chatopadyay A, Ghosh G, et al. Oxidative stressinduced ischemic heart disease: protection by antioxidants. Curr Med Chem, 2004, 11: 369-387.
[15] Fenton RA, Dickson EW, Meyer TE, et al. Aging reduces the cardioprotective effect of ischemic preconditioning in the rat heart. J Mol Cell Cardiol, 2000, 32: 1371-1375.
[16] Schulman D, Latchman DS, Yellon DM. Effect of aging on the ability of preconditioning to protect rat hearts from ischemia-reperfusion injury. Am J Physiol, 2001, 281: H1630-1636.
[17] Lee TM, Su SF, Chou TF, et al. Loss of preconditioning by attenuated activation of myocardial ATP-sentive potassium channels in elderly patients undergoing coronary angioplasty. Ciculation, 2002, 105: 334-340.
[18] Lakatta EG, Sollott SJ. The “heartbreak” of older age. Mol Interv, 2002, 2: 431-446.
[19] Rowe GC, Jiang A, Arany Z.PGC-1 coactivators in cardiac development and disease. Circ Res, 2010, 107: 825-838.
[20] Scarpulla RC.Transcriptional paradigms in mammalian mitochondrial biogenesis and function. Physiol Rev, 2008, 88: 61l-638.
[21] Lu Z, Xu X, Hu X, et a1.PGC-1 alpha regulates expression of myocardial mitochondrial antioxidants and myocardial oxidative stress after chronic systolic overload.Antioxid Redox Signal, 2010, 13: 1011-1022.
Effect of Cardiac Ischemic Preconditioning on Myocardium With its Mechanism in Aged Rats
HAN Jin-song, WANG Hui-shan, HAN Hong-guang, YIN Zong-tao, WANG Zeng-wei.
Department of Cardiovascular Surgery, General Hospital of Shenyang Military Command, Shenyang (110016), Liaoning, China
WANG Hui-shan, E-mail: huishanwang@hotmail.com
Objective: To explore the impact of Ischemic preconditioning (IPC) in aged experimental rats after myocardial ischemia-reperfusion (I/R) with its mechanism.Methods: A total of 32 Wistar rats at the age of (21-23) months were divided into 4 groups, n=8 in each group.①Control group, the rats received cardiac perfusion for 180 min. ②I/R group, the rats received cardiac perfusion for 30 min, followed by ischemia for 30 min, then reperfusion for 120min. ③IPC group, the rats received cardiac perfusion for 10 min, followed by ischemia and reperfusion 2 times (5 min in each time), then ischemia 30 min and reperfusion 120 min. ④Enhanced IPC group, rats received cardiac perfusion for 10 min, followed by ischemia and reperfusion 4 times (5 min in each time), then ischemia 30 min and reperfusion 120 min. The recovery rate of cardiac output (CO), left ventricular developed pressure (LVDP) and the recovery rate of maximum rise and fall of left ventricular pressure (±dp/dtmax) at (30, 60, 90, 120) min after reperfusion were recorded respectively. The creatine kinase (CK-MB), superoxide dismutase (SOD) activity and malondialdehyde (MDA) content were examined before ischemia and 120 min after reperfusion. The apical peroxisome proliferator-activated receptor γ co-stimulatory factor 1α (PGC-1α) was examined by immuno-histochemistry.Results: The MDA content, CK-MB, SOD activities LVDP and (±dp/dtmax) recovery were similar between IPC group and I/R group, P>0.05. While compared with I/R group, the Enhanced IPC group showed decreased CK-MB activity and MDA content, increased SOD activity and CO, LVDP and (±dp/dtmax) recovery rate, all P<0.01. The PGC-1α expression was similar between IPC group and I/R group, P>0.05. While compared with I/R group, the Enhanced IPC group had increased PGC-1α expression, P<0.01.Conclusion: The cardiac IPC was weakened in aged rats which might be because of decreased PGC-1α expression, the enhanced IPC may up-regulate PGC-1α expression and therefore, protect the cardiac tissue in aged experimental rats.
Aging; Ischemic preconditioning; Ischemia-reperfusion; PGC-1α
2013-11-14)
(编辑:漆利萍)
110016 辽宁省沈阳市,中国人民解放军沈阳军区总医院 心血管外科
韩劲松 副主任医师 博士研究生 主要从事心外科基础和临床研究 Email: hanjs0216@sina.com*沈阳军区总医院和第四军医大学联合培养博士研究生 通讯作者:王辉山 Email: huishanwang@hotmail.com
R544. 1
A
1000-3614(2014)08-0624-05
10.3969/j.issn.1000-3614.2014.08.017
方法: 取21~23月龄老年Wistar大鼠32只,建立离体心脏Langendorff灌注模型, 分为4组(每组8只):对照组、I/R组、IPC组、强化IPC组。对照组采用全心灌流180 min,不做任何处理。I/R组采用心脏平衡灌流30 min后,缺血30 min,再复灌120 min。IPC组采用心脏平衡灌流10 min,经两次缺血5 min再灌注5 min后,缺血30 min,再复灌120 min。强化IPC组采用心脏平衡灌流10 min,经四次缺血5 min再灌注5 min后,缺血30 min ,再复灌120 min。比较各组复灌30 min、60 min、90 min、120 min后心排血量的恢复率以及左心室发展压、左心室内压最大上升和下降速率 (±dp/dtmax) 的恢复率;检测缺血前及复灌120 min后冠状动脉流出液中肌酸激酶MB同工酶(CK-MB)和乳酸脱氢酶活性,心肌组织中丙二醛含量和超氧化物歧化酶的活性。各组取心尖肌做冰冻切片行过氧化物酶体增生激活受体γ协同刺激因子1α(PGC-1α)免疫组织化学染色,计算出平均积分吸光度。
结果: IPC组与I/R组丙二醛含量、CK-MB及超氧化物歧化酶活性,左心室发展压 、±dp/dtmax恢复率比较差异无统计学意义(P>0.05),而强化IPC组与I / R组比较, CK-MB和超氧化物歧化酶活性明显减少(P<0.01),丙二醛含量明显降低(P<0.05),超氧化物歧化酶活性明显增加(P<0.01),心排血量、左心室发展压、±dp/dtmax恢复率明显增加 (P<0.01),差异有统计学意义。PGC-1α的表达:IPC组与I/R组比较差异无统计学意义(P>0.05),而强化IPC组表达明显增加,与I/R组比较差异有统计学意义(P<0.01)。
结论: 老年大鼠心肌IPC的保护作用减弱,可能机制是老年心肌PGC-1α蛋白表达降低,使老年心肌调节超氧化物歧化酶活性的作用下降,进而影响老年心肌对应激反应的防护能力,使IPC对老年心肌不能发挥保护作用。而强化IPC使PGC-1α表达增加,恢复了对超氧化物歧化酶活性的调节能力,进而恢复了IPC对老年心肌的保护作用。
