染料木黄酮对3T3-L1细胞增殖与分化的影响
2014-03-02汪先友曹兵海
何 阳,陈 东,汪先友,曹兵海
(中国农业大学动物科学技术学院,动物营养国家重点实验室,北京100193)
染料木黄酮对3T3-L1细胞增殖与分化的影响
何 阳,陈 东,汪先友,曹兵海
(中国农业大学动物科学技术学院,动物营养国家重点实验室,北京100193)
试验旨在研究染料木黄酮对3T3-L1细胞增殖与分化的影响以及对分化过程中相关基因表达的影响。以浓度为0、10、50、100、200 μmol/L的染料木黄酮处理细胞,测定不同天数3T3-L1细胞相对增殖量、细胞合成脂肪量以及第8天与脂肪合成有关的基因PPARγ、FASN、LPL、ACC、HSL的相对表达量。结果表明:在增殖方面,染料木黄酮能显著抑制3T3-L1前脂肪细胞的增殖(P<0.05)。随着染料木黄酮浓度的增加,细胞增殖的抑制作用越强。当浓度为200 μmol/L时,细胞停止增殖。在分化方面,染料木黄酮能显著减少3T3-L1前脂肪细胞分化合成脂肪的量(P<0.05)。随着染料木黄酮浓度的增加,细胞分化合成脂肪量减少。染料木黄酮能显著减少3T3-L1细胞与脂肪合成有关的基因PPARγ、FASN、LPL、ACC、HSL的相对表达量(P<0.05)。在浓度为50 μmol/L时,PPARγ基因相对表达量最低;在浓度为200 μmol/L时,FASN基因相对表达量最低;在浓度为10 μmol/L时,LPL基因相对表达量最低;在浓度为200 μmol/L时,ACC基因相对表达量最低;在浓度为10 μmol/L时,HSL基因相对表达量最低。分析推测,染料木黄酮通过抑制与脂肪合成相关基因的表达来减少脂肪合成量。
染料木黄酮;3T3-L1前脂肪细胞;分化;增殖
染料木黄酮是大豆异黄酮的一种,广泛存在于用于动物饲料的大豆及苜蓿等豆科类植物中。它是大豆生长过程中形成的次生代谢产物。生物活性研究表明,大豆异黄酮特别是其中的染料木素,具有减肥、抗癌、改善心血管功能、提高机体免疫力等功效[1]。因此对染料木黄酮进行全面的研究具有重要的经济价值和社会价值。越来越多的研究表明,具有植物雌激素作用的染料木黄酮影响动物的脂类代谢,但影响机制还没有彻底清楚。染料木黄酮是大豆异黄酮中含量最高的成分,也是大豆异黄酮产品中最有效的活性成分,具有多种生理功能[2]。目前,国内对大豆异黄酮的研究只是停留在它的混合物的层面上,很少有对其某种单一成分进行研究。因此,对大豆异黄酮中的染料木黄酮进行单独研究是十分必要的。
研究表明,染料木黄酮在抑制前脂肪细胞增殖分化作用是多方面的,染料木素是潜在的酪氨酸激酶抑制剂,由该酶催化、磷酸化的一些蛋白质参与了细胞增殖[3]。高剂量染料木素可以降低3T3-L1前脂肪细胞活性[4]。目前,普遍认为染料木黄酮抑制前脂肪细胞分化的原因是其可以激活腺苷酸活化蛋白激酶(AMPK)和乙酰辅酶A的磷酸化水平来减少脂肪的合成[5],但在抑制基因表达方面的报道并不多。
本研究以体外培养3T3-L1前脂肪细胞为材料,研究不同浓度的染料木黄酮对前脂肪细胞增殖与分化合成脂肪性能的影响,从细胞和分子水平上为染料木黄酮在动物脂肪沉积方面的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
染料木黄酮(>98%)购于国药,总RNA提取试剂盒、cDNA反转录试剂盒购于天根生物公司(用RDNA酶处理去除RNA中的DNA),荧光定量试剂盒购于罗氏公司,CCK-8试剂盒购自日本同仁。DMEM培养基和新生牛血清购自Gibco,3T3-L1前脂肪细胞购自国家细胞资源中心。其他试剂均购自Sigma公司。
1.2 方法
试验根据染料木黄酮的浓度分为5个组,即G0、G10、G50、G100、G200组。在染料木黄酮粉末中加入适量DMSO溶液配成20 mmol/L的储备液,使用时向培养基中加入适量的储备液使染料木黄酮终浓度为0、10、50、100、200 μmol/L,分别记为G0、G10、G50、G100、G200组,缺少部分用DMSO补齐。
1.3 3T3-L1前脂肪细胞的分化培养
将汇合成单层的3T3-L1细胞消化,以104细胞/mL密度将细胞悬液接种到96孔板中。汇合2 d后换用含胰岛素10 mg/L,地塞米松1 μmol/L,1-甲基-3-异丁基黄嘌呤0.5 mmol/L,10%牛血清的诱导培养基 (分化第0天),分化第2天换用含胰岛素10 mg/L、不同浓度的染料木黄酮分化培养基,第4天以后换用含不同浓度染料木黄酮的10%牛血清的DMEM基础培养基,每2天换1次液。油红0染色法测定细胞内脂肪含量[6],用酶标仪(Rt6100,深圳雷杜生命科学股份有限公司)在540 nm波长下的吸光度(OD值)表示脂肪含量。
1.4 3T3-L1前脂肪细胞的增殖
3T3-L1细胞以103个/mL细胞密度将细胞悬液接种到96孔板中。12 h以后换用含不同浓度的染料木黄酮DMEM基础培养基,每2天换1次液。用CCK-8试剂盒在37℃孵育1 h后用酶标仪在450 nm波长下测得的吸光度作为细胞相对数量。
1.5 荧光定量PCR
诱导分化第8天的3T3-L1细胞的RNA按试剂盒说明书抽提,取2 μg总RNA按试剂盒说明书逆转录为cDNA进行实时荧光定量PCR(Mx3000,美国安捷伦)。PCR引物以Primer 5.0软件设计,由上海生工公司合成,各基因引物见表1。反应体系为25 μL,反应条件:95℃10 s,57℃15 s,72℃10 s,40个循环,以β-actin为内参基因,以2-△△Ct表示各基因的相对表达量。

表1 用于实时定量PCR的正向引物(F)和反向引物(R)序列
1.6 统计学分析
本试验中的所有数据都以平均数±标准差来表示。用EXCEL2007软件对数据进行初步统计;用SAS V9.0软件对数据进行GLM单因素方差分析,用Duncan氏法
多重比较平均值之间的差异显著性。差异性显著水平为P<0.05。
2 结果与分析
2.1 染料木黄酮对3T3-L1前脂肪细胞增殖的影响
由表2可见,G0、G10和G50组的脂肪细胞数量随培养天数的增加而显著增加(P<0.05)。G100组细胞数量随培养天数增加而上下波动,其中第1、2和8天差异不显著(P>0.05),第6天和第10天也差异不显著(P>0.05),第4、10天以及其他天数均存在显著差异(P<0.05)。G200组细胞数量随培养天数增加而上下波动,其中第2天和第4天差异不显著(P>0.05),第4天和第8天差异不显著(P>0.05),第1天和第10天差异也不显著(P>0.05),其余各天数之间差异显著(P<0.05)。随着染料木黄酮浓度的增加,细胞增殖数量减少。对照组和G10组在第1天显著少于其他各组(P<0.05),在其他天显著高于其他组(P<0.05)。G50组在第1、2、4天与G100组间无显著差异(P>0.05),在第8天和第10天存在显著差异(P<0.05)。G100组与G200组在第2天和第10天存在显著差异(P<0.05)。
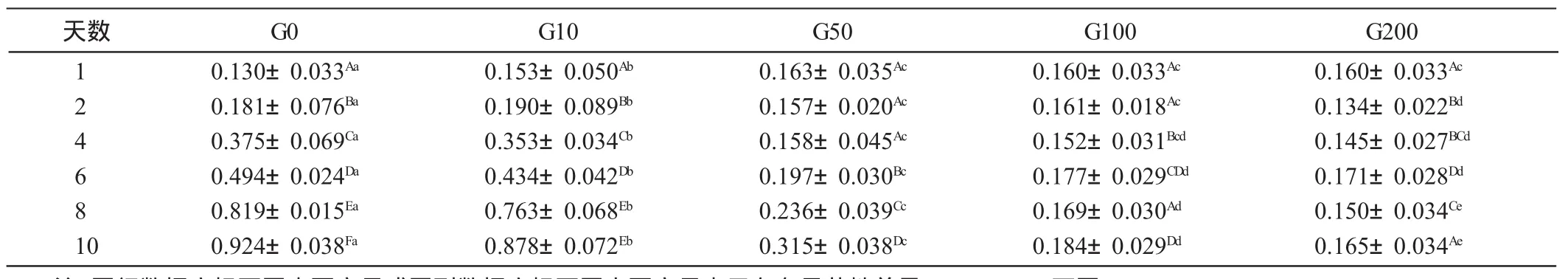
表2 染料木黄酮浓度和培养天数对前脂肪细胞增殖数量的影响(OD值)mmol/L
2.2 染料木黄酮浓度和培养天数对前脂肪细胞分化中脂肪含量的影响
由表3可见,脂肪细胞内的脂肪含量随着培养天数的增加而增加。其中,G0、G10和G50组内隔天存在显著差异(P<0.05)。G100组的第4天和第6天差异不显著(P>0.05),其他时间存在显著差异(P<0.05)。G200组的第6、8、10天差异不显著(P>0.05),其他时间存在显著差异(P<0.05)。分化第2天,G0与G10、G10与G50、G100与G200差异也不显著(P>0.05),其他时间均差异显著(P<0.05)。分化第4天,G10与G50、G10与G100差异均不显著(P>0.05),其他时间均差异显著(P<0.05)。在分化第6、8和10天内各组间均存在显著差异(P<0.05)。
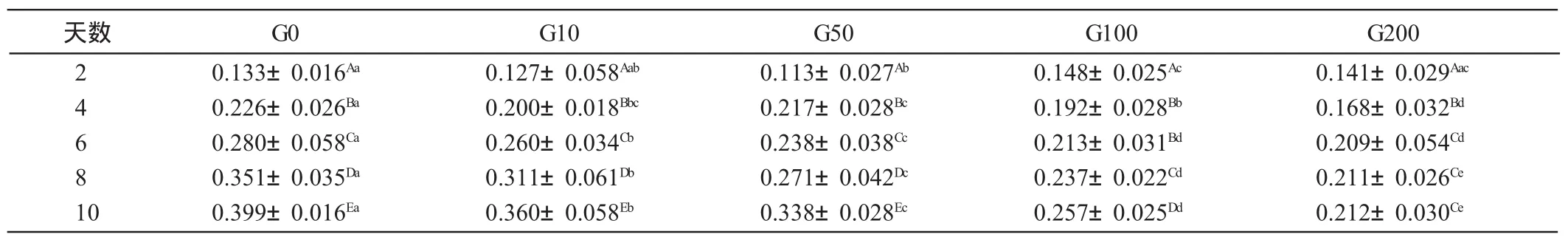
表3 染料木黄酮浓度和培养天数对前脂肪细胞分化中脂肪含量的影响(OD值)mmol/L
2.3 染料木黄酮浓度对前脂肪细胞分化中相关基因表达量的影响
由图1可见,过氧化物酶增殖物激活受体γ(PPARγ)基因相对表达量随着染料木黄酮浓度的增加出现先下降后上升的趋势,在G0组的表达量最高,各组之间均差异显著(P<0.05)。脂肪酸合成酶(FASN)基因相对表达量随着染料木黄酮浓度的增加而降低,添加组均低于对照组,各组之间均差异显著(P<0.05)。脂蛋白酯酶(LPL)基因相对表达量随着染料木黄酮浓度的增加无明显变化趋势,添加组均低于对照组,在G10组表达量最低。乙酰辅酶A羧化酶a(ACC)基因相对表达量随着染料木黄酮浓度的增加而降低,除G10组高于对照组之外,其他添加组显著低于对照组(P<0.05)。激素敏感脂肪酶(HSL)基因相对表达量随着染料木黄酮浓度的增加而增加,但都低于对照组,其中G10组最低,各组之间均差异显著(P<0.05)。
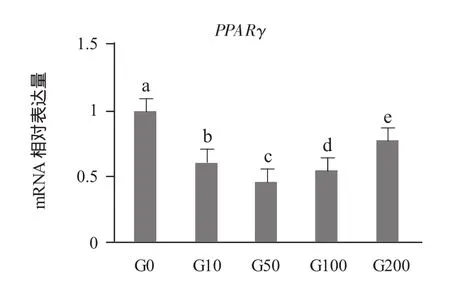
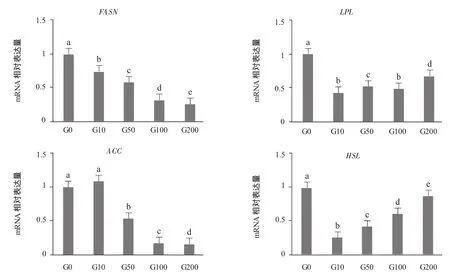
图1 染料木黄酮浓度对前脂肪细胞分化中相关基因表达量的影响
3 讨论
3.1 染料木黄酮浓度和培养天数对前脂肪细胞增殖数量和分化中脂肪含量的影响
关于染料木黄酮抑制细胞增殖的作用机理,一般认为,染料木黄酮是大豆异黄酮的主要成分和活性成分之一,具有类雌激素作用[2]。研究表明,染料木黄酮在低剂量时具有激素样作用可抑制细胞增殖,在高剂量时能够抑制肿瘤细胞的增殖并对细胞有毒性作用[3];但也有研究表明染料木黄酮可以促进牛乳腺上皮细胞的增殖[7]。染料木黄酮是潜在的酪氨酸激酶抑制剂,由该酶催化、磷酸化的一些蛋白质参与了细胞增殖[1]。Kim等[4]研究发现,高剂量染料木素可以使3T3-L1前脂肪细胞凋亡。本试验研究表明,染料木黄酮的浓度为10 μmol/L和50 μmol/L时,对3T3-L1前脂肪细胞的增殖有抑制作用;浓度为200 μmol/L时,3T3-L1前脂肪细胞几乎停止增值。推断可能原因为在低剂量时,染料木黄酮对3T3-L1前脂肪细胞表现为雌激素作用抑制细胞增殖;在高剂量时,染料木黄酮对3T3-L1前脂肪细胞表现为有毒作用,使细胞停止增殖或杀死细胞。
前脂肪细胞分化过程中的一个显著性标志是细胞中逐渐沉积大量的脂肪。染料木黄酮作为大豆异黄酮的一种可以治疗肥胖、糖尿病和心血管疾病的功效。研究显示染料木黄酮对细胞分化合成脂肪的影响是多方面的,Zhang等[8]研究认为,染料木黄酮减少脂肪酸合成酶的量和通过阻碍脂肪合成过程中的通路来减少脂肪合成。Harmo等[9]研究认为,染料木黄酮通过增加增强子结合蛋白类似物来减少增强子结合蛋白β,进而减少脂肪合成。Hwang等[5]认为,染料木黄酮可以激活腺苷酸活化蛋白激酶(AMPK)来增加脂肪的分解。本试验研究显示,染料木黄酮对3T3-L1前脂肪细胞分化合成脂肪具有抑制作用,随着添加量的增加抑制作用越明显。这和前人研究结果相似,但也有研究认为染料木黄酮可以增加乳腺上皮细胞乳脂合成量[7]。推断出现这一结果的原因是染料木黄酮不仅可以减少前脂肪细胞合成脂肪,还可以促进前脂肪细胞中脂肪的分解。
3.2 染料木黄酮浓度对前脂肪细胞分化中相关基因表达量的影响
PPARγ是脂肪组织脂类代谢的重要调节因子,能够调控脂肪酸的吸收和脂肪沉积,在调控脂类代谢方面起中枢作用。PPARγ参与调控脂类代谢相关基因的表达,在控制脂肪储存和释放、维持机体能量平衡及促进脂肪细胞基因表达等方面均有正向调节作用[10]。本试验结果显示,染料木黄酮可以抑制脂肪细胞中PPARγ基因的表达进而减少脂肪的合成,但抑制程度和染料木黄酮的添加量不成正比。这和Rayalam等[11]研究结果相同。脂肪细胞分化过程会编码大量与脂肪合成有关的酶类,FASN是分化晚期的标志物,晚期标志物的多少及活性的强弱表示前脂肪细胞分化能力的强弱,它的出现标志着前脂肪细胞向脂肪细胞的生长和生成。Zhang等[8]研究认为,染料木黄酮可以抑制脂肪细胞中FASN蛋白的表达。本研究结果显示染料木黄酮可以抑制脂肪细胞中FASN基因的表达进而减少脂肪的合成,抑制程度和染料木黄酮
的添加量的增加而增加。可见FASN基因表达的减少是FASN蛋白减少的原因。LPL是甘油三酯降解为甘油和游离脂肪酸反应的限速酶,与机体的脂质代谢密切相关。LPL和二酰基甘油转酰酶的表达可能是终末分化时脂肪细胞脂质大量积累的重要因素[12]。本试验研究显示,染料木黄酮可以抑制脂肪细胞中LPL基因的表达。推断原因是LPL基因的表达受PPARγ基因表达的影响,PPARγ基因的表达可以促进LPL基因的表达。ACC在脂肪酸代谢中起重要作用,是长链脂肪酸生物合成中的限速酶。AMPK的激活可以提高ACC的磷酸化作用。Hwang等[5]认为染料木黄酮可以激活腺苷酸活化蛋白激酶(AMPK)和ACC的磷酸化作用,进而减少脂肪的合成。HSL能将甘油三酯水解成甘油和脂肪酸。现有研究表明HSL表达量的降低能降低前脂肪细胞分化合成脂肪的量。Park等[13]研究认为,染料木黄酮可以抑制人的前脂肪细胞合成脂肪并抑制HSL基因表达量。Pinent等[14]研究认为,原花青素可以抑制3T3-L1前脂肪细胞合成脂肪并抑制HSL基因表达量。本研究结果显示,染料木黄酮抑制HSL基因表达量,但随着浓度升高抑制作用减弱。
4 结论
染料木黄酮可以抑制3T3-L1前脂肪细胞增殖,通过减少细胞在分化过程中多种相关基因的表达量来减少脂肪的合成量。
[1]罗跃中,李忠英.大豆异黄酮的研究概况[J].安徽农业科学,2010,38(12):6506-6508.
[2]高荣海,张春红,赵秀红,等.大豆异黄酮研究进展[J].粮食与油脂,2009(5):1-4.
[3]任国峰,杨爱青,汤凌,等.大豆异黄酮对前列腺增生大鼠细胞凋亡与增殖的影响[J].中国老年学杂志,2010,30(4):471-473.
[4]Kim H K,Nelson-Dooley C,Della-Fera M A,et al.Genistein decreases food intake,body weight,and fat pad weight and causes adipose tissue apoptosis in ovariectomized female mice[J].The Journal of Nutrition,2006,136(2):409-414.
[5]HwangJ T,Park I J,Shin J I,et al.Genistein,EGCG,and capsaicin inhibit adipocyte differentiation process via activating AMP-activated protein kinase[J].Biochemical and Biophysical Research Communications,2005,338(2):694-699.
[6]Wise L S,Green H.Participation of one isozyme of cytosolic glycerophosphate dehydrogenase in the adipose conversion of3T3 cells[J].Journal of Biological Chemistry,1979,254(2):273-275.
[7]穆莹,江连洲.大豆异黄酮对奶牛乳腺上皮细胞增殖及泌乳性能的影响[J].中国畜牧兽医,2013(1):47.
[8]Zhang M,Ikeda K,Xu J W,et al.Genistein suppresses adipogenesis of 3T3 L1 cells via multiple signal pathways[J].Phytotherapy Research,2009,23(5):713-718.
[9]Harmon A,Patel Y,Harp J.Genistein inhibits CCAAT/enhancer-binding protein β(C/EBPβ)activity and 3T3-L1 adipogenesis by increasing C/EBP homologous protein expression[J].Biochem J,2002,367:203-208.
[10]宋新磊,王静,崔焕先,等.PPARγ对脂类代谢和脂肪细胞分化的调控[J].云南农业大学学报,2008,23(6):851-855.
[11]RayalamS,YangJ Y,Ambati S,et al.Resveratrol induces apoptosis and inhibits adipogenesis in 3T3 L1 adipocytes[J].Phytotherapy Research,2008,22(10):1367-1371.
[12]王宏伟,卢慧玲,温宇,等.促酰化蛋白诱导前脂肪细胞分化过程中DGAT、LPL、adipsin mRNA的表达[J].华中科技大学学报,2005,34(6):707-710.
[13]ParkHJ,YangJY,AmbatiS,etal.Combined effectsofgenistein,quercetin,and resveratrol in human and 3T3-L1 adipocytes[J].Journal of Medicinal Food,2008,11(4):773-783.
[14]Pinent M,Blade MC,Salvadó MJ,et al.Intracellular mediators of procyanidin-induced lipolysis in 3T3-L1 adipocytes[J].Journal of Agricultural and Food Chemistry,2005,53(2):262-266.
Effects of Genistein on Proliferation and Differentiation in 3T3-L1 Preadipocyte
He Yang,Chen Dong,CaoBing-hai,et al
(State KeyLaboraroryofAnimal Nutrition,College ofAnimal Science and Technology,China Agricultural University,Beijing 100193,China)
This experiment was designed to study the effects of genistein on 3T3-L1 cell proliferation and differentiation and its impact on the process of differentiation related gene expression.The cells were treated at the concentration of 0,10,50,100,200 μmol/L genistein,and the relative proliferation amount of 3T3-L1 cells on different days,the relative fat synthesize amount of the cells and the related genes relative expression of PPARγ,FASN LPL,ACC,HSL on the 8th day were detected.The results showed that:in terms of proliferation,genistein significantly inhibited the proliferation of 3T3-L1 preadipocytes(P<0.05).The higher the concentration of genistein,the stronger the inhibition of cell proliferation.At the concentration of 200 μmol/L,the cells stopped proliferating.In terms ofdifferentiation,genistein significantlyreduced the amount of3T3-L1 preadipocytes fat synthesis(P<0.05). With increasing concentrations of genistein,the amount of fat cell differentiation synthesis decreased.Genistein reduced significantly the expression of 3T3-L1 cell’s relative genes(PPARγ,FASN,LPL,ACC,HSL)(P<0.05).At the concentration of 50 μmol/L,the relative expression of the PPARγ gene was to the minimum.At the concentration of 200 μmol/L,the relative expression of the FASN gene was to the minimum.At the concentration of 10 μmol/L,the relative expression of the LPL gene was to the minimum.At the concentration of 200 μmol/L,the relative expression ofthe ACCgenewastotheminimum.Attheconcentrationof10 μmol/L,the relative expression of the HSL gene was tothe minimum.Analysis speculated that genistein reduced the amount offat synthesis by inhibiting the synthesis of fat-relat-
genistein;3T3-L1 preadipocytes;proliferation;differentiation
S813.1
A
2095-3887(2014)04-0026-05
10.3969/j.issn.2095-3887.2014.04.007
2014-04-23
国家肉牛牦牛产业技术体系(CARS-38);南方地区草食家畜育肥与高品质肉生产技术研究(201303144)
何阳(1987-),硕士研究生。
曹兵海,博士生导师,主要从事肉牛营养与肉品质研究。
ed gene expression.
