壳聚糖澄清葛根提取液的工艺优化
2014-03-01吴湛霞杨锡洪李思东刘莉莉陈晓琪广东海洋大学理学院广东湛江524088广东海洋大学食品科技学院广东湛江524088
吴湛霞,杨锡洪,李思东,刘莉莉,陈晓琪(.广东海洋大学理学院,广东湛江524088;2.广东海洋大学食品科技学院,广东湛江524088)
壳聚糖澄清葛根提取液的工艺优化
吴湛霞1,杨锡洪2,*,李思东1,刘莉莉1,陈晓琪1
(1.广东海洋大学理学院,广东湛江524088;2.广东海洋大学食品科技学院,广东湛江524088)
以葛根黄酮转移率、提取液透光率为指标,通过单因素实验和正交实验对澄清工艺进行优化,探讨了壳聚糖对葛根提取液澄清作用的影响。结果表明,壳聚糖用于澄清葛根提取液的最佳工艺条件为:壳聚糖分子量为400ku,壳聚糖用量为0.16g/100mL,温度为60℃,pH为5.5。在此条件下,黄酮转移率为73.25%,葛根澄清液透光率为97.9%,壳聚糖澄清葛根提取液的效果较好,葛根的有效成分也得到较好的保留。
葛根提取液,壳聚糖,黄酮,澄清
葛根为野葛的干燥根,是常用中药材,具有退热止泻等功效,在保健品中它可缓解头痛、泄泻、高血压等症状[1-3]。葛根的活性成分有如下几类:异黄酮类,主要包括葛根素、大豆苷等;葛根苷类,主要包括葛根苷A、B、C 3种;三萜皂苷类;生物碱及其他化合物。近代药理研究中最受关注的是葛根素等异黄酮类活性成分,其制剂对头痛、高血压、腹泻等疾患疗效显著[4-9]。异黄酮类物质作为葛根的主要活性成分,其保健功能也逐渐为人们所认可。近年来,各种葛根制剂及葛根功能饮料不断被开发研制[10],如何优化葛根提取液澄清工艺成为研究的主攻方向。目前对葛根提取液进行澄清的经典方法是醇沉法,但已有报道指出将乙醇作为澄清剂有诸多不合理性,如将不溶于醇的无机物作为杂质除去不够妥当,且具有生物活性及免疫作用的蛋白质、多糖也极易被醇沉除去。此外,醇沉工艺耗时长、成本高,成品中残存的乙醇可能对药效有一定影响[11]。
20世纪90年代以来,国内外学者对天然高分子絮凝剂的研究开发产生了浓厚兴趣,淀粉改性阳离子絮凝剂、壳聚糖衍生物、木质素改性絮凝剂等逐渐成为新的研究热点[12]。其中壳聚糖澄清剂因资源丰富、成本低、使用简便等优点倍受关注。壳聚糖絮凝法用于中药制剂澄清工艺的研究已有报道[13],但其用于澄清葛根提取液还少见报道。本文以葛根为原料,对壳聚糖澄清葛根提取液的工艺条件进行探讨,并得出壳聚糖澄清葛根提取液的最佳工艺,为工业化生产应用提供参考。
1 材料与方法
1.1 材料与仪器
400ku分子量壳聚糖、700ku分子量壳聚糖、3~5ku分子量壳聚糖 廉江市台兴海洋生物科技有限公司;葛根块 湛江市鸿中药店霞山分店;95%乙醇、冰醋酸、无水乙醇 分析纯,广东光华化学厂有限公司;盐酸 分析纯,广州化学试剂二厂;葛根素对照品 纯度99%,上海广锐生物科技有限公司。
HHS型电热恒温水浴锅 上海博讯实业有限医疗设备厂;PHS-25型pH计 上海伟业仪器厂;UV-5500型紫外可见分光光度计 上海分析仪器有限公司;UV 1800PC型紫外可见分光光度计 上海美谱达仪器有限公司;SHB型循环式多用真空泵 郑州长城科工贸有限公司;RE52CS型旋转蒸发仪 上海亚莱生化仪器厂。
1.2 实验方法
1.2.1 葛根提取液的制备 称取一定量葛根块,加入30%(体积分数)的乙醇溶液加热回流提取两次:第一次乙醇添加量为葛根质量的6倍,提取时间为2h;第二次乙醇添加量为葛根质量的4倍,提取时间为1h,然后将两次提取液合并,过滤备用。
1.2.2 葛根提取液黄酮含量的测定 对照样溶液的制备:准确称取80℃干燥至恒重的葛根素对照品5.0mg于容量瓶(25mL)中,添加30%(体积分数)的乙醇水溶液,溶解定容后放置备用。
标准曲线的绘制:按照分光光度法(中国药典2010年版一部附录VA)在250nm的波长处测定吸收度,绘制标准曲线。
待测液含量测定:取1.00mL待测液于50mL容量瓶中,用30%(体积分数)的乙醇溶液定容,以30%(体积分数)的乙醇溶液作空白对照,在250nm的波长处测定其吸收度,得待测液含量。
1.2.3 葛根提取液透光率的测定 取待测液适量,以蒸馏水为空白,于600nm最佳波长下测定透光率,透光率的大小间接反映待测液的澄清度,透光率越大,澄清度越好。
1.2.4 澄清前葛根提取液黄酮含量及透光率的测定 取1.00mL葛根提取液于50mL容量瓶中,用30%(体积分数)的乙醇溶液定容,测定其吸光度,计算其黄酮含量及透光率。
1.2.5 壳聚糖澄清葛根提取液的工艺 壳聚糖澄清剂的制备:用1%(体积分数)的乙酸溶液为溶剂配制1%(质量体积分数)的壳聚糖溶液,室温完全溶解后立即使用,以防壳聚糖在稀酸中缓慢水解而影响絮凝效果。
黄酮转移率的计算:葛根提取液经壳聚糖或乙醇澄清,澄清后的葛根提取液中黄酮含量与澄清前葛根提取液中黄酮含量的比值。
1.2.5.1 单因素实验 壳聚糖用量对透光率和黄酮转移率的影响:准确移取25.00mL提取液于50mL具塞比色管中,调节pH为5.0,在60℃下水浴搅拌,并依次加入2.00、3.00、4.00、5.00、6.00mL的1%(质量体积分数)壳聚糖乙酸溶液,即壳聚糖用量分别为0.08、0.12、0.16、0.20、0.24g/100mL(壳聚糖用量表示为每100mL葛根提取液中壳聚糖的加入量(g))。低速搅拌2min,絮凝30min后,自然冷却至室温,静置24h后过滤,取上清液,测定透光率及吸光度。
提取液pH对透光率和黄酮转移率的影响:准确移取25.00mL提取液于50mL具塞比色管中,分别调节pH为3.0、3.5、4.0、4.5、5.0,60℃水浴搅拌下加入4.00mL的1%(质量体积分数)壳聚糖乙酸溶液,即壳聚糖用量为0.16g/100mL,低速搅拌2min,絮凝30min后,自然冷至室温,静置24h,过滤,取上清液,测定透光率及吸光度。
提取液温度对透光率和黄酮转移率的影响:准确移取25.00mL提取液于50mL具塞比色管中,调节pH为4.0,分别在30、40、50、60、70℃条件下水浴,加入4.00mL的1%(质量体积分数)壳聚糖溶液,即壳聚糖用量为0.16g/100mL,低速搅拌2min,絮凝30min后,自然冷至室温,静置24h后过滤,取上清液,测定透光率及吸光度。
1.2.5.2 正交优化实验 由上述单因素实验得出壳聚糖用量、pH和提取液温度的3个水平,建立因素水平表(见表1),以葛根溶液透光率和黄酮转移率为指标,采用正交实验确定最佳壳聚糖用量、pH和提取液温度。
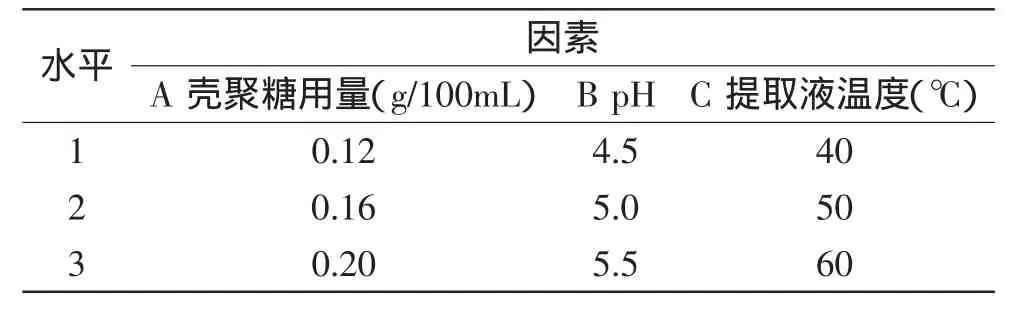
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
1.2.6 壳聚糖分子量与提取液透光率和黄酮转移率的关系 取提取液25.00mL,分别在最优条件下加入最佳用量的分子量(M)分别为400、700、3~5ku壳聚糖,静置24h后过滤,取上清液测定葛根黄酮含量及透光率,计算黄酮转移率。
1.2.7 壳聚糖澄清葛根提取液与传统工艺比较 取葛根提取液25.00mL,添加95%(体积分数)的乙醇配制成70%(质量体积分数)的待测溶液,搅拌,静置24h待醇沉后过滤,将上清液浓缩至25.00mL,测定其葛根黄酮含量和透光率,计算黄酮转移率。
取葛根提取液25.00mL,在壳聚糖澄清工艺优化后得出的最佳条件下澄清,静置24h后过滤,取上清液测定葛根黄酮的含量及透光率,计算黄酮转移率。
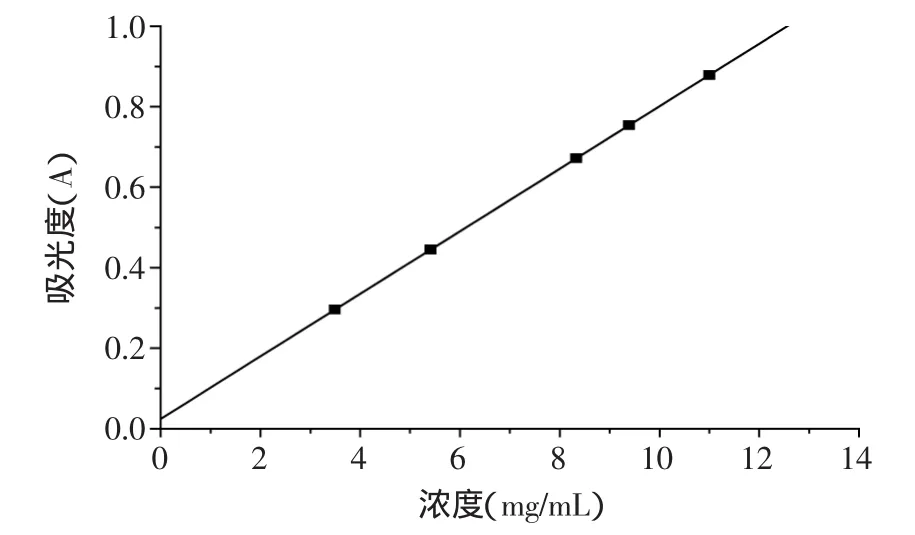
图1 黄酮浓度对吸光度的标准曲线Fig.1 Standard curve of concentration of flavonoid and the absorbance
2 结果与分析
2.1 葛根溶液黄酮含量的测定
采用分光光度法在250nm波长处测定吸光度,其线性关系见图1。以黄酮浓度(C)对吸光度(A)进行线性回归,得回归方程:A=0.0777C+0.0243(相关系数R2=0.999),即为提取液黄酮含量测定标准曲线。由图1可知,黄酮浓度在4.00~11.0μg/mL范围内其浓度值与吸光度具有良好的线性关系。
2.2 澄清前葛根提取液黄酮含量和透光率的测定
用紫外分光光度法测得澄清葛根提取液的透光率为24.7%,吸光度为0.671,换算得澄清前葛根提取液黄酮含量为416.2μg/mL。
2.3 单因素实验
2.3.1 壳聚糖用量对透光率和黄酮转移率的影响 如图2所示,随着壳聚糖用量的增加,葛根提取液的黄酮转移率逐渐降低,透光率逐渐增大。说明随着壳聚糖用量的增加,葛根提取液澄清度逐渐升高,而葛根提取液有效成分却逐渐减少。在0.16~0.24g/100mL时,随着壳聚糖用量的增高,透光率升高不太明显,而黄酮转移率却大幅度降低,所以0.16g/100mL为最佳用量。当壳聚糖用量大于0.16g/100mL时,葛根提取液的澄清效果较好,而葛根黄酮转移率却降低。可能的原因是:随着壳聚糖用量的增加,吸附架桥和电中和作用增强,澄清效果逐渐增强,另外壳聚糖可能会影响提取液中黄酮的稳定性,与蛋白质、鞣酸等大分子物质同时沉降,导致黄酮的含量呈饱和性而降低。酮的转移影响较大。当pH为4时,有效成分黄酮的转移率较高,大于70%;综合考虑澄清效果,此pH条件下澄清后的提取液透光率也较高,即可选为较合适的pH。可能的原因是随着pH降低,蛋白质和鞣质等大分子也带正电荷,使壳聚糖的阳离子型澄清作用逐渐减弱,澄清效果变差。
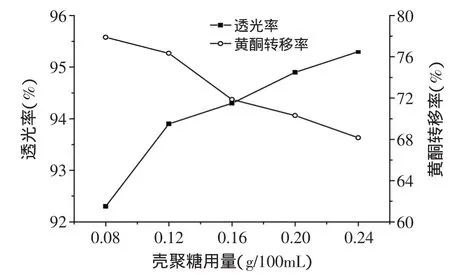
图2 壳聚糖用量对透光率和黄酮转移率的影响Fig.2 Effect of amount of chitosan on the transport rate of flavonoid and the light transmittance
2.3.2 提取液pH与透光率及黄酮转移率的关系 由图3可知,随着pH的增加,葛根黄酮的转移率先下降后上升,而透光率一直呈上升趋势。说明pH对葛根黄
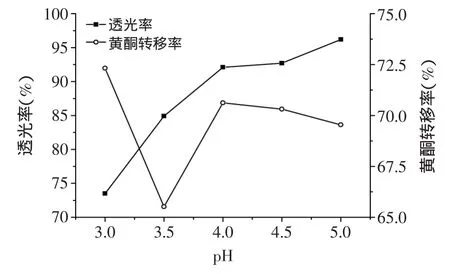
图3 提取液pH与透光率和黄酮转移率的关系Fig.3 Relationship of pH of extracting solution with the transport rate of flavonoid and the light transmittance
2.3.3 提取液温度对透光率及黄酮转移率的影响 如图4所示,在提取液温度为30~50℃范围内,随着提取液温度的升高,黄酮转移率及透光率均呈上升趋势;而在50~70℃范围内,随着提取液温度的升高,黄酮转移率及透光率均呈下降趋势。说明提取液温度为50℃时,葛根澄清度和黄酮转移率最佳。随着温度的升高,澄清效果有所改善,但温度过高会出现澄清效果变差的现象,且黄酮含量也逐渐减低。原因可能是高温使溶液黏性降低,粒子热运动加强,从而使架桥澄清作用减弱。
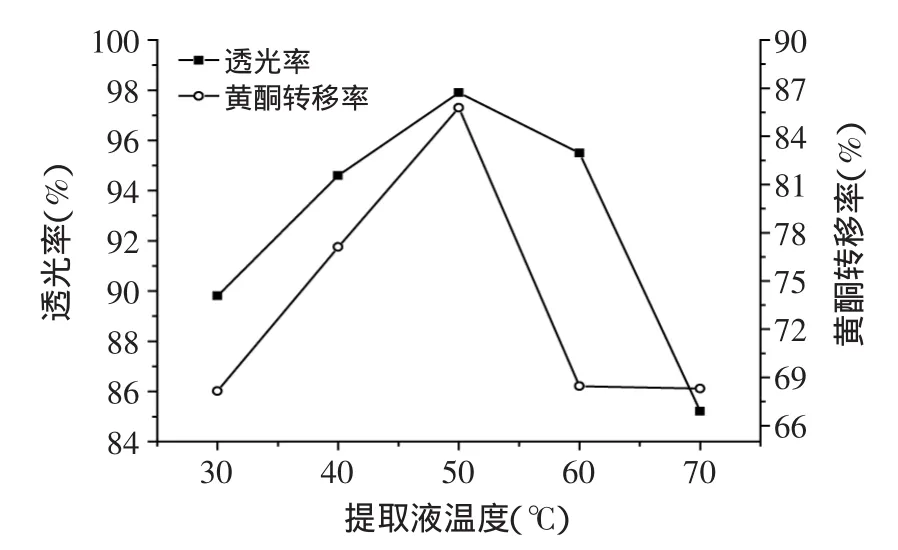
图4 提取液温度对透光率和黄酮转移率的影响Fig.4 Effect of temperature of extracting solution on the transport rate of flavonoid and the light transmittance
2.4 壳聚糖澄清工艺的优化
正交实验结果见表2,用壳聚糖澄清葛根提取液过程中,考虑到黄酮转移率和提取液透光率是研究壳聚糖澄清效果的两个指标,在尽可能保持较高黄酮转移率的条件下,透光率越大越好。所以对黄酮转移率和透光率这两个指标分别赋予权重,再进一步进行极差分析,结果见表3。赋予黄酮转移率和透光率的权重分别为0.8和0.2,在这个基础上再进行极差分析,从而获得最佳的澄清工艺条件。
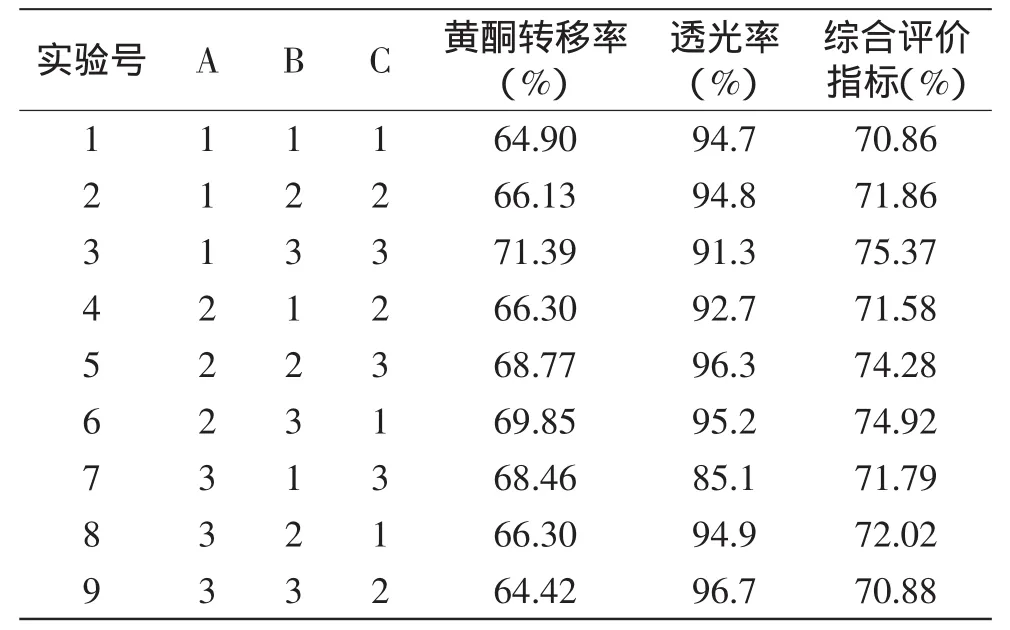
表2 L9(34)正交实验结果Table 2 L9(34)Design and results of orthogonal experiment
从表3中可以看出,影响壳聚糖澄清葛根提取液的效果的因素主次顺序是C>B>A,即提取液温度对澄清效果的影响最大,其次是提取液的pH,最后为壳聚糖用量,确定的最优方案为A2B3C3。由正交实验可得最佳工艺条件为:壳聚糖用量是0.16g/100mL,pH是5.5,提取液温度是60℃。在此条件下进行验证实验,得出黄酮转移率为73.25%,葛根澄清液透光率为97.9%。壳聚糖澄清葛根提取液的工艺简单且澄清效果很好,对葛根的有效成分也有较好的保留作用。

表3 极差分析Table 3 Range analysis
2.5 壳聚糖分子量与葛根提取液透光率和黄酮转移率的关系
如表4所示,同一澄清工艺条件,不同分子量壳聚糖对葛根提取液的澄清效果差别较大。当壳聚糖分子量为400ku时,澄清效果最好,透光率高达97.9%,而当分子量为700ku时,澄清液较混浊,透光率只有81.4%,而选用分子量为3~5ku的壳聚糖时,澄清效果较差且黏糊难以过滤,但葛根黄酮转移率较高。因此上述讨论的壳聚糖最优澄清工艺只适用于质量分数为400ku的壳聚糖。
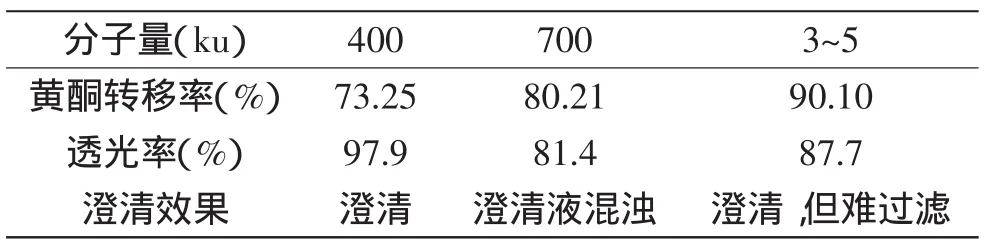
表4 最优条件下不同分子量壳聚糖的澄清效果比较Table 4 Comparison of the clarification effect by chitosan with different molecular weight on the optimal conditions
2.6 壳聚糖澄清法与醇沉法的比较
表5为葛根提取液经澄清法与醇沉法过滤后的黄酮转移率及透光率。由表5可得,醇沉法澄清葛根提取液的黄酮转移率较高,高达89.72%,而澄清度比壳聚糖澄清时差,透光率只有82.3%。壳聚糖(分子量为400ku)澄清效果与醇沉效果相比,壳聚糖澄清效果较好,而葛根黄酮的转移率相对偏低。
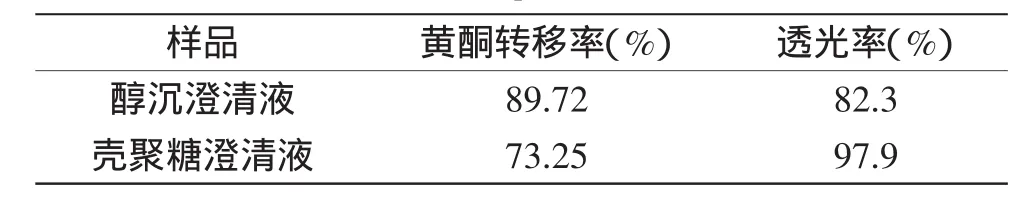
表5 最优条件下壳聚糖澄清法与醇沉法的澄清效果比较Table 5 Comparison of the clarification effect by chitosan and alcohol on the optimal conditions
3 结论
实验以葛根黄酮转移率、提取液透光率为指标,通过单因素实验和正交实验对澄清工艺进行优化,得出最佳工艺条件即壳聚糖用量是0.16g/100mL,提取液pH为5.5,提取液温度是60℃时,澄清效果最好。在此条件下黄酮转移率为73.25%,葛根澄清液透光率高达97.9%。壳聚糖澄清葛根提取液的工艺简单,成本低廉,且澄清效果很好,葛根的有效成分也能得到较大程度的保留,本实验结论可为工业化应用提供参考。
[1]国家药典委员会.中国药典Ⅰ部[M].北京:化学工业出版社,2005:233-234.
[2]杨鹏,李秀兰,贾雪岭.葛根素的药理作用和临床应用[J].内蒙古民族大学学报:自然科学版,2013,28(2):226-227.
[3]李誉海,刘爱芬,孙慧博.葛根素治疗冠心病的研究进展[J].中国医疗前沿,2013,8(13):10-11.
[4]周吉银,周世文.葛根总黄酮及葛根素解酒的药理研究进展[J].中国医院药学杂志,2007,27(9):1280-1282.
[5]尹丽红,李艳枫,孟繁琳.葛根的化学成分、药理作用和临床应用[J].黑龙江医药,2010,23(3):371-372.
[6]赵淑芹.葛根的药理作用与临床应用[J].中国医药科学,2013,3(2):40-43.
[7]徐立,赵媛,栾玉泉,等.葛根不同部位中葛根素含量研究[J].大理学院学报,2009,8(10):3-6.
[8]徐轶尔,李秋红,杨菲菲.中药葛根的药理药效研究[J].吉林中医药,2010,30(11):993-994.
[9]谢明亮,王位萍.葛根的药理作用和临床应用进展[J].中医中药,2011,19(6):329.
[10]罗志强,孙术国,王小虎,等.葛根保健饮品研究进展[J].农业工程技术,2009(10):37-40.
[11]马依努尔·拜克力,吴桂荣.吸附澄清剂在纯化中药制剂中的应用[J].新疆医科大学学报,2007,30(3):215-216.
[12]Pal S,Mal D,Singh R P.Cationic starch:an effective flocculating agent[J].Carbohydrate Polymer,2005,59:417-423.
[13]商常发,李庆林,何领.壳聚糖絮凝法在澄清中药水提液中的应用[J].中国中医药科技,2006,13(5):365-366.
Optimization of clarification process of extracting solution from Radix Puerariae with chitosan
WU Zhan-xia1,YANG Xi-hong2,*,LI Si-dong1,LIU Li-li1,CHEN Xiao-qi1
(1.College of Science,Guangdong Ocean University,Zhanjiang 524088,China;2.College of Food Science and Technology,Guangdong Ocean University,Zhanjiang 524088,China)
The optimum condition of clarification process of extracting solution from Radix Puerariae with chitosan was investigated using single factor experiment and orthogonal experiment with the transport rate of flavonoid and the light transmittance of extracting solution as indexes.The optimum conditions of flocculation were as follows:the clarification temperature was 60℃,the amount of chitosan with molecular weight of 400ku was 0.16g/100mL(the content of chitosan per 100mL of extracting solution from Radix Puerariae)and the pH value was 5.5.Under this condition,the transport rate of flavonoid was 73.25%,and the light transmittance was 97.9%.The clarification technology by chitosan had good effect on the extracting solution from Radix Puerariae,in addition,the effective component of Radix Puerariae was well preserved.
extracting solution from Radix Puerariae;chitosan;flavonoid;clarification
TS201.1
B
1002-0306(2014)14-0268-04
10.13386/j.issn1002-0306.2014.14.051
2013-10-12 *通讯联系人
吴湛霞(1967-),女,大专,实验师,研究方向:海洋应用化学。
国家自然科学基金项目(31271938)。
