酶-超声波联用提取紫薯色素的工艺研究
2014-03-01孟雅红付彦青孙丽平彭林才昆明理工大学云南省食品安全研究院云南昆明650500昆明理工大学化学工程学院云南昆明650500
李 辉,孟雅红,付彦青,孙丽平,彭林才(1.昆明理工大学云南省食品安全研究院,云南昆明650500;.昆明理工大学化学工程学院,云南昆明650500)
酶-超声波联用提取紫薯色素的工艺研究
李 辉1,2,孟雅红1,2,付彦青1,2,孙丽平1,2,彭林才2
(1.昆明理工大学云南省食品安全研究院,云南昆明650500;2.昆明理工大学化学工程学院,云南昆明650500)
研究了酶-超声波联用提取紫薯色素的工艺条件,通过单因素和L9(34)正交实验确定了其最佳提取工艺条件为:纤维素酶用量20IU/g,酶解时间45min,酶解温度50℃,酶解pH5.6,料液比1∶10(g/mL),超声时间20min,超声温度60℃。在最佳提取工艺条件下,最佳提取次数为三次时,紫薯色素的提取率可达98.7%。同时对比了酶法、超声法、酶-超声联用法三种提取方法,结果表明酶-超声波联用法的紫薯色素提取率较酶法、超声法分别提高了39.3%和20.3%。研究表明酶-超声波联用法能更好地提取紫薯色素,为紫薯色素的提取提供了一种新工艺。
紫薯,紫薯色素,纤维素酶,超声波
随着人们生活水平的提高和保健意识的增强,对食用色素的选取有了新的趋向[1]。天然色素以其安全、绿色、无毒性,同时兼具营养和药理等保健功能等优点而日益受到人们的重视[2-3]。因此,寻求和开发天然色素对于保障人类健康,促进食品工业的发展具有十分重要的意义。紫薯(purple sweet potato),又名黑薯,薯肉呈紫色至深紫色,它除了具有普通红薯的营养成分外,还富含硒元素和花青素[4]。紫薯色素是从紫薯中提取的具有良好生物活性的水溶性红色素,属于天然花青素类色素,存在于紫薯的块根、茎、叶和薯皮中[5-6]。在自然状态下,花青素在植物体内常与各种单糖结合形成糖苷,称为花色苷(anthocyanin)。紫薯色素不仅具有给食品着色的作用,而且还具有抗氧化、抗突变、减轻肝机能障碍与心血管疾病等作用[7],是一类极具前途的功能型食品添加剂和保健食品基料。目前,对紫薯色素的提取方法有溶剂法[8]、微波提取法[9-10]、超声提取法[11]、酶-微波提取法[12]等,而采用酶-超声波联用技术提取紫薯色素的研究鲜有报道。由于紫薯中含有大量的纤维素[13],采用纤维素酶可以较温和地将紫薯中的纤维素水解,有效地破坏细胞壁和细胞膜,加速色素成分的释放,从而提高提取率[14]。超声波法利用超声波的空化效应、高速冲击破碎等作用,破坏提取物细胞结构,使提取液更易进入细胞内部,加速有效成分的溶出[15]。本实验采用酶-超声波联用技术提取紫薯色素,并对其提取工艺条件进行优化,同时对超声波、酶法及酶-超声波联用三种提取方法进行比较,旨在为紫薯色素的提取提供一种新工艺及理论依据。
1 材料与方法
1.1 材料与仪器
紫薯 昆明呈贡;纤维素酶 酶活力33IU/mL,江苏淮安百麦绿色生物能源有限公司;柠檬酸、柠檬酸钠 国产分析纯,天津风船化学试剂科技有限公司。
UV-1800型紫外-可见分光光度计 上海美谱达仪器有限公司;TC-200B型变频恒温摇床 上海天呈科技有限公司;SCQ型数控加热超声波清洗器 上海声彦超声波仪器有限公司;TGL-16G型台式离心机 上海安亭科学仪器厂;FE20型pH计 上海梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 紫薯色素的提取工艺流程 新鲜紫薯洗净去皮切片,60℃烘干,粉碎过60目筛,得到紫薯粉末,置于密闭容器中备用。准确称取1.0g紫薯粉置于100mL具塞三角瓶中,加入一定量的柠檬酸-柠檬酸钠缓冲液,加适量的纤维素酶,置于恒温摇床中(100r/min)在一定温度下提取一定时间;将三角瓶及内容物冷却至室温,放入超声波清洗机中(超声频率40kHz,超声功率为150W),在一定超声温度条件下处理一定时间;最后,3000r/min离心15min,得到提取液。
1.2.2 紫薯色素最大吸收峰测定 准确称取1.0g紫薯粉,加入20mL柠檬酸-柠檬酸钠缓冲液,在50℃水浴锅中浸提1h,3000r/min离心15min后,取上清液,在200~800nm范围内扫描,测定吸光度值,筛选最大吸收峰波长。
1.2.3 单因素实验 在其他相同的提取条件下(酶解时间45min,酶解温度50℃,超声温度50℃),以紫薯色素在最大吸收峰处的吸光度值为评价指标,间接反映紫薯色素的提取率。分别考察纤维素酶用量(5、10、15、20、25IU/g)、酶解时间(15、30、45、60、75min)、酶解温度(20、30、40、50、60℃)、酶解pH(3.2、4.0、4.8、5.6、6.6)、料液比(紫薯粉:提取液)(1∶10、1∶15、1∶20、1∶25、1∶30g/mL)、超声温度(30、40、50、60、70℃)、超声时间(10、20、30、40、50min)7个单因素对紫薯色素提取率的影响。
1.2.4 正交实验 在单因素实验中选取对紫薯色素提取影响较大的四个因素,按正交表设计四因素三水平L9(34)的正交实验,进一步优化最佳提取工艺,并对实验结果进行分析。正交实验因素水平表见表1。
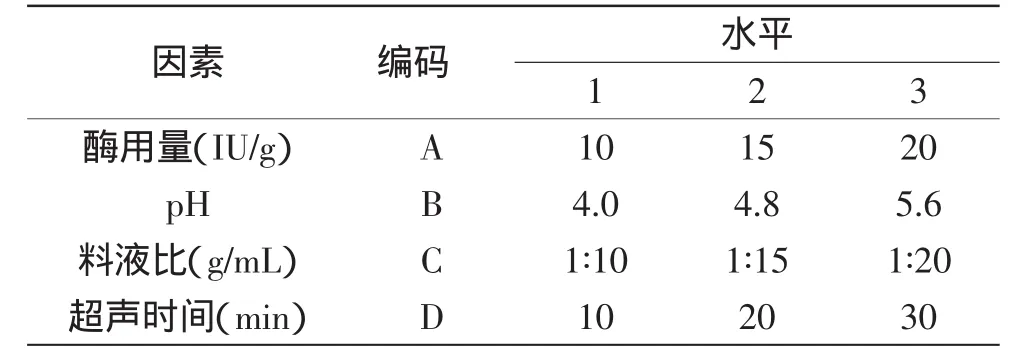
表1 正交实验因素水平表Table 1 The level of orthogonal experimental factors
1.2.5 提取级数的确定 按正交实验的优化条件对紫薯色素进行反复提取,至提取液基本呈无色,收集提取液,测定各次提取液体积V及其在最大吸收峰处的吸光度值A。将各次提取液合并得到总体积VT以及总吸光度值AT,提取率按下式计算,确定最佳提取次数。
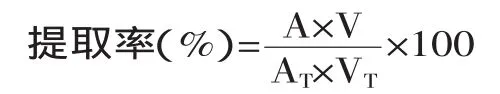
1.2.6 不同提取方法的比较 在正交实验优化的最佳提取工艺条件下,分别采用单独的酶法、单独的超声波法和酶-超声联用法提取紫薯色素,分别收集其提取液定容至50mL容量瓶,测定各溶液在最大吸收峰处的吸光度值。
2 结果与讨论
2.1 紫薯色素最大吸收峰的确定
紫薯色素的紫外-可见吸收光谱图见图1。从图1中可以看出,在526nm处具有最大吸收峰。这与文献[12]所报道的紫薯花色苷色素的特征吸收峰基本吻合。因此,本实验选取526nm作为紫薯色素的最大吸收峰。
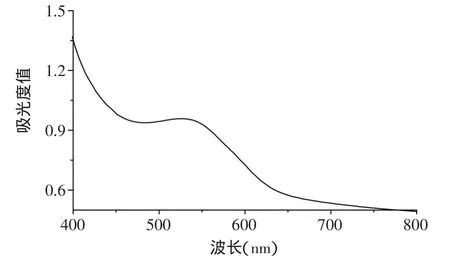
图1 紫薯色素的紫外-可见吸收光谱图Fig.1 UV-Vis absorption spectrogram of purple sweet potato pigment
2.2 单因素实验结果分析
2.2.1 纤维素酶用量对紫薯色素提取的影响 由图2可见,随着纤维素酶用量的增加,紫薯色素的提取率不断增大。这是因为紫薯中含有大量的纤维素物质,它与色素类物质结合紧密,纤维素酶能促进纤维素解链,使得更多的色素物质释放,从而使得紫薯色素提取率提高。当纤维素酶用量超过15IU/g时,紫薯色素的提取率增加不明显,这是因为此时酶解反应基本达到了饱和。因此,初步推测较适宜的纤维素酶用量为15IU/g。

图2 纤维素酶用量对紫薯色素提取率的影响Fig.2 Effect of cellulase dose on extraction rate of purple sweet potato pigment
2.2.2 酶解时间对紫薯色素提取的影响 由图3可见,随着酶解时间的延长,紫薯色素提取率先增加后略有降低。这可能是因为酶解时间的延长,造成了少量紫薯色素分子的破坏。在酶解时间为45min时,紫薯色素提取率出现最大值。因此,初步推测比较合适的酶解时间为45min。
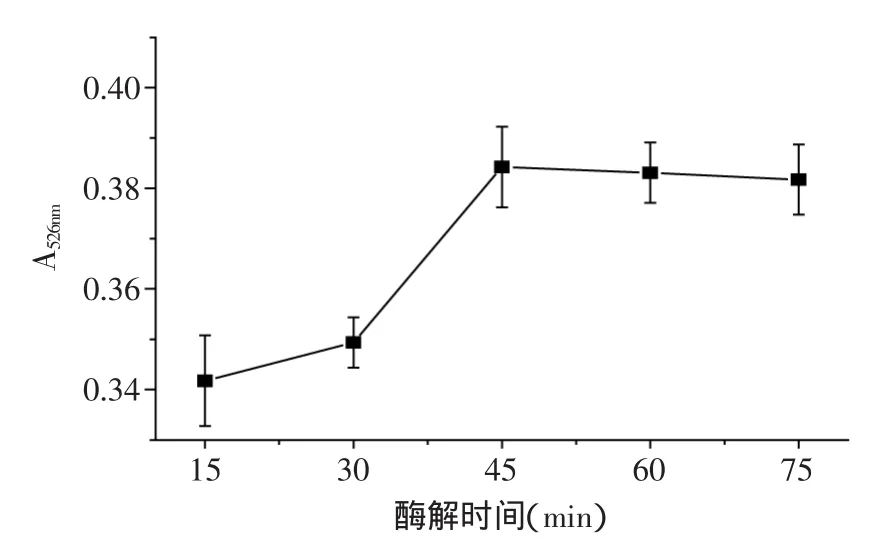
图3 酶解时间对紫薯色素提取率的影响Fig.3 Effect of enzymatic hydrolysis time on extraction rate of purple sweet potato pigment
2.2.3 酶解温度对紫薯色素提取的影响 由图4可见,在一定温度范围内(30~50℃),随着温度的升高,紫薯色素的提取率也随之增加,这是由于温度的升高使纤维素酶的活力增强,提高了酶解反应的速度,加快了纤维素的降解,使得色素得以释放。当温度超过50℃时,紫薯色素提取率显著降低,这是因为温度过高可能导致部分紫薯色素发生降解,同时部分酶活力失活,最终导致紫薯色素提取率降低。因此,初步推测50℃为较适宜的酶解温度。
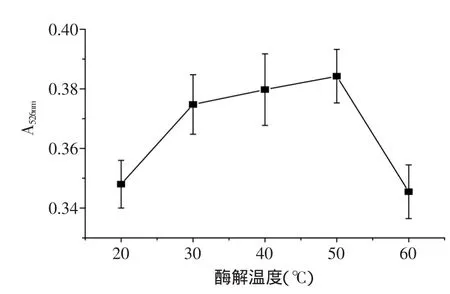
图4 酶解温度对紫薯色素提取率的影响Fig.4 Effect of enzymatic hydrolysis temperature on extraction rate of purple sweet potato pigment
2.2.4 酶解pH对紫薯色素提取的影响 从图5可以看出,随着酶解pH的增加,紫薯色素的提取率先增加后下降。在pH为4.8时,紫薯色素的提取率达到最大值。这是因为纤维素酶的最佳作用pH为3.0~5.0,在此范围纤维素具有最大的活力,可加速紫薯中纤维素的降解,使得紫薯色素的溶出效率提高。因此,初步推断4.8为较合适的酶解pH。
2.2.5 料液比对紫薯色素提取的影响 由图6可以看出,随着料液比的增大,紫薯色素的提取率先增大后降低。这是因为在酶解的过程中,随着溶液量的增加,提取液和紫薯粉末之间的接触面积增大,有利于纤维素酶对紫薯细胞壁纤维素的降解,使得紫薯细胞迅速破裂,有利于紫薯色素的溶出。但是随着料液比的不断增加,提取液中纤维素酶的浓度也随之减小,酶解反应速率降低。因此,综合经济成本及后续浓缩处理等因素的考虑,初步推断适宜的料液比为1∶15(g/mL)。
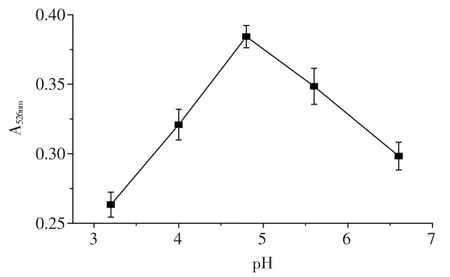
图5 酶解pH对紫薯色素提取率的影响Fig.5 Effect of enzymatic hydrolysis pH on extraction rate of purple sweet potato pigment
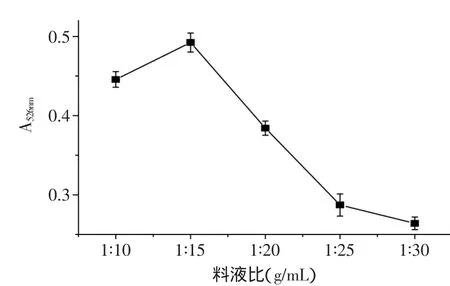
图6 液料比对紫薯色素提取率的影响Fig.6 Effect of solid-liquid ratio on extraction rate of purple sweet potato pigment
2.2.6 超声温度对紫薯色素提取的影响 由图7可以看出,当超声温度为60℃时,紫薯色素的提取率达到最大值。当超声温度超过60℃时,紫薯色素提取率降低,这是因为天然色素对热的稳定性不同,当提取温度过高时,会破坏色素结构,造成提取率下降。因此,初步推测超声温度为60℃为宜。
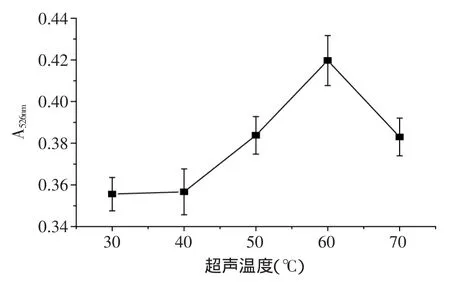
图7 超声温度对紫薯色素提取率的影响Fig.7 Effect of ultrasonic temperature on extraction rate of purple sweet potato pigment
2.2.7 超声时间对紫薯色素提取的影响 由图8可以看出,紫薯色素的提取率随着超声时间的延长先增加后减小。当超声时间为20min时,紫薯色素的提取率达到最大值。这是因为超声时间较短时,色素不易溶出,超声时间过长时,色素又会因长时间受热而分解。因此,初步推断超声20min对紫薯色素的提取效果最好。
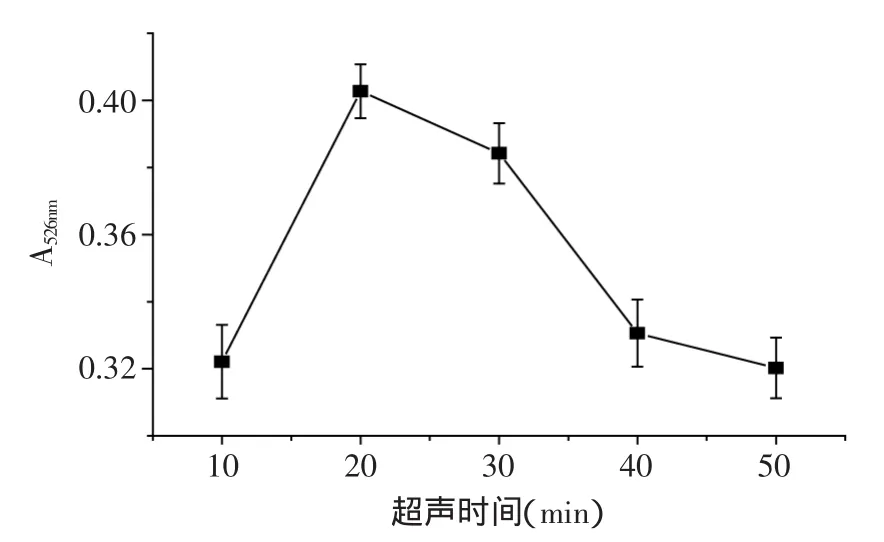
图8 超声时间对紫薯色素提取率的影响Fig.8 Effect of ultrasonic time on extraction rate of purple sweet potato pigment
综上,由图2~图8可以看出,纤维素酶用量、酶解pH、料液比和超声时间对紫薯色素的提取率的影响较大,所以选择这四个因素作为正交实验的考察因素,对酶-超声联用提取紫薯色素的工艺条件进行进一步的优化。
2.3 酶-超声波联用提取紫薯色素最佳工艺条件的优化
选取纤维素酶用量、酶解pH、料液比和超声时间作为考察因素,以紫薯色素在526nm处的吸光度值为考察指标,进行L9(34)正交实验,实验结果如表2所示。对实验结果进行方差分析,其结果见表3。
从表2的极差分析可知,各因素对紫薯色素提取率的影响顺序为:料液比>酶解pH>纤维素酶用量>超声时间,以影响最小的因素D作为误差列,选择因素A、B、C做进一步的方差分析,结果如表3所示。
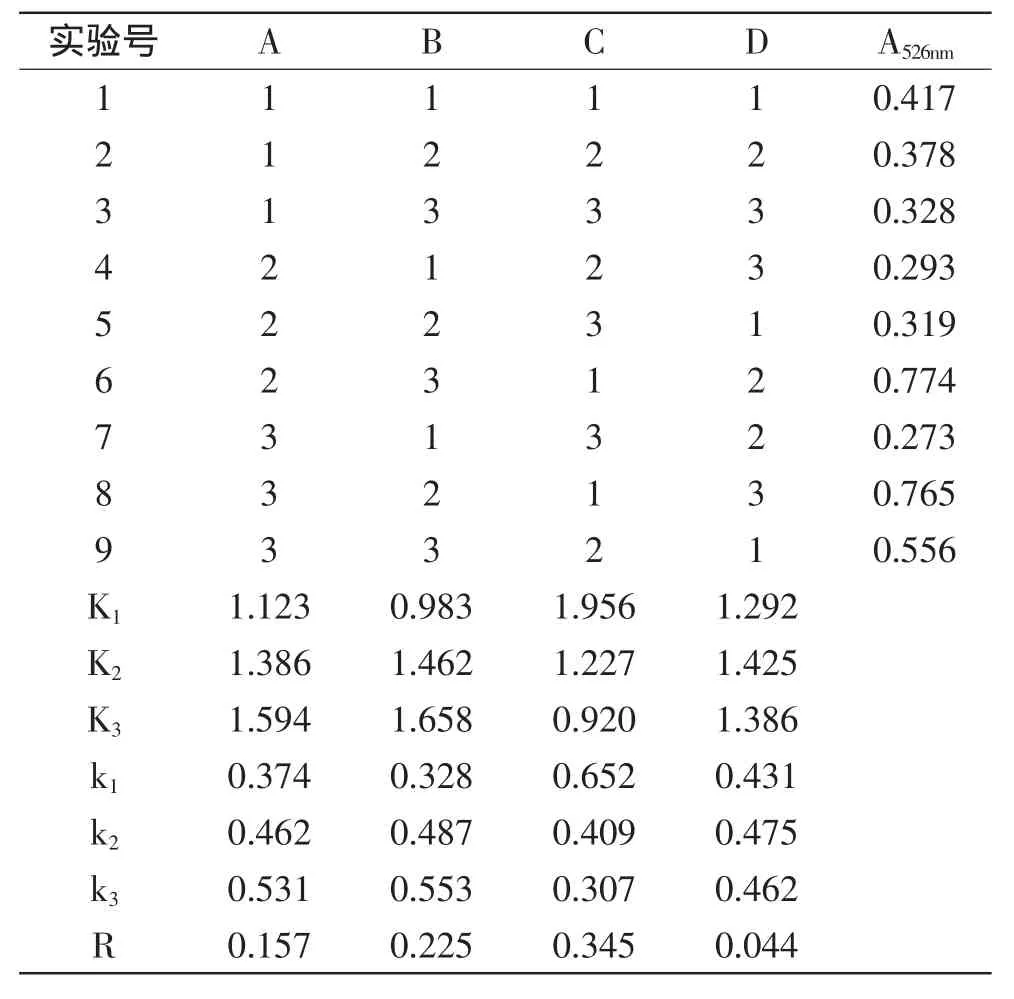
表2 L9(34)正交实验结果与分析Table 2 Results and analysis of L9(34)orthogonal experiment
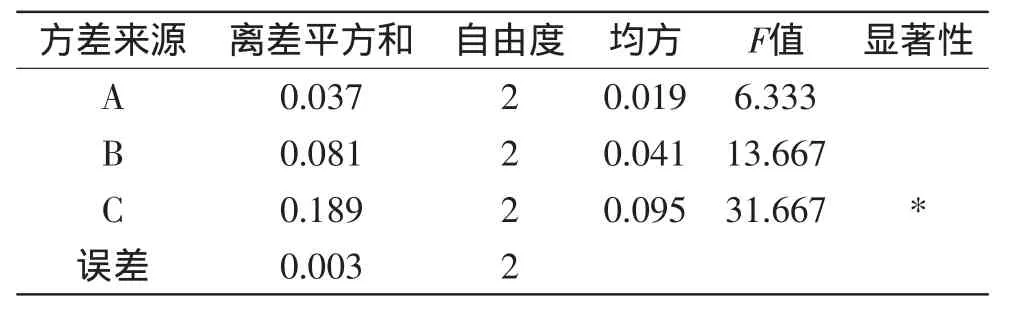
表3 方差分析结果Table 3 The results of variance analysis
从表3方差分析结果可以看出,料液比对紫薯色素提取有显著性影响,其余为不显著因素。结合表2极差分析的结果,可以确定最佳提取组合为A3B3C1D2。按照A3B3C1D2做验证性实验,紫薯色素在526nm处的吸光度值可达0.847。因此,酶-超声波联用提取紫薯色素的最佳工艺参数为:纤维素酶用量20IU/g,酶解pH5.6,料液比1∶10(g/mL),超声时间20min。
2.4 提取次数的确定
按正交实验的最佳提取工艺参数,对紫薯色素进行多次提取,并计算提取率,结果如表4所示。由表4可见,提取3次时,提取率达到98.7%,可将绝大部分色素溶出,所以最佳提取次数确定为3次。

表4 提取次数对紫薯色素提取率的影响Table 4 Effect of extraction times on extraction rate of purple sweet potato pigment
2.5 紫薯色素三种不同提取方法的比较
分别用酶解法、超声法、酶-超声联用法提取紫薯色素,比较三种提取方法对紫薯色素提取率的影响,结果发现酶法、超声法、酶-超声波联用法提取紫薯色素测得A526nm分别为0.608、0.704、0.847。酶-超声波联用法的紫薯色素提取率相比酶法和超声法分别提高了39.3%和20.3%,可见酶-超声波联用提取法可以有效提高紫薯色素的提取率,比单独使用酶法、超声法提取的效果要好。
3 结论
3.1 通过单因素及正交实验确定了紫薯色素的最佳提取工艺参数为:纤维素酶用量20IU/g,酶解时间45min,酶解温度50℃,酶解pH 5.6,料液比1∶10(g/mL),超声时间20min,超声温度50℃。
3.2 在最佳提取工艺参数条件下提取紫薯色素,提取次数为3次时,紫薯色素的提取率可达98.7%,可将绝大多数紫薯色素提取溶出。
3.3 与酶法、超声波提取法相比,酶-超声波联用法提取紫薯色素的提取率分别增加了39.3%和20.3%,使得紫薯色素的提取率大大提高。因此,酶-超声波联用技术是提取紫薯色素的一种高效提取方法,具有实际的应用价值。
[1]曹雁平.我国天然食用色素研究现状[J].食品与发酵工业,2007,33(1):80-84.
[2]王静,刘昭明,肖凯军,等.天然食用色素的结构与生理活性分析[J].食品工业科技,2007,28(12):208-212.
[3]Hallagan J B,Allen D C,Borzelleca J F.The safety and regulatory status of food,drug and cosmetics colour additives exempt from certification[J].Food and Chemical Toxicology,1995,33(6):515-528.
[4]杨巍,黄洁琼,陈英,等.紫薯的营养价值与产品开发[J].农产品加工·学刊,2011(8):41-43.
[5]胡梦琳,杨甲甲,代涛,等.紫薯色素两种提取方法的比对研究[J].食品科学,2011,32(6):247-249.
[6]Zhu H M,Zhao M.Study on chemical constituents and antioxidation activity of anthocyanins from Ipomoea batatas L(purple sweet potato)[J].Chemistry and Industry of Forest Products,2009,29(1):39-45.
[7]Yoshimoto M,Okuno S,Yamaguchi M,et al.Antimutagenicity of deacyleated anthocyanin in purple-fleshed sweet potato[J]. Bioscience,Biotechnology,and Biochemistry,2001,65(7):1652-1656.
[8]Li J W,Zhang L F,Liu Y F.Optimization of extraction of natural pigment from purple sweet potato by response surface methodology and its stability[J].Journal of Chemistry,2013,2013:1-5.
[9]余凡,杨恒拓,葛亚龙,等.紫薯色素的微波提取及其稳定性和抗氧化活性的研究[J].食品工业科技,2013,34(4):322-326.
[10]Lu L Z,Zhou Y Z,Zhang Y Q,et al.Anthocyanin extracts from purple sweet potato by means of microwave baking and acidified electrolysed water and their antioxidation in vitro[J]. International Journal of Food Science&Technology,2010,45(7):1378-1385.
[11]顾红梅,张新申,蒋小萍.紫薯中花青素的超声波提取工艺[J].化学研究与应用,2004,16(3):404-408.
[12]刘洁,叶婷婷.酶-微波辅助提取紫薯花青素的工艺研究[J].广州化工,2012,40(21):60-62.
[13]高路,成义.分子筛-微生物发酵结合法制备紫薯渣膳食纤维研究(II)[J].粮食与油脂,2012(3):26-28.
[14]李治华,谢江,黄驰,等.紫甘薯花青素提取纯化技术研究进展[J].中国农学通报,2013,29(27):192-194.
[15]Chen F,Sun Y Z,Zhao G H,et al.Optimization of ultrasound-assisted extraction of anthocyanins in red raspbeeries and identification ofanthocyanins in extractusing high performance liquid chromatography-mass spectrometry[J]. Ultrasonics Sonochemistry,2007,14(6):767-778.
Study on enzyme-ultrasonic combined extraction method of purple sweet potato pigment
LI Hui1,2,MENG Ya-hong1,2,FU Yan-qing1,2,SUN Li-ping1,2,PENG Lin-cai2
(1.Yunnan Province Food Safety Research Institute,Kunming University of Science and Technology,Kunming 650500,China;2.Faculty of Chemical Engineering,Kunming University of Science and Technology,Kunming 650500,China)
The enzyme-ultrasonic combined extraction method of purple sweet potato pigment was studied by single factor experiment and L9(34)orthogonal experiment.The results showed that the optimum extraction conditions were obtained as follows:cellulase dose 20IU/g,enzymatic hydrolysis time 45min,enzymatic hydrolysis temperature 50℃,enzymatic hydrolysis pH5.6,solid-liquid ratio 1∶10,ultrasonic time 20min and ultrasonic temperature 60℃.Under the optimum conditions,the extraction rate reached up to 98.7%after three times extractions.Furthermore,the three extraction methods(enzymatic extraction,ultrasonic extraction and enzymeultrasonic combined extraction)were compared.The pigment extraction rate of enzyme-ultrasonic combined extraction method increased by 39.3%and 20.3%respectively compared to that of enzyme extraction and ultrasonic extraction.The results of this study indicated that pigment extraction rate of enzyme-ultrasonic combined extraction method was the highest.This study would provide a new extraction method for purple sweet potato pigment.
purple sweet potato;purple sweet potato pigment;cellulose;ultrasonic
TS255.1
B
1002-0306(2014)14-0256-05
10.13386/j.issn1002-0306.2014.14.048
2013-11-19
李辉(1985-),女,博士,讲师,研究方向:食品化学。
云南省省级人培项目(KKSY201305002)。
