米曲霉产果糖基转移酶发酵条件优化与分离纯化
2014-03-01史文婷毛多斌杨雪鹏郑州轻工业学院食品与生物工程学院河南郑州450000
史文婷,刘 寅,赵 越,毛多斌,杨雪鹏(郑州轻工业学院,食品与生物工程学院,河南郑州450000)
米曲霉产果糖基转移酶发酵条件优化与分离纯化
史文婷,刘寅,赵越,毛多斌,杨雪鹏*
(郑州轻工业学院,食品与生物工程学院,河南郑州450000)
通过单因素实验和均匀设计实验对一株产果糖基转移酶的米曲霉摇瓶发酵条件进行优化,其最佳发酵条件为:发酵温度24℃,转速161r/min,装液量50mL/250mL,起始pH5.0,接种量1%,发酵时间96h。在该条件下,果糖基转移酶酶活力达到33.07U/mL,较优化前提高64.6%。通过Desalting脱盐柱,DEAE FF阴离子柱和SepHacryl S-100 HR凝胶柱等分离纯化步骤,经SDS-PAGE检测,该酶呈现一条带,纯化倍数、酶的比活力和收率分别为29.35、231.14U/mg和48.9%。经薄层层析检测,该酶能够生成蔗糖-6-乙酸酯(s-6-a),证明该酶为果糖基转移酶。经计算,该酶分子量约为92.8ku。
米曲霉,果糖基转移酶,优化,分离纯化

图1 受体反应示意图Fig.1 The graph of acceptor reaction
随着人们生活水平的提高,果聚糖(FOS)这类保健糖的需求量不断增大。工业上,通常采用酶法生产FOS,其原理为果糖基转移酶催化裂解蔗糖形成葡萄糖和酶与果糖的过渡态复合物,复合物受到亲核化合物攻击时果糖基转移到不同的受体上生成不同的果糖苷或果糖,这种反应称为受体反应(Acceptor reaction),如图1所示,其中,INV(Invertase)表示转化酶,1-SST(Fructosyltransferase)表示果糖基转移酶,G表示葡萄糖,F表示果糖[1]。近期有关低聚果糖功能的研究较多,例如胡晓燕、郝选明研究发现,补充低聚果糖可以改善甚至逆转6周递增负荷训练引起的大鼠一系列机能下降现象,表明其对免疫抑制有显著调节作用[2];王乃强、李国庆等研究发现低聚果糖能够显著提高小鼠对钙离子的吸收效率,为低聚果糖在补钙食品行业中的应用提供理论支持[3];刘晓梅、彭芝榕等研究发现低聚果糖和乳酸杆菌均具有润肠通便的作用并对维持肠道菌群平衡、抑制肠球菌和肠杆菌的生长有较好功效,其通便功用大小与药物剂量浓度有关[4]。
本课题组前期筛选得到了米曲霉菌株,该菌株所产果糖基转移酶转移能力较强[5-7],并能够合成蔗糖-6-乙酸酯[8],故通过采用薄层层析(TLC)技术检测蔗糖-6-乙酸酯(s-6-a)的生成来鉴定所得到的酶为果糖基转移酶。
本实验通过对米曲霉菌株进行发酵条件的优化,并对发酵后酶液进行分离纯化,以期得到纯度较高的酶,为后期进行果糖基转移酶受体反应的动力学和热力学的微观研究奠定基础。
1 材料与方法
1.1材料与仪器
米曲霉O-1由实验室保藏;蔗糖、葡萄糖、果糖、蔗果三糖、蔗果四糖、低聚果糖、葡萄糖-6-乙酸酯(g-6-a)、蔗糖-6-乙酸酯(s-6-a)标样均购于Sigma公司;乙腈、甲醇为色谱纯;其他试剂均为国产分析纯;马铃薯培养基蔗糖16g,马铃薯200g,磷酸氢二钾0.2%,dH2O 1L。
Waters 1525 Binary型高效液相色谱仪美国Waters;AKTA explorer 10S型蛋白质纯化仪GE公司;DYCZ-24DN型稳压稳流电泳仪北京六一仪器厂。
1.2实验方法
1.2.1粗酶液的制备取一支活化后的斜面,加入无菌水,制备成孢子悬液,取300μL孢子悬液加入100mL发酵培养基中,28℃,160r/min培养。用6层纱布将菌体过滤洗涤拧干后悬浮于最适缓冲液(pH6.0的磷酸-柠檬酸缓冲液),进行超声波破碎。破碎后经10000r/min,离心60min,上清液即为粗酶液。
1.2.2酶活力测定取2mL 10%的蔗糖溶液(最适缓冲液配制),加入40μL酶液(以蔗果三糖的量不超过总糖的10%为宜)。50℃水浴振荡反应30min,沸水浴15min终止酶反应,离心取上清液制备样品。酶活力定义:50℃条件下,每分钟催化蔗糖生成1μmol蔗果三糖所需的酶量定义为一个酶活单位(U)。
酶活力=0.2×GF2%×1000/(0.504×t×V)[9]
式中:0.2—蔗糖总量(g);GF2%—蔗果三糖的百分含量;0.504—1μmol蔗果三糖的含量(mg);t—反应时间(min);V—上清酶液体积(mL)。
1.2.3糖的检测检测器:Waters 2424 ELS Detector;色谱柱:大连依利特NH2柱(250×4.6mm);流动相为乙腈-水(75∶25);流速:1.0mL/min;进样量:10μL;柱温:30℃,分析时间30min。
1.2.4米曲霉产果糖基转移酶发酵条件的优化
1.2.4.1单因素实验单因素实验包括:起始pH、装液量、接种量、温度、转速以及发酵时间,所有实验均设置3个平行。
1.2.4.2均匀设计利用单因素方差分析法分析上述实验结果,选取影响产酶显著的四个因素进行均匀设计。选取的四个因素为装液量、转速、接种量和温度,每个因素设置5个水平,采用均匀设计表U5(54),见表1。其他培养条件:起始pH5.0,发酵时间96h。
1.2.5蛋白质含量的测定参照文献[10]。

表1 U5(54)均匀设计表Table 1 U5(54)uniform design table
1.2.6SDS电泳检验参照文献[11]。
1.2.7酶的分离纯化将发酵后的粗酶液30K中空纤维柱浓缩后,冷冻干燥成粉末,向粉末中加入适量的最适缓冲液,混匀后,依次通过Desalting脱盐柱、DEAE FF阴离子柱和SepHacryl S-100 HR凝胶柱,流速为1.0mL/min,凝胶柱上样量为10mL,其他两个柱子上样量均为1mL。脱盐柱与凝胶柱均用最适缓冲液进行洗脱,阴离子柱依次用pH6.0、5.0、4.0、3.0的磷酸-柠檬酸缓冲液进行洗脱,最后用pH5.0磷酸-柠檬酸缓冲液(含1mol/L NaCl)洗脱。回收各个纯化步骤的吸收峰进行酶活测定。
1.2.8薄层层析硅胶板为TLC Silica gel 60;层析液为正丁醇∶无水乙醇∶蒸馏水=5∶3∶2,展开两次,显示剂:5%硫酸甲醇。
2 结果与分析
2.1米曲霉果糖基转移酶的产酶条件优化
2.1.1单因素实验优化产酶条件
2.1.1.1装液量对产酶的影响装液量反映了菌株对溶氧的要求,在好氧培养中,氧气的供应往往是发酵过程能否成功的重要因素之一,氧气不足时容易引起乙酸的积累从而影响菌体的生长和产酶量[12]。从图2中可知,装液量为20mL/250mL时酶活最高,其次为40mL/250mL,这可能因为该米曲霉在氧气充足的环境更有利于生长和产酶。由于两者酶活相差不多,考虑到培养基的利用效率,故装液量采用40mL/250mL。

图2 装液量对产酶的影响Fig.2 Effect of loaded liquid on fructosyltransferase produced by Aspergillus oryzae
2.1.1.2接种量对产酶的影响接种量决定着菌体的密集程度,适当的密集度既有利于菌体的生成,也有利于产酶,若密集程度过高,反而会因为营养消耗太快或通氧量不足等问题使酶产量降低[13]。从图3可知,随着接种量的增加,酶活力的总体趋势呈现先减小再增加再减少的过程,这也与上述的理论相符合。当接种量为300μL/40mL时,由于此时的养分和溶氧最有利于菌体的生长于产酶,故果糖基转移酶的酶活力最大。
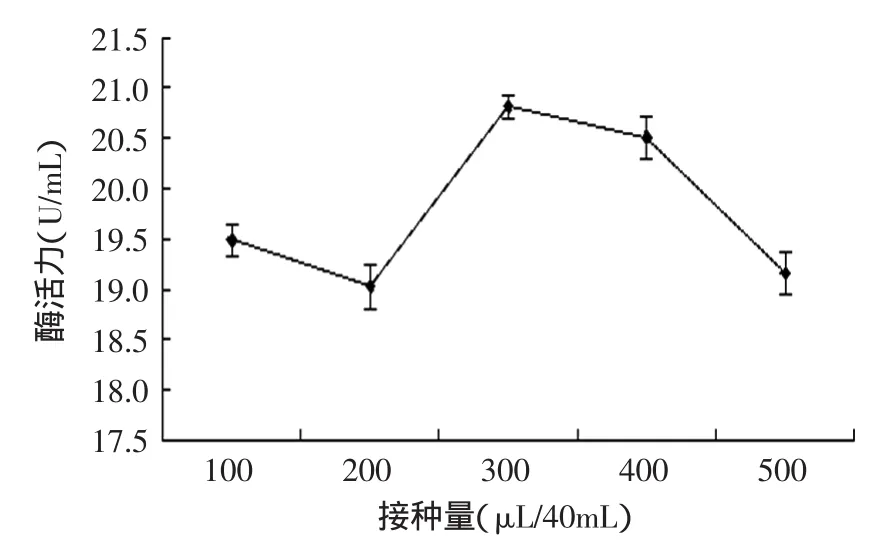
图3 接种量对产酶的影响Fig.3 Effect of inoculum size on fructosyltransferase produced by Aspergillus oryzae
2.1.1.3发酵时间对产酶的影响测定不同发酵时间培养的发酵液的酶活力,结果如图4所示。由图4可知,随着发酵时间的延长,果糖基转移酶酶活也呈现出先升后降的趋势,当发酵时间达到96h时,酶活达到最大,之后酶活力开始降低,这可能由于发酵前期,米曲霉主要进行自身繁殖生长,同时伴随有果糖基转移酶的生成,当发酵到96h,此时米曲霉达到最大生物量,故产酶量最高,随着发酵继续进行,米曲霉开始进入衰亡期,故产酶量下降。因此,选择96h作为最佳培养时间。

图4 发酵时间对产酶的影响Fig.4 Effect of fermentation time on fructosyltransferase produced by Aspergillus oryzae
2.1.1.4起始pH对产酶的影响pH主要从酶的活性,细胞膜所带电荷的状态以及代谢过程等方面影响菌体生长繁殖和发酵产物合成,因此,采用不同起始pH的发酵培养基对米曲霉产酶进行研究[14],结果见图5。由图5可知,当起始pH为5.0时酶活力最高,这表明该米曲霉在偏酸性的环境中能够更好生长与产酶。
2.1.1.5温度对产酶的影响温度主要从发酵动力学特性,菌体代谢产物合成方向,微生物代谢调节机制,发酵液的理化性质等方面来影响产物的合成[15]。当温度升高时,米曲霉的代谢加快,这就加速酶的产生,但是当温度超出了米曲霉的最适温度时,由于米曲霉的代谢受到一定程度的限制,从而使产酶量下降。通过对温度因素的考察,结果如图6所示。从图6中可知,当温度为28℃时,果糖基转移酶的酶活力最高,这说明,当温度达到28℃时,米曲霉生长代谢最为旺盛,产酶量最多,故酶活最高。

图5 起始pH对产酶的影响Fig.5 Effect of initial pH on fructosyltransferase produced by Aspergillus oryzae
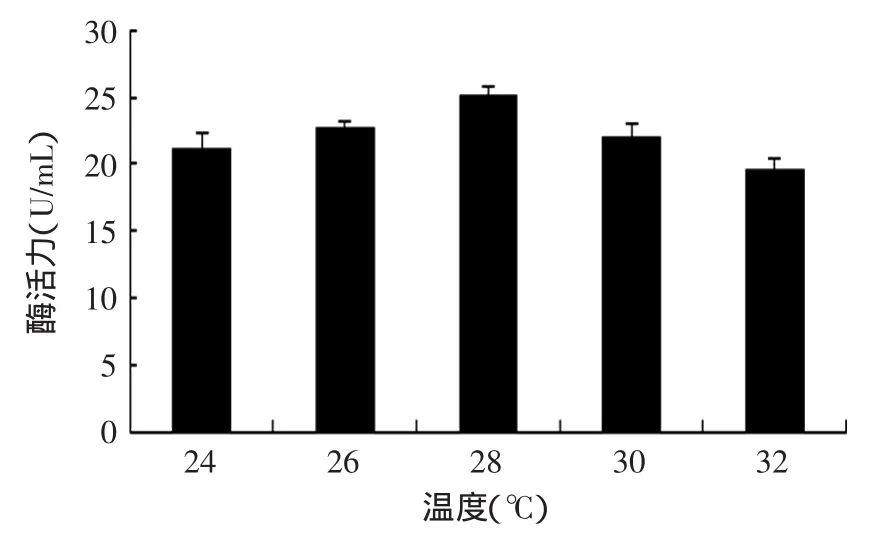
图6 温度对产酶的影响Fig.6 Effect of temperature on fructosyltransferase produced by Aspergillus oryzae
2.1.1.6转速对产酶的影响转速与装液量均为影响溶氧的重要因素,因此对转速的研究也十分重要。从图7中可知,当摇床转速为150r/min时,米曲霉所产果糖基转移酶的酶活达到最大,这说明该转速下,发酵培养基中的溶氧量更加有利于米曲霉菌体的生长,故酶活最高。

图7 转速对米曲霉产果糖基转移酶的影响Fig.7 Effect of rotate speed on fructosyltransferase production produced by Aspergillus oryzae
2.1.2均匀设计实验经过均匀设计实验,结果见表2。

表2 均匀实验结果Table 2 The result of uniform design
通过DPS软件进行回归分析,得到酶活大小(Y)与各因素(X)之间的关系方程为Y=63.567+0.006X3-1.394X4+0.0000076X32,相关系数R=0.999,F=5282.71,p=0.0101。各因素的最佳组合为:装液量50mL/250mL,转速161r/min,接种量500μL(1%),温度24℃,理论酶活可达35.14U/mL。根据DPS软件回归分析的结果进行验证实验,发酵液酶活为33.07U/mL,与理论值相符。通过优化,酶活力较优化前提高了64.6%,这说明该优化是行之有效的,这为后面进行酶的分离纯化奠定了良好的基础。
2.2酶的分离纯化
分离纯化步骤结果见表3。
从表3中可以看出,经过分离纯化,酶的比活力达到231.14U/mg,纯化倍数达到29.35,收率为48.9%。经SDS-PAGE电泳检测,结果如图8所示。从图8中可知,所纯化的样品呈现一条带。经计算[11],该米曲霉果糖基转移酶的相对分子质量大致为92.8ku。

图8 SDS-PAGE电泳图Fig.8 SDS-PAGE pattern of the purified protease from Aspergillus oryzae
对分离纯化后得到的纯酶液进行薄层层析(TLC),检测其能否催化蔗糖生成s-6-a,结果见图9。如图9所示,经过一系列纯化步骤后,得到的电泳纯的酶液能够催化葡萄糖-6-乙酸酯(g-6-a)生成蔗糖-6-乙酸酯(s-6-a),故证明了该纯化后的酶液为果糖基转移酶。

图9 纯酶的蔗糖-6-乙酸酯检测Fig.9 The detection of s-6-a for fructosyltransferase after purification
3 结论
经过单因素实验和均匀设计实验,对一株米曲霉产果糖基转移酶的发酵条件进行优化,得到了最优的产酶条件:装液量50mL/250mL,接种量1%,温度24℃,转速161r/min,起始pH5.0,培养时间96h。通过优化,果糖基转移酶的酶活力可高达33.07U/mL,较之前提高了64.6%。将优化后粗酶液进行超滤、凝胶柱层析等纯化过程,得到了电泳纯的酶液,纯化倍数、比活力和收率分别为29.35、231.14U/mg和48.9%。经薄层层析检测,该纯化后的酶液能够生成蔗糖-6-乙酸酯(s-6-a),故证明纯化后的酶液为果糖基转移酶。经计算,该酶的分子量为92.8ku,与相关文献结果较为接近[16-18]。
为了对该酶进行动力学、热力学反应研究以及酶的应用研究,拟对纯化后的酶进行进一步的氮端测序,以期采用基因工程的方法获得大量的纯酶。

表3 果糖基转移酶各纯化步骤结果Table 3 Separation and purification of fructosyltransferase
[1]Altenbach D,Rudino-Pinera E,Olvera C,et al.An acceptorsubstrate binding site determining glycosyl transfer emerges from mutant analysis of a plant vacuolar invertase and a fructosyltransferase[J].Plant Mol Biol,2009,69:47-56.
[2]胡晓燕,郝选明.补充低聚果糖对递增负荷训练大鼠免疫指标的影响[J].中国运动医学杂志,2012(4):336-340.
[3]王乃强,李国庆,刘辉,等.低聚果糖促进钙离子吸收的研究[J].精细与专用化学品,2013(5):20-23.
[4]刘晓梅,彭芝榕,倪学勤,等.低聚果糖、乳酸杆菌对便秘模型大鼠的通便功能影响[J].食品科学,2013(11):296-299.
[5]Chen LP,Han YW,Mao DB.Activity identification and analysis of fructosyltransferase from different strains[J].Xiandai Nongye Keji,2009,18:332-335.
[6]Chen LP,Han YW,Mao DB.Cloning and analysis of fructosyltransferase gene from Bacillus subtilis[J].Journal of Henan Agricultural University,2009,47:21-26.
[7]Han YW,Chen LP,Mao DB.Expression and activity analysis of sucrose:sucrose 1-fructosyltransferase from onion,New Biotechnology,2010,27:341-346.
[8]Han YW,Liu GM,Huang DY,et al.Study on the synthesis of sucrose-6-acetate catalyzed by fructosyltransferase from Aspergillus oryzae[J].New Biotechnology,2011,28:14-18.
[9]何熙璞,张敏,蒋勇才,等.产果糖基转移酶米曲霉菌株的选育[J].食品研究与开发,2007,28(9):1-4.
[10]苏雪燕,车程川,刘金峰,等.地衣芽胞杆菌产纤溶酶的分离、纯化及其酶学性质研究[J].曲阜师范大学学报,2013(7):85-88.
[11]聂立影,郑春阳.来自Pyrococcus horikoshii的极端耐热β-1,4-内切纤维素酶的分离纯化与酶学性质[J].天津理工大学学报,2013(8):51-56.
[12]Goyal D,Sahni G,Sahoo D K.Enhanced production of recombinant streptokinase in Escherichia coli using fed-batch culture[J].Bioresource Technology,2009,100(19):4468-4474.
[13]窦烨,王清路,李俏俏.毕赤酵母工程菌发酵条件的优化[J].食品工业科技,2008(6):168-171.
[14]Wu Q,Xu H,Ying HJ,et al.Kinetic analysis and pH-shift control strategy for poly(gamma-glutamic acid)production with BacillussubtilisCGMCC0833[J].BiochemicalEngineering Journal,2010,50(2):24-28.
[15]Wei G,Li Y,Du G.Application of a two-stage temperature control strategy for enhanced glutathione production in the batch fermentation by Candida utilis[J].Biotechnol Lett,2003,25:887-890.
[16]杨正茂,秦克亮,赵玉秀,等.β-果糖基转移酶和β-呋喃果糖苷酶的分离纯化[J].中国医药工业杂志,2002,33(5):219-222.
[17]Lamia L’Hocine,Zhang W Bo,et al.Purification and partial characterizationoffructosyltransferaseandinvertasefrom Aspergillus niger AS0023[J].Biotechnology,2000,81(1):73-84.
[18]陈华.海藻糖合成酶和果糖基转移酶的分离纯化及部分性质研究[D].南宁:广西大学,2001.
Fermentation conditions optimization and purification of fructosyltransferase produced by Aspergillus oryzae
SHI Wen-ting,LIU Yin,ZHAO Yue,MAO Duo-bin,YANG Xue-peng*
(Food and Bioengineering College,Zhengzhou University of Light Industry,Zhengzhou 450000,China)
The optimal fermentation conditions of fructosyltransferase produced by Aspergillus oryzae was studied by single-factor experiment and uniform design.The optimized conditions was temperature 24℃,rotation rate 161r/min,medium volume 50mL/250mL,initial pH5.0 and inoculum size 1%.The highest enzyme activity was 33.07U/mL after 96h,64.6%higher than before.The fructosyltransferase was separated and purified by using a procedure including column chromatography separation by Desalting,DEAE FF and SepHacryl S-100 HR.The final purified fold,specific activity and yield of the purified enzyme were 29.35,231.14U/mg and 48.9%,respectively.The purified enzyme was confirmed to be homogeneous by SDS-PAGE.Detected by thin layer chromatography(TLC),the enzyme was able to generate sucrose-6-acetate(s-6-a),as proof of fructosyltransferase.Its molecular weight was estimated to be 92.8ku.
Aspergillus oryzae;fructosyltransferase;optimization;purification
TS201.3
A
1002-0306(2014)14-0211-05
10.13386/j.issn1002-0306.2014.14.038
2013-09-27*通讯联系人
史文婷(1989-),女,硕士研究生,主要从事酶工程方面的研究。
国家自然科学基金项目(20676127);河南省农业科技攻关项目(102102110044)。
