乳酸乳球菌的高密度发酵研究
2014-03-01冯慧杰沐万孟江南大学食品科学与技术国家重点实验室江苏无锡214122
冯慧杰,沐万孟,张 涛,江 波(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
乳酸乳球菌的高密度发酵研究
冯慧杰,沐万孟,张 涛,江 波*
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
为了提高一株乳酸乳球菌(Lactococcus lactisSYFS 1.009)单位体积活菌数,通过单因素和正交实验对培养基中各组分进行了研究,并在此基础上,利用3L发酵罐进行恒pH补料实验。结果表明,优化后确定最优的培养基组成为:葡萄糖30g/L,酵母膏40g/L,磷酸二氢钾40g/L,MgSO40.6g/L,MnSO4·H2O 0.1g/L,吐温80 0.5mL/L。此条件下,30℃发酵14h后菌体干重为3.1g/L,是MRS培养基培养条件下的3.4倍(菌体浓度0.9g/L)。在发酵罐恒pH补料12h后,发酵液OD600达到15.3,菌体干重为7.3g/L。
乳酸乳球菌,磷酸二氢钾,乳酸
乳酸乳球菌作为一种益生菌,是乳制品发酵工业中重要的发酵剂,同时也可生产乳酸链球菌素(nisin),胞外多糖,γ-氨基丁酸,乳酸等。另外作为GRAS(Generally Regard as Safe)菌株,乳酸乳球菌也常被用作基因工程的受体菌。由于乳酸乳球菌的细胞数量是决定发酵剂性能和提高产物产量(在确保单位细胞酶活不变的前提下)的关键环节,因而乳酸乳球菌的高密度培养显得十分重要。在乳酸菌高密度发酵方法的研究中,国内研究者对缓冲盐法和化学中和法研究较多,但最终获得菌体浓度较小,一般不超过4g/L[1]。国外研究者还应用透析法和细胞循环法培养乳酸菌。Osborne在1977年首次将透析应用到乳酸杆菌培养中,获得了30~40g/L的细胞干重[2]。TAKAHIRO SUZUKI用陶瓷滤器去除乳酸的方法,经238h获得细胞干重高达141g/L[3]。虽然透析法和细胞循环法比缓冲盐法和化学中和法菌体密度有很大提高,但是需要对发酵罐做重大的技术改造且有膜污染等问题,不利于工业化推广。
本实验所采用菌株是实验室保藏的一株乳酸乳球菌(Lactococcus lactisSYFS1.009)。本文根据乳酸乳球菌的生长特性,在考察碳氮源等因素的基础上,着重对缓冲盐体系及发酵罐恒pH补料操作进行了探索,为后续该乳酸乳球菌细胞转化法生产相应产物奠定了基础。
1 材料与方法
1.1 材料与仪器
乳酸乳球菌(Lactococcus lactisSYFS1.009) 由实验室保藏;葡萄糖、酵母膏、牛肉膏、蛋白胨、乳糖、蔗糖、麦芽糖、硫酸铵、硝酸铵、吐温80、MgSO4·7H2O、MnSO4·4H2O等 均为分析纯,国药集团化学试剂有限公司;乳酸 色谱纯,Sigma公司。
CL-40M型全自动蒸汽灭菌锅 日本ALP公司;Centrifuge 5804R型离心机 德国Eppendorf公司;Alpha-1系列紫外可见分光光度计 上海谱元仪器有限公司;pH计 梅特勒-托利多仪器有限公司;电热恒温鼓风干燥箱 上海恒科有限公司;SW-CJIFD型超净工作台 苏净集团安泰空气技术有限制造公司;Agilent 1200型高效液相色谱仪 美国安捷伦公司;B1-150A型低温生化培养箱 施都凯仪器设备(上海)有限公司;BIOFLO-110型3L发酵罐 美国NBS公司。
1.2 实验方法
1.2.1 培养基的制备 MRS液体培养基(g/L):葡萄糖20,酵母膏5,牛肉膏10,蛋白胨10,K2HPO42,乙酸钠5,柠檬酸氢二铵2,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,吐温80 1mL,pH6.8~7.0。斜面培养基是在MRS液体培养基基础上添加20g/L琼脂。
1.2.2 菌种制备与传代 将乳酸乳球菌保藏菌种转接于斜面试管中,30℃下培养24h,4℃保存。从保藏的斜面试管培养基中挑取菌落于装有100mL MRS液体培养基的250mL三角瓶中,30℃静置培养24h,传代2~3次进行后续实验。
1.2.3 发酵条件 三角瓶发酵条件:250mL三角瓶中装入发酵培养基100mL,调初始pH为6.8~7.0,种子接种量为1%,30℃静置培养14h后测定OD600。3L发酵罐发酵条件:装液量为2L,接种量为1%,30℃培养,转速为50r/min,不通气。
1.2.4 单因素实验设计
1.2.4.1 不同碳源对菌体密度的影响 分别采用2%的葡萄糖、乳糖、蔗糖、麦芽糖、果糖作为不同的碳源,其他培养基成分参照1.2.1中MRS培养基组成添加,进行三角瓶发酵实验,以发酵液OD600为依据优化碳源。
1.2.4.2 不同氮源对菌体密度的影响 分别采用2.5%的蛋白胨、酵母膏、牛肉膏、胰蛋白胨,硫酸铵、硝酸铵、0.5%酵母膏+1%牛肉膏+1%蛋白胨、0.83%酵母膏+0.83%胰蛋白胨+0.83%蛋白胨作为不同的氮源,碳源种类为1.2.4.1中选定碳源,其他成分参照1.2.1中培养基组成添加,进行三角瓶发酵实验,以发酵液OD600为依据优化氮源。
1.2.4.3 缓冲盐体系的筛选及浓度的确定 分别向培养基中添加浓度为0.05~0.45mol/L的pH为7的各缓冲体系,分别是磷酸二氢钠/磷酸氢二钠;磷酸二氢钾/氢氧化钠;磷酸氢二钠/柠檬酸;磷酸氢二钠/磷酸二氢钾;檬酸钠/乙酸钠/磷酸氢二钾;磷酸氢二钾/乙酸钠/柠檬酸氢二铵,氮源为25g/L酵母膏,其他成分与MRS培养基相同,测定OD600来挑选合适的缓冲盐体系。
1.2.4.4 碳氮源总量及碳氮比的筛选 在缓冲盐实验的基础上,分别用5%~9%的碳氮总量与0.25~2的碳氮比组合取代原培养基中碳、氮源,其他成分与MRS培养基相同,接种发酵,根据菌体生长情况来确定适宜的碳氮量。
1.2.4.5 微量元素、吐温80对菌体生物量的影响 以30g/L葡萄糖,40g/L酵母膏,40g/L磷酸二氢钾为培养基主要成分,其他成分参照MRS培养基。按浓度为0.05、0.1、0.2、0.5、0.7、1、2g/L添加MnSO4·H2O,按浓度为0.1、0.25、0.5、0.7、1、2、3、5g/L添加MgSO4,按浓度为0.02、0.05、0.07、0.1、0.2、0.5g/L添加CuSO4,按浓度为0.05、0.1、0.3、0.5、0.7、1、1.5、2、5g/L添加FeSO4·7H2O,按浓度为0.5、1、2、4、8mL/L添加吐温。根据菌体生长情况来确定适宜的浓度。
1.2.5 正交实验 在单因素实验的基础上,选择葡萄糖、酵母膏、磷酸二氢钾为主要影响因素进行L9(34)正交实验,以发酵液OD600为考察指标,确定最佳组分。正交实验因素水平表见表1。
1.2.6 恒pH补料3L发酵罐实验 利用优化后的培养基进行3L发酵罐恒pH补料实验,自动流加25%的氨水维持pH恒定为7.0±0.3,用500g/L的葡萄糖浓缩液维持发酵液中葡萄糖含量为10g/L以上,每2h取样离线检测菌体生物量、残糖量和乳酸含量,发酵时间为24h。

表1 正交实验因素水平表Table 1 Factors and levels of the orthogonal tests
1.3 测定方法
1.3.1 生物量测定
1.3.1.1 菌体密度 取发酵培养液,以空白培养基为对照,用紫外可见分光光度计在600nm波长下测定。
1.3.1.2 菌体干重 取30mL发酵液于10000r/min离心10min后收集菌体,经蒸馏水洗涤两次后重新离心,去上清液后置于90℃烘箱干燥中过夜测定。
1.3.2 乳酸的测定 高效液相色谱法,发酵液离心后稀释10倍,再经0.45μm膜过滤,经高效液相分析仪上样测定。测定条件:色谱柱为Hypersil ODS(5μm,4.0mm×250mm),甲醇和0.01mol/L的磷酸5∶95为流动相,流速为2.0mL/min,检测波长为210nm,进样量为5μL[4]。
1.3.3 残糖的测定 DNS法[5]。
2 结果与分析
2.1 不同碳源对菌体密度的影响
不同碳源对Lactococcus lactis SYFS1.009生长情况的影响见图1,实验结果表明,对菌体生长的影响大小排序是乳糖>葡萄糖>果糖>麦芽糖>蔗糖。葡萄糖和乳糖做碳源时,发酵液中菌体密度较高,综合考虑原料成本与菌体生长情况,选择葡萄糖作为碳源。

图1 不同碳源对菌体浓度的影响Fig.1 Effect of different carbon sources on the growth of bacteria
2.2 不同氮源对菌体密度的影响
不同氮源对Lactococcus lactisSYFS1.009生长情况的影响见图2。由图2可知,在酵母膏作为单一氮源的情况下,菌体浓度要高于其他氮源和混合氮源。这主要是由于酵母膏中尼克酸、叶酸、钴胺酸含量较高,其在中、酸性环境中对热稳定,且富含多种氨基酸,对菌体生长有显著的促进作用[6]。因此选择酵母膏作为最佳氮源。
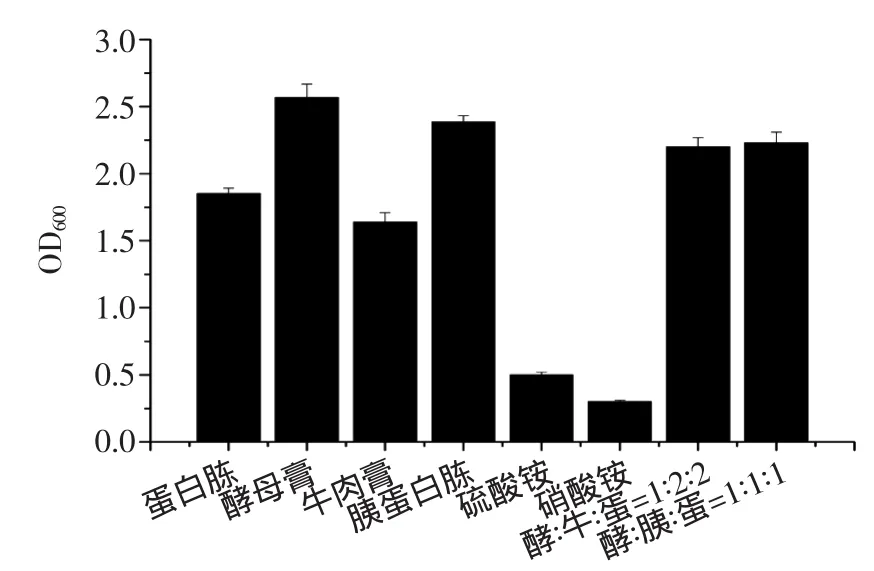
图2 不同氮源对菌体浓度的影响Fig.2 Effect of different nitrogen sources on the growth of bacteria
2.3 缓冲盐体系的筛选及确定
由表2可知,培养基中添加缓冲体系对菌体的增殖效果明显高于对照组。不同的是,后两组缓冲体系在低浓度时缓冲效果明显优于前四组,但随着缓冲体系浓度的增大,前四组缓冲体系培养下的菌体密度不断加大,在0.25mol/L的缓冲体系浓度下仍然有增加的趋势,而后两组菌体浓度则随着缓冲盐体系浓度增大呈先提高后降低的趋势。
为进一步优化缓冲体系的研究结果,对磷酸二氢钠/磷酸氢二钠、磷酸二氢钾/氢氧化钠、磷酸氢二钠/柠檬酸、磷酸氢二钠/磷酸二氢钾四种缓冲体系进行了更高浓度下菌体生长情况的研究。由图3结果可见,在磷酸二氢钾/氢氧化钠缓冲体系下,菌体浓度随缓冲体系浓度增加而增加,且在0.45mol/L时明显高于其他组,OD值达到3.6。此时磷酸二氢钾添加量约为42g/L。而其他三组缓冲体系在0.25mol/L的添加量后逐渐减低。因此选择磷酸二氢钾/氢氧化钠作为最佳缓冲体系。
由上述实验知,磷酸二氢钾/氢氧化钠缓冲体系对乳酸乳球菌发酵液具有很高的缓冲能力,可能导致培养基中碳源、氮源完全消耗。为了更准确地确定适宜的缓冲盐浓度,对培养基中的碳、氮源浓度进行了翻倍,分别为40g/L、50g/L。在此基础上,分别在培养基中添加0~90g/L的磷酸二氢钾(用氢氧化钠调节pH为7.0),以10g/L为增加量。以OD600为依据,选择合适的磷酸二氢钾浓度。由图4可知,在碳、氮源加倍的情况下,发酵液OD600随着磷酸二氢钾浓度的增大呈先升高后降低的趋势。OD600在40g/L磷酸二氢钾浓度下达到最高,为4.14。随后菌体密度逐渐减低,这可能是由于超高浓度的磷酸二氢钾中高浓度的钾离子,对细胞渗透压造成了影响。根据本实验结果知,40g/L的磷酸二氢钾对乳酸乳球菌生长有显著地促进作用,然而这种高浓度的磷酸盐作为发酵培养基的缓冲盐是极为少见的,在乳酸菌发酵方面国内未发现类似报道。而国外也仅有Vuyst等学者[7]发现培养基中添加50g/L的磷酸二氢钾可以显著增加nisin的产量。

图3 不同浓度的四种缓冲盐体系对菌体浓度的影响Fig.3 Effect of different four buffers on the growth of bacteria

图4 不同浓度的磷酸二氢钾对菌体浓度的影响Fig.4 Effect of K2HPO4content on the growth of bacteria

表2 不同缓冲盐体系对Lactococcus lactis SYFS1.009菌体浓度的影响Table 2 Effect of different buffers on the growth of Lactococcus lactis SYFS1.009
2.4 碳氮源总量及碳氮比的筛选
碳源和氮源利用之间有密切的关系,二者之间的比例能够直接影响微生物的生长和发酵产物的积累[8]。氮源过多则会使菌体生长过于旺盛,容易引起菌体的衰老和自溶;碳源过多则容易形成较低的pH,不利于菌体生长[9]。由图5结果可知,菌体浓度随培养基碳氮比例变化而变化,基本上是呈先增大后减小的趋势。当碳氮比为0.75时,菌体浓度较高。综合考虑选择碳氮总量为7%,碳氮比为0.75作为最佳碳氮组分。

图5 碳氮总量和碳氮比对Lactococcus lactis SYFS1.009菌体浓度的影响Fig.5 Effect of different carbon nitrogen ratios on the growth of Lactococcus lactis SYFS1.009
2.5 微量元素、吐温80对菌体浓度的影响
Mg、Mn、Cu、Fe等微量元素作为酶的激活剂或生物活性物质的组成成分也是微生物在生长繁殖过程中所不可缺少的[10],因此需要实验来确定它们的用量。图6显示了在分别添加了不同浓度的MgSO4,MnSO4·H2O,FeSO4·7H2O和CuSO4的培养基中Lactococcus lactisSYFS1.009的生长情况。从本实验的结果可以看出,培养基中添加Mn2+、Mg2+对菌体生长有显著的促进作用。考虑菌体生长情况,选择MgSO4、MnSO4·H2O的添加量分别为100、600mg/L。FeSO4·7H2O和CuSO4在低浓度时对菌体生长有微弱的促进作用,但浓度增大时,对菌体生长有很强的抑制作用,因此不考虑添加此两种微量元素。
由图7结果可知,吐温80作为培养基中的表面活性剂,对菌体生长有微弱的促进作用,因此选择合适的吐温80浓度为0.5mL/L。
2.6 正交实验
2.6.1 正交实验结果分析 在以上实验基础上,根据OD600对上述三个因素进行L9(34)正交实验。实验结果见表3。

图6 微量元素对菌体浓度的影响Fig.6 Effect of trace elements on the growth of bacteria
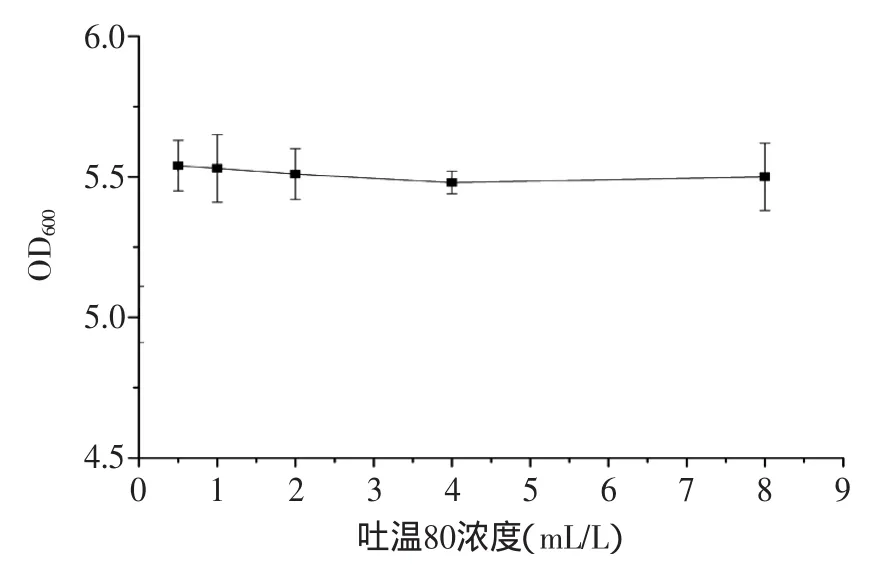
图7 吐温80对菌体浓度的影响Fig.7 Effect of Tween 80 content on the growth of bacteria
由表3和表4可以看出,在选定的水平范围内,三个因素对菌体密度影响大小次序为磷酸二氢钾(C)>酵母膏(B)>葡萄糖(A),葡萄糖对菌体生长具有显著影响,酵母膏和磷酸二氢钾对菌体生长情况具有极显著影响。综上可知,最佳工艺条件A1B2C2,即葡萄糖30g/L,酵母膏40g/L,磷酸二氢钾40g/L。
2.6.2 验证实验 按A1B2C2最佳工艺条件进行三次重复实验,结果表明,OD600为6.35,高于正交实验结果表3中其他组合值。测定此条件下菌体干重为3.1g/L,是MRS相同培养条件下0.9g/L的3.4倍。
2.7 恒pH补料3L发酵罐实验
在3L的发酵罐中接种发酵,自动流加25%的氨水维持pH始终在7.0±0.3,并保持发酵液中葡萄糖含量在10g/L以上,发酵24h。

表3 正交实验结果Table 3 Results of orthogonal tests
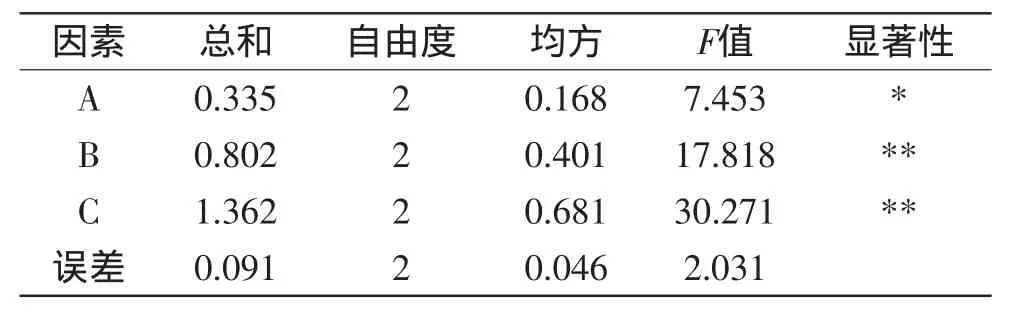
表4 正交实验结果方差分析表Table 4 Variance analysis for OD value

图8 3L发酵罐恒pH补料培养过程曲线Fig.8 Time curve of fermentation in 3L bioreactor
由图8分析可知,接种后2h内菌体生长基本属于延滞期,乳酸产生量和葡萄糖消耗量均较小。2~10h为对数生长期,期间消耗大量的葡萄糖,并在葡萄糖含量低于10g/L的6h和8h添加葡萄糖,使发酵液中葡萄糖含量分别提高了8g/L和3g/L。在对数生长期内,菌体浓度迅速提高,OD600从2.0提高到14.3,并在12h达到最高值15.3,此时菌体干重测得为7.3g/L。随着葡萄糖的大量消耗,发酵液中乳酸含量也急剧增大,在10h就已高达36g/L,24h最终乳酸含量为45g/L。有文献指出,发酵培养基中加入缓冲体系和加碱中和可以较大程度上减缓乳酸对乳酸菌生长的抑制,但生成的乳酸盐浓度过大时也会对菌体生长产生抑制[11]。由此分析可知,10h后菌体生长缓慢甚至衰减,并不是由于底物葡萄糖没有及时补充,而是产生的乳酸和乳酸盐有产物抑制效应。为了更好提高菌体浓度,后期实验需在减少乳酸及乳酸盐方面做更深入的研究。
3 结论
经实验确定Lactococcus lactisSYFS1.009最适培养基为:葡萄糖30g/L,酵母膏40g/L,磷酸二氢钾40g/L,MgSO40.6g/L,MnSO4·H2O 0.1g/L,吐温80 0.5mL/L。此条件下,14h发酵液OD600为6.32,干重为3.1g/L,是MRS培养基培养条件下的3.4倍。在发酵罐恒pH补料12h后,发酵液OD600达到15.3,菌体干重为7.3g/L。
[1]张广敏,王炜,包慧芳,等.植物乳杆菌Lp2的高密度发酵[J].中国生物工程杂志,2009,29(6):68-73.
[2]Osborne R J W.Production of frozen concentrated cheese starters by diffusion culture[J].Soc Diary Technol,1977,30:40-44.
[3]TakahiroSuzuki.Adensecellculture system for microorganisms using a stirred ceramic membrane reactor incorporating asymmetric porous ceramic filters[J].Journal of fermentation and bioengineering,1996,82(3):264-271.
[4]章新,朱惠贤,王林,等.用快速分离柱高效液相色谱法生物发酵产物中的乳酸[J].中国酿造,2005,148(7):53-54.
[5]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:168-169.
[6]李志成,张连斌,段旭昌.嗜酸乳杆菌生长促进物质研究[J].中国食品学报,2006,6(5):40-44.
[7]Luc De Vuyst,Erick J.Vandamme,Influence of the phosphorus and nitrogen source on nisin production in Lactococcus lactis subsp,lactis batch fermentations using a complex medium[J]. Appl Microbiol Biotechnol,1993,40:17-22.
[8]曹军卫,马辉文.微生物工程[M].第二版.北京:科学出版社,2007:80-88.
[9]余龙江.发酵工程原理与技术应用[M].北京:化学工业出版社,2006:9-11.
[10]李寅,高海军,陈坚.高细胞密度发酵技术[M].北京:化学工业出版社,2006:50-51.
[11]郭淑文,赵树欣,崔景宜,等.以乳清为原料采用混菌发酵技术促进Nisin生产的研究[J].中国酿造,2010,220(7):123-126.
Study on the high cell density culture of Lactococcus lactis
FENG Hui-jie,MU Wan-meng,ZHANG Tao,JIANG Bo*
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In order to improve the cell density of Lactococcus lactis SYFS1.009,the fermentation culture medium and fed-batch culture conditions were studied.The optimum fermentation conditions by single-factor experiment and orthogonal experiment were determined:glucose 30g/L,yeast extract 40g/L,K2HPO440g/L,MgSO40.6g/L,MnSO4·H2O 0.1g/L,Tween 80 0.5mL/L.After cultivated in this medium for 14h at 30℃,DCW(dry cell weight)was 3.1g/L,which was about 3.4 times higher than in MRS(DCW 0.9g/L).After 12h culture,the DCW was up to 7.3g/L and OD600was 15.3.
Lactococcus lactis;potassium dihydrogen phosphate;lactic acid
TS201.1
A
1002-0306(2014)14-0197-05
10.13386/j.issn1002-0306.2014.14.035
2013-11-20 *通讯联系人
冯慧杰(1988-),男,硕士研究生,研究方向:食品加工新技术。
科技部十二五863计划(2011AA100904)。
