冷水鱼肠道抑菌活性乳酸菌的筛选及其生理特性分析
2014-03-01任士菊王俊钢倪永清石河子大学食品学院新疆石河子83000新疆农垦科学院农产品加工研究所新疆石河子83000
任士菊,王俊钢,周 红,邓 梅,马 媛,倪永清,*(.石河子大学食品学院,新疆石河子83000;.新疆农垦科学院农产品加工研究所,新疆石河子83000)
冷水鱼肠道抑菌活性乳酸菌的筛选及其生理特性分析
任士菊1,王俊钢2,周 红1,邓 梅1,马 媛1,倪永清1,*
(1.石河子大学食品学院,新疆石河子832000;2.新疆农垦科学院农产品加工研究所,新疆石河子832000)
利用牛津杯法对分离自冷水鱼肠道的24株乳酸菌进行筛选,得到具有明显抑菌活性的乳酸菌9株,基于菌株的16S rDNA基因序列进行系统发育分析,6株属于Lactococcus属,3株属于Enterococcus属。对9株乳酸菌发酵上清液进行抑菌成分分析和蛋白质性质实验,结果表明,9株乳酸菌的发酵上清液经排除酸和过氧化氢干扰后,对李斯特菌仍具有不同程度的抑制作用;有机酸的产生对实验菌株MHY3-2和MD-2抑菌活性的干扰影响较大,而菌株MB2-1和MD-1受有机酸干扰影响较小,且经排除酸和过氧化氢后的乳酸菌对李斯特菌的抑菌效果最为显著;分析发酵上清液中抑菌物质的蛋白质性质,发现除菌株MB2-2和MD-1对胰蛋白酶表现不敏感外,其余实验菌株发酵上清液经胃蛋白酶和胰蛋白酶处理后均失去抑菌活性,结果表明,实验菌株的发酵上清液中的抑菌物质具有蛋白质的性质,抑菌组分中可能存在类细菌素或细菌素组分。此外,对9株乳酸菌的抗生素耐药性进行初步分析,结果显示,所有实验菌株对氨苄西林、万古霉素、红霉素、氯霉素、环丙沙星和诺氟沙星均表现敏感,为冷水鱼肠道乳酸菌资源的开发利用奠定基础。
抑菌活性,乳酸菌,筛选,生理特性
大多数乳酸菌作为一般公认的安全的(generally recognized as safe,GRAS)[1-3]微生物,被普遍应用于食品保藏技术中,在一定程度上可以延长食品货架期,起到一定防腐的作用。乳酸菌在代谢过程中可以产生有机酸、过氧化氢、双乙酰以及细菌素等抑菌成分物质[4-5],能有效地抑制食品中一些食源性病原菌或腐败菌的生长[6-8]。细菌素作为一种安全的、天然的生物型防腐剂[9]取代化学合成的食品添加剂应用到食品工业具有极大的应用潜能[10]。虽然目前已知的细菌素种类繁多,但广泛应用于食品工业且成功实现商业化生产的仅有乳酸链球菌素Nisin[11]。
乳酸菌在自然界中分布广泛,低温或极端环境中也发现有乳酸菌的存在,但是该类乳酸菌却并未得到充分的认识和开发,尤其在国内关于低温乳酸菌尤其是具有抑菌活性的耐冷乳酸菌的研究和报道为空白。具有很强生长活性和较高比生长速率的产细菌素的适低温乳酸菌,作为生物保护剂在食品保鲜尤其是低温冷藏保鲜中具有更大的优势和极具潜力的应用价值。
我国新疆北部阿勒泰地区地处北纬44°59′35″~49°10′45″之间,境内额尔齐斯河、乌伦古河等流域蕴藏着丰富的冷水鱼资源,为研究和开发具有抑菌活性的低温乳酸菌提供了有利的条件。本研究从新疆冷水鱼肠道分离的24株乳球菌(Lacterococcus spp.)、肠球菌(Enterococcus spp.)中筛选具有抑菌活性的乳酸菌菌株,并对抑菌活性乳酸菌发酵上清液的抑菌物质成分及菌株的生理特性进行了初步研究,为冷水鱼肠道乳酸菌资源的开发和利用奠定基础。
1 材料与方法
1.1 材料与仪器
24株乳酸菌 实验室保藏菌种,分离自新疆阿勒泰地区额尔齐斯河流域冷水鱼肠道;大肠杆菌、李斯特菌 实验室保藏菌株;金黄色葡萄球菌CICC21600 中国工业微生物菌种保藏管理中心购买;MRS肉汤、M17琼脂 青岛高科园海博生物技术有限责任公司;PCR反应试剂 生工生物工程(上海)有限公司;0.22μm微孔滤膜 上海兴亚净化材料厂;抗菌药物纸片 杭州天和微生物试剂有限公司。
5810R高速冷冻离心机 德国eppendorf仪器公司;SPX智能生化培养箱 宁波市江南仪器厂;PHS-3C标准型pH计 上海精密科学仪器有限公司;TC-512PCR扩增仪 英国Techne公司;PowerPac Universal水平电泳仪 美国BioRad公司;UVmini-1240紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 乳酸菌无细胞发酵上清液的制备[12-13]分离自冷水鱼肠道的24株乳酸菌,按2%的接种量接种于100mL MRS液体培养基中,16℃条件下培养48~72h后,离心(10000×g,10min,4℃)获得上清液,并用0.22μm微孔滤膜过滤得到无细胞发酵上清液,于4℃条件下保存备用。
1.2.2 具有抑菌活性乳酸菌的初步筛选 选取金黄色葡萄球菌、大肠杆菌和李斯特菌作为指示菌,采用牛津杯法[14]对24株乳酸菌进行抑菌活性的初步筛选。取100μL指示菌菌悬液(浓度约为106~107CFU/mL)均匀涂布于LB平板,向牛津杯中加入200μL发酵上清液,4℃条件下预扩散3~5h,37℃培养18~24h,测定抑菌圈直径。
1.2.3 乳酸菌发酵上清液中抑菌物质成分分析 选取李斯特菌作为指示菌,采用牛津杯法对9株乳酸菌发酵上清液进行抑菌成分分析。无细胞发酵上清液通过以下几种方式进行处理:用1mol/L无菌NaOH调节上清液pH至6.5(图1B);先调节上清液pH至6.5,再加入过氧化氢酶(终浓度5mg/L)37℃水浴2h,进行灭酶处理(图1C);为进一步确定检测抑菌物质的蛋白质性质,向上清液中分别加入胰蛋白酶和胃蛋白酶(终浓度1mg/mL)37℃水浴2h,进行灭酶处理(见表2),以不做任何处理的发酵上清液作为对照(图1A)。吸取200μL上述处理后的发酵上清液加于牛津杯中,4℃冰箱中预扩散3~5h,37℃培养24h,测量抑菌圈直径,平行测定三次取平均值。
1.2.4 具有抑菌活性乳酸菌的16S rRNA系统发育分析 DNA的提取按照Zeng[15]等的方法进行。采用引物27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和1492R(5′-TAC CTT GTT ACG ACT T-3′)扩增乳酸菌16S rDNA基因。PCR扩增产物通过2%(w/v)琼脂糖凝胶电泳进行检测。PCR产物送交上海生工生物科技有限公司进行测序。测序结果提交到GenBank数据库,通过BLAST工具搜索同源性较高的序列,并采用CLUSTAL X 1.81和MEGA 5.0软件对其进行比对分析并建立系统发育树。
1.2.5 温度对乳酸菌生长的影响 具有抑菌活性的乳酸菌菌株以2%接种量接种于10mL的MRS液体培养基中,分别置于4、12、16、24、28、37℃六个温度条件下进行培养,24h后测定其OD600值。
1.2.6 药物敏感性测定 采用药物纸片琼脂扩散法[16],测定9种具有抑菌活性的乳酸菌对常见15种抗生素的敏感性。吸取100μL菌悬液(浓度为107~108CFU/mL)均匀涂布于M17[17]固体平板表面,待琼脂表面干燥后,将抗菌药物纸片贴于琼脂表面,每个培养皿等间距放置3张同种药物的纸片,置于16℃培养箱中恒温培养24~48h,观察并测定其抑菌圈直径。9株乳酸菌药敏实验的测定,选用金黄色葡萄球菌ATCC25923标准菌株作为质控菌,实验结果参照WHO提供的最新版的NCCLS标准进行判定。
2 结果与分析
2.1 抑菌活性乳酸菌的筛选
采用牛津杯法对分离自冷水鱼肠道的24株乳酸菌进行初步筛选,共得到具有明显抑菌活性的菌株9株。由表1可以看出,9株乳酸菌对李斯特菌、金黄色葡萄球菌和大肠杆菌3种指示菌均具有较好的抑制作用。
2.2 乳酸菌发酵上清液中抑菌物质成分分析
乳酸菌发酵上清液排除有机酸后,发现9种乳酸菌的发酵上清液对李斯特菌的抑制作用均有不同程度的减弱(见图1)。这一现象的产生显然是由于解除了乳酸菌产生的有机酸对指示细菌的抑菌作用[18]。由图1可以看出,有机酸产生对菌株MHY3-2和MD-2抑菌活性干扰影响最显著;而菌株MB2-1和MD-1的发酵上清液经排除酸和过氧化氢处理后,对李斯特菌仍具有较好的抑菌效果,排酸实验对抑菌活性的干扰较小。而对比发酵上清液过氧化氢酶处理前后的实验结果(图1)可以看出,过氧化氢对实验菌株发酵上清液抑菌活性的影响不明显。

表1 具有抑菌活性乳酸菌的初筛结果(mm)Table 1 Preliminary result of lactic acid bacteria with inhibitory activity(mm)

图1 无细胞发酵上清液抑菌物质成分分析Fig.1 Antibacterial substance component analysis of cell-free fermentation supernatant
分析发酵上清液中抑菌物质的蛋白质性质,实验结果(表2)显示,9株乳酸菌发酵上清液经过胃蛋白酶处理后,均失去抑菌活性;除菌株MB2-2和MD-1经胰蛋白酶处理后抑菌圈直径未发生明显变化外,其余菌株产生的抑菌物质对胰蛋白酶均较敏感。上述结果表明,实验菌株的发酵上清液中的抑菌物质具有蛋白质的性质,抑菌组分中可能存在类细菌素或细菌素组分。
2.3 抑菌活性乳酸菌菌株的系统发育
基于9株乳酸菌16S rRNA部分基因序列,使用Maximum Likelihood构建系统发育树(图2),结果显示,具有抑菌活性的9株乳酸菌菌株分别属于Lactococcus和Enterococcus属。由系统发育树可知,这些菌株隶属于Lactococcus属的6株,其中菌株MB2-2,MHY3-4和MB2-3与Lactococcus garvieae亲缘关系较近;MD-1与菌株Lactococcuslactis subsp.lactis NFL(KC146069.1)具有99%的序列相似性,MHY3-2与Lactococcuspiscium MARL41(JN226415.1)的序列相似性在99%以上,而MHY3-3在发育树上与Lactococcusraffinolactis cG08(AB593336.1)的亲缘关系最近。菌株MB2-1,MD-2和MD-3隶属于Enterococcus属,其中菌株MD-2和MD-3在系统发育树上与Enterococcus faecalis LRC31(JF772057.1)聚为一簇,具有较近的进化距离;MB2-1与Enterococcushermanniensis SS1760(GQ337028.1)的16S rDNA序列具有98%的同源性。

图2 基于抑菌活性乳酸菌16SrRNA基因序列构建的系统发育树Fig.2 Phylogenic tree of lactic acid bacteria with inhibitory activity based on 16S rRNA gene partial sequences
2.4 乳酸菌最适生长温度范围的测定
由图3可以看出,实验菌株在低于10℃条件下生长相对缓慢,15~20℃的条件下随着温度的升高,菌液的OD值呈上升趋势。结果表明,乳酸菌的优势生长温度都在20℃以上,最适生长温度在24℃左右,生长温度范围介于4~37℃,属于耐冷乳酸菌范畴。
2.5 抗生素耐药性分析
对9株具有抑菌活性的乳酸菌进行药敏实验,结果(表3)显示,所有实验菌株对氨苄西林、万古霉素、红霉素、氯霉素、环丙沙星和诺氟沙星均表现敏感,而对头孢噻肟、克林霉素、卡那霉素和链霉素均耐药。实验发现,大多数实验菌株对利福平、复方新诺明、青霉素及四环素表现敏感或中度敏感,而大多数实验菌株对对庆大霉素表现耐药。
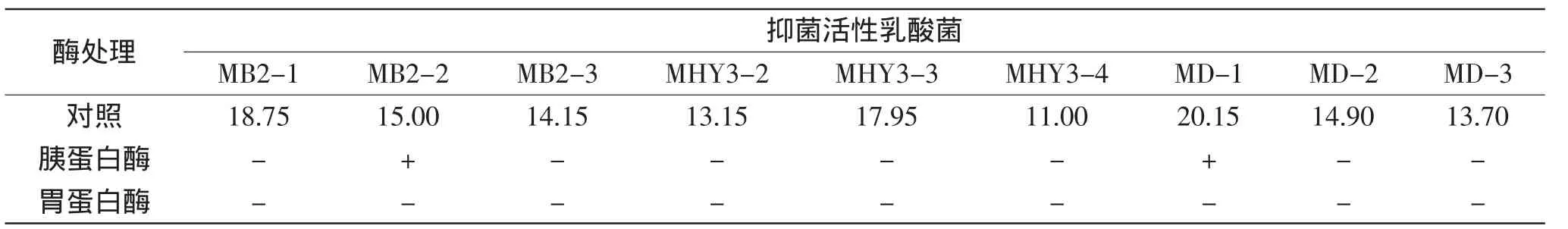
表2 发酵上清液中抑菌物质的蛋白质性质(mm)Table 2 Proteinaceous nature of fermentation supernatant inhibitory substance(mm)

图3 温度对9株抑菌活性乳酸菌生长的影响Fig.3 Effect of temperature on growth of 9 strains of lactic acid bacteria with inhibitory activity
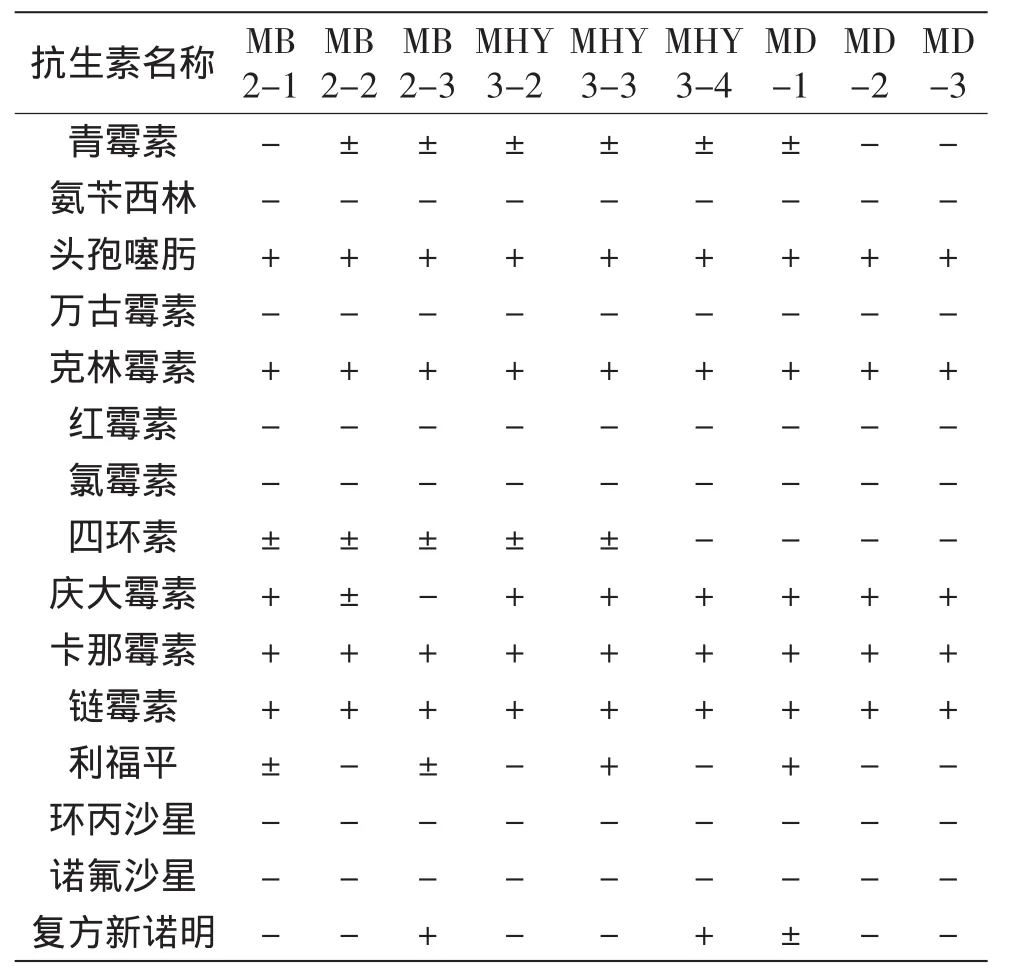
表3 9株具有抑菌活性的乳酸菌对抗生素的耐药性Table 3 Antibiotic resistance of 9 strains of lactic acid bacteria with inhibitory activity
3 结论
选取李斯特菌、金黄色葡萄球菌和大肠杆菌作为指示菌,利用牛津杯法对分离自冷水鱼肠道的24株乳酸菌进行初步筛选,共筛选出具有明显抑菌活性的乳酸菌9株,其中6株隶属于Lactococcus属,其他3株属于Enterococcus属。对9株乳酸菌发酵上清液进行抑菌成分分析和蛋白酶敏感性实验,结果表明,9株乳酸菌发酵上清液中可能存在细菌素或其他抑菌肽成分,这与G Rajaram等[4]报道的乳酸菌产生具有抑菌活性的蛋白或多肽的结论相一致。
研究发现,菌株MB2-1和MD-1排除酸和过氧化氢处理后的发酵上清液对李斯特菌的抑制效果最为突出,经初步分析,这两株乳酸菌可能为产细菌素或类细菌素的优良菌株。
采用药物纸片琼脂扩散法对分属于2个属的9株乳酸菌进行15种抗生素的敏感性测定,结果表明,所有菌株对氨苄西林,万古霉素,红霉素,氯霉素,环丙沙星和诺氟沙星均表现敏感,但对于其他抗生素,不同菌株存在不同程度的耐药性,这可能与菌株是否携带耐药基因及其生物学等特性相关。研究发现,许多肠球菌属菌株存在gelE,esp,ace,efaA,vanA和vanB等毒力基因[19-21],鉴于菌株MB2-1,MD-2和MD-3的安全性,后续我们将会对具有抑菌活性的肠球菌属菌株的毒力基因及其产细菌素的相关特性进行深入研究,为今后将其应用于生物防腐技术及食品保鲜奠定理论基础。
[1]Jamuna M,Jeevaratnam K.Isolation and partial characterization of bacteriocins from Pediococcus species[J].Applied Microbiology and Biotechnology,2004,65(4):433-439.
[2]Macwana S J,Muriana P M.A‘bacteriocin PCR array’for identification of bacteriocin-related structural genes in lactic acid bacteria[J].Journal of Microbiological Methods,2012,88(2):197-204.
[3]Liu S N,Han Y,Zhou Z J.Lactic acid bacteria in traditional fermented Chinese foods[J].Food Research International,2011,44(3):643-651.
[4]Rajaram G,Manivasagan P,Thilagavathi B,et al.Purification and characterization of a bacteriocin produced by Lactobacillus lactis isolated from marine environment[J].Advance Journal of Food Science and Technology,2010,2(2):138-144.
[5]Deegan L H,Cotter P D,Hill C,et al.Bacteriocins:Biological tools for bio-preservation and shelf-life extension[J].International Dairy Journal,2006,16(9):1058-1071.
[6]Jiang J,Shi B,Zhu D Q,et al.Characterization of a novel bacteriocin produced by Lactobacillus sakei LSJ618 isolated from traditional Chinese fermented radish[J].Food Control,2012,23(2):338-344.
[7]Reenen C A V,Chikindas M L,Zyl W H V,et al. Characterization and heterologous expression of a class IIa bacteriocin,plantaricin 423 from Lactobacillus plantarum 423,in Saccharomycescerevisiae[J].InternationalJournalofFood Microbiology,2003,81(1):29-40.
[8]Campos C A,RodríguezÓ,Calo-Mata P,et al.Preliminary characterization of bacteriocins from Lactococcus lactis,Enterococcus faecium and Enterococcus mundtii strains isolated from turbot(Psetta maxima)[J].Food Research International,2006,39(3):356-364.
[9]Perez R H,Himeno K,Ishibashi N,et al.Monitoring of the multiple bacteriocin production by Enterococcus faecium NKR-5-3 through a developed liquid chromatography and mass spectrometry-based quantification system[J].Journal of Bioscience and Bioengineering,2012,114(5):490-496.
[10]Cheigh C I,C H J,Park H,et al.Influence of growth conditions on the production of a nisin-like bacteriocin by Lactococcus lactis subsp.lactis A164 isolated from kimchi[J].Journal of Biotechnology,2002,95:225-235.
[11]Cleveland J,Montville T J,Nes I F,et al.Bacteriocins:Safe,naturalantimicrobialsforfood preservation[J].InternationalJournal of Food Microbiology,2001,71:1-20.
[12]Schillinger U, Lücke F K. Antibacterial activity oflactobacillus sake isolated from meat[J].Applied and Envirinmental Microbiology,1989,55(8):1901-1906.
[13]Audisio M C,Torres M J,Sabaté D C,et al.Properties of different lactic acid bacteria isolated from Apis mellifera L.beegut[J].Mictobiological Research,2011,166(1):1-13.
[14]刘健,王海雁,赵淑江.牛津杯法测定五倍子对大黄鱼病原弧菌的体外抑菌活力[J].海洋科学,2009,33(11):44-47.
[15]Zeng W M,Wu C B,Zhang R B,et al.Isolation and identification ofmoderately thermophilic acidophilic ironoxidizing bacterium and its bioleaching characterization[J]. Transactions of Nonferrous Metals Society of China,2009,19(1):222-227.
[16]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:130-137.
[17]冯大伟,周家春.益生乳酸菌的纸片扩散法药敏性实验评价[J].微生物学通报,2010,37(3):454-464.
[18]Hladíková Z,Smetanková J,Greif G,et al.Antimicrobial activity of selected lactic acid cocci and production of organic acids[J].Acta Chimica Slovaca,2012,5(1):80-85.
[19]Martín-Platero A M,Valdivia E,Maqueda M,et al. Characterization and safety evaluation of enterococci isolated from Spanish goats’milk cheeses[J].International Journal of Food Microbiology,2009,132(1):24-32.
[20]Lindenstrauß A G,Pavlovic M,Bringmann A,et al. Comparison of genotypic and phenotypic cluster analyses of virulence determinants and possible role of CRISPR elements towards their incidence in Enterococcus faecalis and Enterococcus faecium[J].Systematic and Applied Microbiology,2011,34(8):553-560.
[21]Jamet E,Akary E,Poisson M A,et al.Prevalence and characterization of antibiotic resistant Enterococcus faecalis in French cheeses[J].Food Microbiology,2012,31(2):191-198.
Screening of lactic acid bacteria with inhibitory activity isolated from intestinal of cold water fish and analysis of its physiological property
REN Shi-ju1,WANG Jun-gang2,ZHOU Hong1,DENG Mei1,MA Yuan1,NI Yong-qing1,*
(1.College of Food,Shihezi University,Shihezi 832000,China;2.Agricultural Product Processing Research Institute,Xinjiang Academy of Agriculture,Shihezi 832000,China)
9 strains of lactic acid bacteria with inhibitory activity were screened from 24 lactic acid bacteria isolated from cold water fish intestinal by using oxford cup method.6 strains belonged to Lacterococcus genus and 3 strains belonged to Enterococcus genus by phylogenic analysis based on their partial 16S rDNA gene sequences.Cell-free fermenting supematants(CFSs)from 9 strains were performed to determine the inhibitory compounds and the proteninaceous nature of inhibitors.The result showed that CFSs of 9 lactic acid bacteria still exhibit different degree of inhibitory activity against Listeria monocytogenes after eliminating the effect of organic acid and hydrogen peroxide;the inhibitory activity of strains MHY3-2 and MD-2 were strongly dependent on the organic acid,whereas the influence of organic acid produced by strains MB2-1 and MD-1 on the inhibitory activity were negligible.CFSs of strains MB2-1 and MD-1 after eliminating organic acid and hydrogen peroxide show significant antibacterial activity against Listeria monocytogenes among 9 strains.The activity of all tested strains was lost by treating with pepsin and trysin but strains MB2-2 and MD-1 not sensitive to trypsin.The results demonstrated that the inhibitory compound was proteinaceous in nature and likely is bacterion-like or bacterion.In addition,antibiotic resistance of 9 strains of lactic acid bacteria was preliminarily tested.9 strains were sensitive to ampicillin,vancomycin,erythromycin,chloramphenicol,ciprofloxacin and norfloxacin.The safety aspects of strains with inhibitory activity studied could provid basis for exploitarion and application of lactic acid bacteria isolated from the intestine of cold water fish.
inhibitory activity;lactic acid bacteria;screening;physiological property
TS201.3
A
1002-0306(2014)14-0178-05
10.13386/j.issn1002-0306.2014.14.031
2013-10-28 *通讯联系人
任士菊(1987-),女,硕士研究生,研究方向:食品生物技术。
国家自然科学基金(31360001);新疆生产建设兵团博士资金专项(2011BB009);石河子大学自然科学重点学科(ZRKX20104001)。
