猪血浆蛋白对鲢鱼鱼糜品质的影响
2014-03-01夏文水姜启兴许艳顺许学勤江南大学食品学院江苏无锡214122
雷 雨,夏文水,姜启兴,许艳顺,许学勤(江南大学食品学院,江苏无锡214122)
猪血浆蛋白对鲢鱼鱼糜品质的影响
雷雨,夏文水,姜启兴,许艳顺,许学勤*
(江南大学食品学院,江苏无锡214122)
将猪血浆蛋白添加到鲢鱼鱼糜制品中,测定鱼糜制品凝胶强度、TPA、失水率和色泽的变化,并采用化学方法研究了添加猪血浆蛋白后鱼糜的化学作用力和溶解率的变化。结果表明,以1.5g/100g比例添加猪血浆蛋白时,鱼糜凝胶强度较空白样品提高了约2倍,高于添加等量的大豆分离蛋白的鱼糜制品凝胶强度,失水率降低至4.29%,白度稍微降低。溶解率及化学作用力分析显示猪血浆蛋白主要是通过非二硫共价键(尤其是ε-(γ-Glu)-Lys)、疏水键及氢键来促进鱼糜形成更致密、均匀的三维网状空间结构。
猪血浆蛋白,鱼糜,质构,溶解率,化学作用力
鲢鱼是我国目前养殖产量最大的一种淡水鱼,其最常用的加工产品是鱼糜制品[1]。鱼糜及其制品质量与其凝胶强度有很大关系。由于鲢鱼肌肉中的蛋白酶活性高于海水鱼的蛋白酶活性,因而其鱼糜制品的凝胶强度也远低于海水鱼糜制品的。因此,多年来,如何提高鲢鱼鱼糜品质,尤其是鱼糜的凝胶强度,一直成为关注焦点。例如,从鲑鱼的卵中提取蛋白酶抑制剂来改善鱼糜品质[2]。添加其他食品辅料如马铃薯淀粉等提高鱼糜凝胶强度[3]。为加大鲢鱼加工利用比例,寻找一种天然含有鲢鱼肌肉中蛋白水解酶抑制剂的蛋白是非常重要的。
猪血作为畜产品加工的副产物,其加工利用较少,具有资源丰富、价格低廉的优点。Benjakul等[4-5]研究表明猪血浆蛋白中IV-1片段能有效抑制黄笛鲷肌肉中蛋白酶,大幅度抑制肌肉自溶及肌球蛋白重链的降解,且I-S片段含有较高的谷氨酰胺转移酶活性催化肌球蛋白重链以非二硫共价键交联以形成致密的三维网状结构,从而大幅提高黄笛鲷鱼糜的凝胶强度及品质。钟禅等[6]从猪血中分离出能有效抑制鲢鱼浆中肌原纤维蛋白降解的激肽原Ⅰ和激肽原Ⅱ,且显著提高鲢鱼鱼糜的凝胶强度。猪血浆蛋白用来改善淡水鱼鱼糜品质的研究还鲜有报道。
为此,本文拟以鲢鱼为实验对象,研究猪血浆蛋白对鲢鱼鱼糜制品品质的影响,并与添加大豆分离蛋白后的鱼糜制品进行比较,同时对添加猪血浆蛋白的鱼糜中化学作用力及溶解率进行实验,以期为拓展猪血利用、提高鲢鱼鱼糜制品品质途径提供实验依据。
1 材料与方法
1.1材料与仪器
新鲜鲢鱼每条约2kg,购于无锡市雪浪菜市场;新鲜猪血无锡天棚食品有限公司屠宰部;氯化钠、柠檬酸钠、尿素、硫酸钾、硫酸铜、氢氧化钠、硼酸、甲基红、溴甲酚绿、SDS、巯基乙醇等化学试剂均为分析纯,上海化学试剂公司。
AB204-N精密电子天平、AB104-N电子分析天平Metter-Toledo Group公司;DGG-9240恒温水浴锅上海森信式实验仪器有限公司;TA-XT2i质构仪英国Stable Micro System公司;Model 4K15冷冻离心机德国Sigma公司;UV1000紫外可见分光光度计上海天美科学仪器有限公司;IKA均质机德国IKA公司;UltraScan Pro1166色差仪美国Hunterlab公司;西贝乐SQ2119DX多功能食品加工机上海帅佳电子科技有限公司。
1.2实验方法
1.2.1工艺流程鲢鱼鱼糜的制备工艺流程如下:
食盐、猪血浆蛋白↓
新鲜鲢鱼→预处理→手工采肉→漂洗→脱水→斩拌→灌入肠衣→加热→冷却→测定各项指标
1.2.2操作要点
1.2.2.1预处理将新鲜鲢鱼去头、去内脏、去鱼鳞,彻底除去鱼腔中内脏和黑膜。
1.2.2.2手工采肉由上述鱼段手工采下鱼肉。
1.2.2.3漂洗三次漂洗,前两次漂洗液为蒸馏水,最后一次漂洗液为0.3%(m/v)食盐溶液,漂洗时鱼肉与漂洗液的比例为1∶3(v/v)。
1.2.2.4脱水漂洗后的鱼肉在4℃,3000r/min,离心10min,鱼肉置于4℃冰箱中备用。
1.2.2.5斩拌鱼肉中空擂1min,添加2.5%的食盐斩拌1min,最后加入不同浓度的猪血浆蛋白斩拌1min。
1.2.2.6灌入肠衣将鱼浆灌入直径为25mm的聚偏二氯乙烯肠衣中。
1.2.2.7加热两段式加热法(40℃/30min,90℃/ 20min)。
1.2.2.8冷却加热结束后将鱼肠立即置于冰水中冷却,4℃冷藏过夜。
1.3实验设计
1.3.1凝胶强度的测定参照Benjakul等[5]方法,用质构仪测定样品的破断强度和凹陷深度,凝胶强度即为两者乘积。
1.3.2质地剖面分析(TPA)参照Habib-Allah等[7]方法,用质构仪测定样品的硬度、弹性、黏结性、胶黏性、咀嚼性、回复性等指标。
1.3.3失水率的测定参照Guangquan Xiong等[8]方法,将鱼肠切成3mm厚的薄片并称重(W1),下面放3张滤纸,上面放2张滤纸,用5kg的砝码压制并保持2min,去掉滤纸,再将样品称重(W2)。

1.3.4白度的测定白度是鱼糜感官品质的重要指标,其值与L*、a*、b*有关。L*值表示样品的亮度,a*表示样品的红绿值,+a*表示样品偏红,-a*表示样品偏绿,b*表示样品的黄蓝值,+b*表示样品偏黄,-b*表示样品偏蓝。参照Benjakul等[5]方法,将鱼肠切成5mm厚的圆柱体,用色差仪在室温下测定鱼肠的L*、a*、b*值,其白度按下式计算:

1.3.5鱼糜溶解率测定参照Benjakul等[9]方法。取适量鱼糜凝胶样品,加入Tris-HCl缓冲液均质,煮沸,搅拌,离心。上清液中添加50%(W/V)的TCA至终质量分数为10%,4℃放置,离心,沉淀物用10%TCA冲洗并溶解于0.5mol/L NaOH中。总蛋白含量为凝胶直接溶解于0.5mol/L NaOH中蛋白质含量。溶解率为溶解于溶剂中的蛋白质占总蛋白质含量的百分比。
1.3.6化学作用力的测定参照Guillén等[10]方法。取2g鱼糜凝胶样品,分别与10mL的0.05mol/L NaCl(SA)、0.6mol/L NaCl(SB)、0.6mol/L NaCl+1.5mol/L urea(SC)、0.6mol/L NaCl+8mol/L urea(SD)混合并均质、离心,用双缩脲法测定上清液中蛋白质含量。鱼糜凝胶中非特异性连接作用的贡献以溶解在SA溶液中的蛋白含量表示;离子键的贡献以溶解于SB与SA溶液中的蛋白含量差表示;氢键的贡献以溶解于SC与SB溶液中的蛋白含量差表示;疏水键的贡献以溶解于SD与SC溶液中的蛋白含量差表示。结果以每升溶液所含的溶出蛋白质量来表示(g/L)。
1.4数据处理
应用Origin 8.5软件及Excel软件进行数据分析。
2 结果与讨论
2.1猪血浆蛋白对鲢鱼鱼糜凝胶强度影响
凝胶强度是评价鱼糜品质优劣的重要指标之一。由图1可知,随着猪血浆蛋白含量的增大,鲢鱼鱼糜的凝胶强度呈现先增大后减小的趋势,且当猪血浆蛋白含量增大至1.5g/100g时达到最大值8620g·mm,较空白样品提高了约2倍。这种鱼糜凝胶强度随猪血浆蛋白添加增加出现峰值的现象,与Benjakul等利用猪血浆蛋白改变海生大眼鲷鱼糜的结果类似[11],也可认为猪血浆蛋白具有抑制鲢鱼鱼糜内源酶对肌原纤维蛋白重链的降解作用,也可认为,猪血浆蛋白似乎含有谷氨酰胺转移酶活性,从而可以催化肌球蛋白重链以非二硫共价键方式交联,形成致密的三维网状结构,从而提高鱼糜凝胶强度;当猪血浆蛋白添加量大于1.5g/100g后出现的凝胶强度逐渐减小现象,可能与猪血浆蛋白的添加降低了体系肌球蛋白比例有关,从而干涉到肌球蛋白分子间三维网状结构的形成[5]。因而,利用猪血浆蛋改善鲢鱼鱼糜凝胶强度,存在一个最适添加浓度,本实验中,此最适添加浓度为1.5g/100g。

图1 猪血浆蛋白对鱼糜凝胶强度的影响Fig.1 Effect of porcine plasma protein on gel strength of surimi
2.2猪血浆蛋白对鲢鱼鱼糜TPA的影响
TPA是评价鱼糜品质优劣的另一个重要手段。对图1与表1比较可见,猪血浆蛋白添加到鱼糜中后,鱼糜的硬度及咀嚼性与凝胶强度的变化趋势相同,均随猪血浆蛋白含量从0g/100g增加至1.5g/100g逐渐增大,此后随猪血浆蛋白含量从1.5g/100g增加至2.5g/100g而逐渐减小。表明当以1.5g/100g的猪血浆蛋白加入到鲢鱼鱼糜中后,鱼糜产生相同形变量所需咀嚼力变大,口感变好,质构被明显改善。但弹性、凝聚性、回复力、胶黏性等变化不大。所有鱼糜凝胶的弹性值介于0.96~0.98之间,接近于1,说明鱼糜凝胶在第一次压缩后能较好复原[7]。
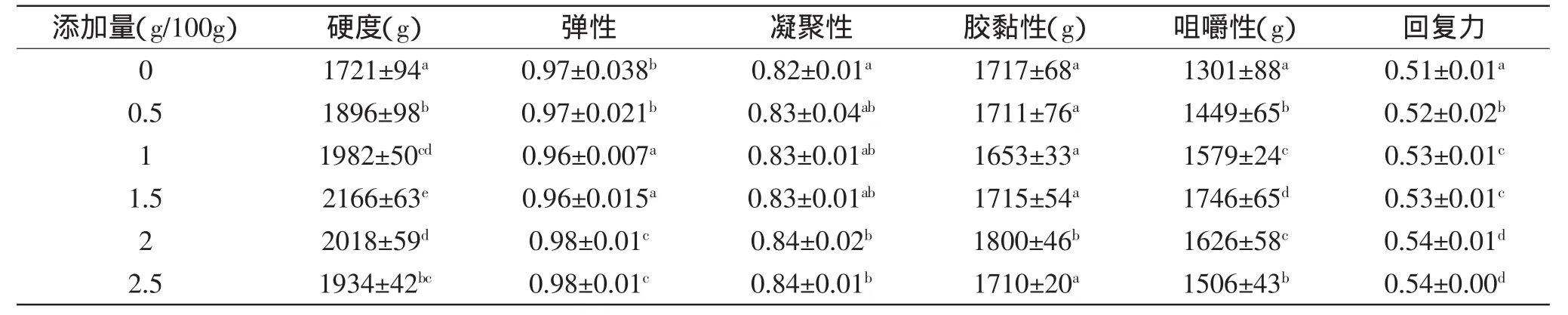
表1 猪血浆蛋白对鱼糜TPA的影响Table 1 Effect of porcine plasma protein on TPA of surimi
2.3猪血浆蛋白对鲢鱼鱼糜持水能力的影响
鱼糜的持水能力与其失水率呈负相关。图2所示为不同猪血浆蛋白添加浓度对鲢鱼鱼糜失水率的影响。由图2可知,随猪血浆蛋白浓度从0~2.5g/100g,鲢鱼鱼糜的失水率呈降低趋势,即猪血浆蛋白浓度高,鲢鱼鱼糜的持水性越好。空白鱼糜样品的失水率为5.69%,而添加猪血浆蛋白鱼糜的最小失水率为3.96%,可见猪血浆蛋白添加有助于提高鱼糜制品的持水性能。这种由加入猪血浆蛋白引起的鲢鱼鱼糜持水能力提高,可能与形成更致密的三维网状空间结构有关。

图2 猪血浆蛋白对鱼糜失水率的影响Fig.2 Effect of porcine plasma protein on the water loss rate of surimi
2.4猪血浆蛋白对鲢鱼鱼糜白度的影响
由表2知,猪血浆蛋白对亮度L*无显著变化;a*和b*均随猪血浆蛋白浓度从0g/100g增加至2.5g/100g逐渐增大,这与猪血浆蛋白的淡黄红色相一致。猪血浆蛋白浓度从0g/100g增加至2.5g/100g时,白度减小,这与Benjakul等[5]结果相一致,表明猪血浆蛋白的添加对鲢鱼鱼糜的白度有不利影响。但当添加最佳猪血浆蛋白浓度1.5g/100g时,其白度还是在消费者可以接受的范围之内(白度在75以上一般认为是可以接受的)。

表2 猪血浆蛋白对鱼糜色泽的影响Table 2 Effect of porcine plasma protein on the color parameters of surimi

图3 添加猪血浆蛋白和添加大豆分离蛋白的鱼糜品质比较Fig.3 Quality comparison of surimi made by addition of porcine plasma protein and soy protein isolate
2.5猪血浆蛋白和大豆分离蛋白对鲢鱼鱼糜品质影响的比较
为了验证猪血浆蛋白对鲢鱼肌肉内源性蛋白酶的抑制作用,并对猪血浆蛋白添加引起鱼鲢鱼糜感官品质变化进行评价,安排添加猪血浆蛋白及大豆分离蛋白的比较实验,两者在鲢鱼糜制品的添加量均为1.5g/100g,结果如图3所示。由图3可见,添加猪血浆蛋白的鲢鱼鱼糜凝胶强度最高,其次是添加大豆分离蛋白的鱼糜,对照样品的最低。如果认为大豆分离蛋白对鲢鱼鱼糜凝胶强度的改善仅是蛋白填充作用,则猪血浆蛋白改善鲢鱼鱼糜凝胶强度应该包含蛋白填充和抑制蛋白酶活性两个方面;另一方面,如果认为大豆分离蛋白添加引起的鱼糜凝胶强度高于对照的凝胶强度是由于其存在某种对鱼糜内源蛋白酶的抑制因素所引起,则认为猪血浆蛋白对鲢鱼鱼糜内源性蛋白酶的抑制能力比大豆分离蛋白的抵制能力更高。事实上,刘海梅[12]的研究表明大豆分离蛋白对鲢鱼肌肉内源蛋白酶有抑制性。因此,可以认为猪血浆蛋白大豆分离蛋白对鲢鱼肌肉内源性蛋白酶的抑制力更强。图3也表明添加猪血浆蛋白鱼糜白度高于添加大豆分离蛋白的鱼糜,但均低于对照样品,即猪血浆蛋白和大豆分离蛋白均降低鲢鱼鱼糜的白度。大豆分离蛋白的颜色较猪血浆蛋白更黄更深,可能因此使得添加大豆分离蛋白的鱼糜白度低于添加猪血浆蛋白的鱼糜。
2.6猪血浆蛋白对鲢鱼鱼糜溶解率的影响
含SDS、尿素和β-巯基乙醇的混合溶剂,能使鱼糜凝胶中除(主要以ε-(γ-Glu)-Lys代表的)非二硫共价以外的所有化学键断裂,由此混合试剂测得的鲢鱼糜溶解率高低,可以反应鱼糜凝胶中非二硫共价键的多少[5]。
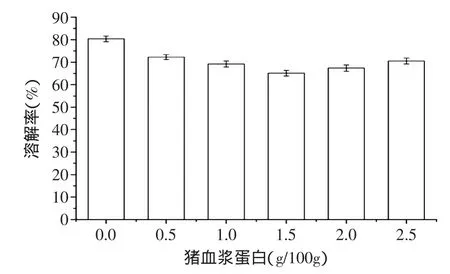
图4 猪血浆蛋白对鱼糜凝胶溶解性的影响Fig.4 The change of solubility of surimi with porcine plasma protein
由图4可看出,鱼糜凝胶的溶解率,随猪血浆蛋白浓度从0g/100g增加至1.5g/100g而逐渐减小,之后,糜凝胶的溶解率随着猪血浆蛋白浓度增大而逐渐增大。将图4与图1进行比较可见,鱼糜凝胶溶解率随猪血浆蛋白浓度而减小的趋势范围,与鱼糜凝胶强度随猪血浆浓度增大的趋势范围一致。这一现象与Benjakul等[9]结果一致,认为鱼糜溶解率随猪血浆蛋白浓度增加而减小,是鱼糜内源TG酶和猪血浆蛋白TG酶共同诱导形成非二硫共价键所致。本实验中,猪血浆蛋白添加量大于1.5g/100g后,鱼糜凝胶的溶解率反而增大,即形成的非二硫共价键反而减少,可能是由于猪血浆蛋白加入,对肌球蛋白-肌球蛋白交联产生干扰所致。虽然猪血浆蛋白浓度增加有利于抑制鲢鱼肌肉内源酶,但溶解率的增大意味着非二硫共价键的减少。因此,猪血浆蛋白对鲢鱼鱼糜内源性蛋白水解酶的抑制效应及对肌球蛋白交联干扰对双重效应,决定了猪血浆蛋白浓度对鲢鱼鱼糜凝胶强度的影响。另外,猪血浆蛋白浓度对鲢鱼鱼糜溶解率的影响与对凝胶强度的影响具有一致性,在添加的猪血浆蛋白浓度范围内,也存在一个与鱼糜溶解率最低相对应的猪血浆蛋白添加量,即1.5g/100g。
2.7猪血浆蛋白对鲢鱼鱼糜化学作用力的影响
蛋白凝胶是变性蛋白分子间有序聚集而形成的三维网状结构,是蛋白分子之间或蛋白分子与水分子之间排斥和吸引相互作用平衡的结果[13]。蛋白分子间相互作用力决定了凝胶的质构特性[14]。图5所示为与猪血浆蛋白浓度对鱼糜中维持鲢鱼鱼糜蛋白构象稳定的非特异结合、离子键、氢键和疏水键的影响。由图5可知,体系中的氢键和疏水键这两种化学力,分别随着猪血浆蛋白浓度从0g/100g增加至1.5g/100g而逐渐增大和减小,此后,两种化学作用力几乎不再受猪血浆蛋白浓度的影响;猪血浆蛋白浓度对非特异结合和离子键几乎没影响。由此可见,猪血浆蛋白添加使鲢鱼鱼糜凝胶强度改善,与体系氢键增加及疏水键降低有很大相关性,而与非特异结合和离子键无明显相关性,至于添加猪血浆蛋白后是否会增大二硫键贡献尚需进一步研究。Gómez-Guillén等[10]认为蛋白水解会形成新的疏水键,图5中当猪血浆蛋白浓度从0g/100g增加至1.5g/100g时,疏水键随着猪血浆蛋白添加浓度的升高而降低,可以间接说明猪血浆蛋白对蛋白酶具有抑制作用。
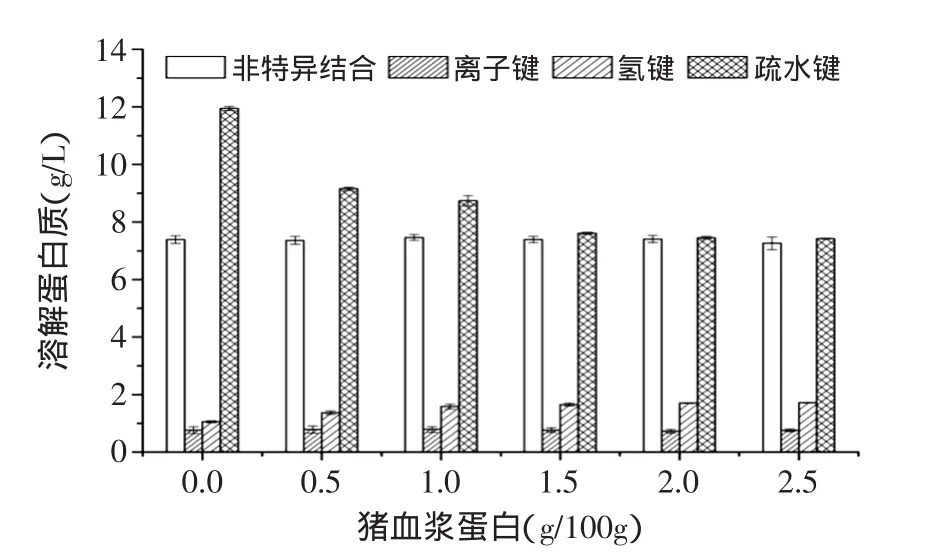
图5 猪血浆蛋白对鱼糜凝胶化学作用力影响Fig.5 Soluble protein of gels prepared with or without porcine plasma protein addition
3 结论
不同猪血浆蛋白添加对鲢鱼鱼糜制品品质影响实验的结果表明,添加适量猪血浆蛋白能有效改善鲢鱼鱼糜的凝胶强度、持水性、TPA,会使白度略有降低,但在可接受范围内。在猪血浆蛋白最佳添加量1.5g/100g条件下时,可提高鱼糜凝胶强度约2倍,高于添加等量大豆分离蛋白的鱼糜制品凝胶强度,间接证明猪血浆蛋白对鲢鱼肌肉的蛋白酶具有抑制作用。溶解率及化学作用力分析显示猪血浆蛋白主要是通过氢键、疏水键及非二硫共价键(尤其是ε-(γ-Glu)-Lys)来促进鱼糜形成更致密、均匀的三维网状空间结构。研究表明猪血浆蛋白可以有效改善淡水鱼鱼糜制品的品质,但通过冷冻干燥使其生产成本过高,不易用于工厂生产。对于如何制得生产成本低且能有效改善淡水鱼鱼糜制品品质的猪血浆蛋白还需要进一步研究。
[1]周国艳,郭堂鹏.鲢鱼鱼糜在储藏过程中新鲜度和盐溶性蛋白[J].食品科技,2008(8):240-243.
[2]李德昆.蛋白酶抑制剂的制备及其抑制狭鳕鱼糜凝胶劣化的研究[D].青岛:中国海洋大学,2008.
[3]刘欢,马兵,宋怿,等.几种食品辅料抑制鲢鱼组织蛋白酶B、L、H参与鱼糜凝胶软化的研究[J].食品科技,2010(11):150-154.
[4]Benjakul S,Visessanguan W,Srivilai C.Porcine plasma protein as proteinase in hibitor in bigeye snapper(Priacanthus tayenus)muscle and surimi[J].Journal of the Science of Food and Agriculture,2001,81:1039-1046.
[5]Benjakul S,Visessanguan W,Srivilai C.Porcine plasma protein as gel enhancer in bigeye snapper(Priacanthus tayenus)surimi [J].Journal of Food Biochemistry,2001,25:285-305.
[6]钟婵,江韬玲,翁武银,等.猪血激肽原的分离纯化及其对白鲢鱼鱼糜的凝胶作用[J].集美大学学报:自然科学版,2012(17):13-18.
[7]Habib-Allah H,Masoud R,Ali J.A Comparative study on effect of egg white,soy protein isolate and potato starch on functional properties of common carp(Cyprinus carpio)surimi gel[J].J Food Process Technol,2012,3:11-17.
[8]Xiong G Q,Cheng W.Effect of konjac glucomanan on physicochemical properties of myofibrillar protein and surimi gelsfromgrasscarp(Ctenopharyngodonidellus)[J].Food Chemistry,2009,116:413-418.
[9]Benjakul S,Visessanguan W,Chantarasuwan C.Effect of porcine plasma protein and setting on gel properties of surimi produced from fish caught in Thailand[J].Food Science and Technology,2004,37(2):177-185.
[10]Gómez-Guillén M C,Borderías A J,Montero P.Chemical interactions of nonmuscle proteins in the network of sardine(Sardinapilchardus)musclegels[J].FoodScienceand Technology,1997,30(6):602-608.
[11]Benjakul S,Visessanguan W,Srivilai C.Gel properties of bigeye snapper(priacanthus tayenus)surimi as affected by setting and porcine plasma proteins[J].Journal of Food Quality,2001,24(5):453-471.
[12]刘海梅.大豆分离蛋白对微生物转谷氨胺酶诱导鲢鱼糜凝胶形成的影响[J].食品科学,2009,30(5):76-78.
[13]董秋颖,杨玉玲,许婷.从质构学角度研究肌原纤维蛋白凝胶形成的作用力[J].食品与发酵工业,2009,35(5):45-49.
[14]Careche M,Alvarez C,Tejada M.Suwari and kamaboko sardine gels:Effect of heat treatment on solubility of networks[J]. Journal of Agricultural and Food Chemistry,1995,43(4):1002-1010.
Effect of porcine plasma protein on the quality of silver carp surimi
LEI Yu,XIA Wen-shui,JIANG Qi-xing,XU Yan-shun1,XU Xue-qin*
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Porcine plasma protein(PPP)was examined for its effects on the mechanical and water holding properties of heat-induced gels made from washed silver carp surimi.Different types of chemical bondings and solubility in gels were also studied by chemical technology.Results showed that an addition of 1.5%(w/w)PPP could make the gel strength of silver carp surimi almost two times more than those without PPP.It had a better gel strength than samples added with the same amount of soy protein isolate and the water loss rate decreased to 4.29%,but slightly decreased the whiteness.The solubility studies and chemical forces analysis indicated that nondisulfide covalent bond,particularly ε-(γ-glutamyl)lysine linkage,hydrophobic bond and hydrogen bonds which were significant increased in gels when added with PPP played an important role in forming a compact and homogeneous three-dimensional gel network.
porcine plasma protein;surimi;texture;solubility;chemical bonds
TS201.1
A
1002-0306(2014)14-0103-05
10.13386/j.issn1002-0306.2014.14.014
2013-09-12*通讯联系人
雷雨(1989-),女,硕士研究生,研究方向:食品加工技术。
现代农业产业技术体系建设专项资金资助(CARS-46-22)。
