原发性肝癌合并门静脉高压症病人行联合肝脾切除与单纯肝切除的回顾性研究
2014-02-27罗鸿萍王其张必翔
罗鸿萍 王其 张必翔
中国约有82%的原发性肝癌(hepatocellular carcinoma,HCC)病人合并有乙型肝炎病毒感染,其中约86%的病人合并有乙型病毒性肝炎(简称乙肝)肝硬化[1]。这部分病人常合并门静脉高压症,其处理十分棘手。因为担心肝储备功能差,这类病人一度被视为肝切除术的禁忌证[2]。研究发现脾切除有助于改善肝硬化病人的肝功能[3-4]。脾切除一度被视作扩大HCC合并门静脉高压症病人肝切除术适应证的一种手段[3,5-7]。这些探索使得这类病人不再是肝切除术的绝对禁忌证,但也导致了脾切除术的盛行。这可能使一部病人接受了不必要的脾切除术。目前,对于合并较严重门静脉高压症的HCC病人(血小板计数小于50×109/L或食管静脉曲张>F2),联合肝脾切除术(simultaneous splenectomy and hepatectomy,SPH)争议较小;但是对于合并较轻症门静脉高压症的HCC病人是否需要施行SPH则充满争议[3,5-7]。毕竟,相比单纯肝切除术(hepatectomy alone,HA)而言,SPH增大了手术风险。并且,脾切除对长期预后有何影响尚无定论。我们设计了一组回顾性病例对照研究,分析脾切除在HCC合并轻中度乙肝肝硬化性门静脉高压症病人(hepatitis B-related hepatocellular carcinoma and portal hypertension,HBV-HCC/PH)中的风险及益处,以探讨脾切除的必要性。
资料与方法
一、临床资料
本研究获得医院伦理委员会批准,不涉及病人隐私。选取本院肝脏外科2002年1月至2008年12月间病例资料库中的病人为研究对象。参考文献报道[3,5-7],我们将同时符合下述3个条件者定义为轻中度门静脉高压症:①术前血小板计数在(50~80)×109/L,②白细胞计数>2.0×109/L,③无食管静脉曲张或曲张程度≤F2(F0:无曲张;F1:轻度,直的曲张血管;F2:中度,迂曲的曲张血管)。因文献报道充满争议[3,5-7],我科将合并轻中度门静脉高压症的HBV-HCC/PH病人作为SPH相对适应证。即术前向病人阐述脾切除的风险及可能益处,接受HA还是SPH由病人决定。这样,在我们的资料库中,HA的病例远多于SPH病例,仅有57例病人接受SPH。按1∶2配对,且围手术期临床资料相匹配的原则,随机抽取114例HA病例。食管静脉曲张分级及术后肿瘤病理学TNM分期参见文献[8-9]。
二、方法
术前评估及手术方法参见文献[10]。对术后48~72 h内未无出血并发症的SPH组病人以低分子肝素进行预防性抗凝治疗。术前3个月以内HBV DNA≥1×103copies/ml的病人术后接受抗病毒治疗,药物及用法在感染科医师指导下进行。术后3年内每3个月左右随访一次。3年内无复发者改为每半年随访一次。本研究随访时间定为5年,生存期在5年以上病人远期失访率较高,未统计5年后生存情况。复发病人处理原则如下:肿瘤大于5 cm且可切除者再次手术切除;肿瘤直径小于3 cm,且数量小于3个,射频或微波治疗;其他情况,介入化疗。
三、统计学处理
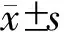
结 果
一、两组术前、术后临床病理资料比较
本研究共纳入171例病例,其中HA组114例,SPH组57例。详细术前资料见表1,结果显示SPH组除白细胞计数偏低外,其他临床资料与HA组差异无统计学意义。两组病例的术后病理学TNM分期、肿瘤分化程度(以Edmonson and Steiner分级法分级)及微血管侵犯情况差异无统计学意义,详见表2。
二、围手术期情况
两组病例在肝切除范围、出血量及术中输血率方面差异无统计学意义(表2)。SPH组手术时间长于HA组(表2)。
术后并发症依Clavien-Dindo[11]分类法分类,按严重程度从低至高分为7级,三级以上者为严重并发症。三级以上并发症分布如下:Grade 3a级:需要2次以上穿刺抽液的胸腔积液,HA组1例,SPH组2例;顽固性腹水,HA组2例,SPH组1例;SPH组需要穿刺引流的胆漏、伤口感染各1例。Grade 3b级:HA组腹腔内出血1例;SPH组需要二期缝合的伤口感染1例。Grade 4a级:肝肾综合征,HA组2例,SPH组1例;SPH组需要监护治疗的腹腔内大出血3例。Grade 4b级:HA组肺部感染并一过性肝性脑病1例;SPH组腹腔内脓肿合并一过性肝性脑病1例。Grade 5级:肝功能衰竭,HA组1例,SPH组2例。HA组心肌梗死1例。SPH组发生严重并发症的风险约为HA组的3.5倍[22.8%(13/57)比7.9%(9/114);比值比=3.45,95%可信限为1.37~8.65;P=0.006]。

表1 单纯肝切除与联合肝脾切除术前临床资料比较
注:a.肿瘤大小分级:Ⅰ级,肿瘤最大径≤5 cm;Ⅱ级,5 cm<肿瘤最大径≤10 cm;Ⅲ级,肿瘤最大径>10 cm

表2 围手术期两组资料比较
SPH组门静脉血栓(portal vein thrombosis,PVT)发生率为14.0%(8/57),HA组无,差异有统计学意义(P<0.001)。SPH组及HA组病人的围手术期死亡率分别为3.5%(2/57)及1.8%(2/114),差异无统计学意义(P=0.601)。值得注意的是,SPH组2例死亡病例均合并有PVT,术后合并PVT病人的围手术期死亡风险较未合并者高26.8倍[25.0%(2/8)比1.2%(2/161);比值比=26.8,95%可信限为3.2~224.1;P=0.011]。
脾切除对白细胞及血小板计数有显著的提升作用(图1A、B)。术后60 d时,SPH组病人的肝功能较术前显著好转,表现为凝血酶原时间缩短,总胆红素及终末期肝病模型(mayo end-stage liver disease,MELD)评分下降;而HA组术后肝功能略有恶化(图1C~F)。这提示脾切除对肝功能有改善作用。
三、长期预后
HA组术后5年无瘤生存率为26.3%,总体生存率为51.8%;SPH组5年无瘤生存率为35.1%,总体生存率为54.4%;两组病例在无瘤生存率及总生存率上差异无统计学意义(图2)。在术后2年内无瘤生存病例中,HA组及SPH组分别有47例及27例病人有完整的实验室检查随访资料。在2年的随访中,HA组的血小板计数、总胆红素、凝血酶原时间及白蛋白无显著变化;而SPH组的血小板计数维持在正常值水平,凝血酶原时间及白蛋白无显著变化,总胆红素在术后1年内低于术前水平(P<0.05),而在术后2年时则与术前水平差异无统计学意义(图3)。这提示脾切除有短期改善肝功能作用,但这种作用在长期时间内逐渐消退。

HA:单纯肝切除;SPH:联合肝脾切除图2 单纯肝切除或联合肝脾切除病人的Kaplan⁃Meier生存曲线
讨 论
肝移植无疑是HBV-HCC/PH患者的理想治疗方法[9],但受制于短缺的供体,以肝叶切除术为主的综合治疗还是目前绝大部分这类病人的主要治疗方案。并且,许多HBV-HCC/PH病人肝储备功能良好,可以耐受大范围肝叶切除术[12]。

图1 单纯肝切除或联合肝脾切除病人术前及术后60d检验指标变化。HA:单纯肝切除;SPH:联合肝脾切除。同组内与术前值相比∗P<0.05。柱形图上短线段,95%可信限

图3 单纯肝切除或联合肝脾切除病人术后2年内检验指标变化。HA:单纯肝切除;SPH:联合肝脾切除。在同组内与术前值相比∗P<0.05。95%CI:95%可信限
目前对于合并轻中度门静脉高压症的HCC病人是否应行SPH充满争议[5-7]。卫计委制定的HCC诊疗指南中对相应问题也无明确规定[13]。赞同脾切除的主要原因如下:①可改善肝功能;②能预防血小板进行性下降,可降低由此导致的出血风险[6-8]。但是,这些研究有如下共性缺点:①样本量较小;②缺乏对肝功能的长期随访;③未阐明脾切除能否改善长期预后;④缺乏相应的对照病例评估SPH相对于HA的风险。本研究结果显示,SPH组病例的肝功能仅在约1年内有改善,这与文献报道一致[3-4];在此后的2年内,由脾切除带来的肝功能改善作用则逐渐消退,这尚无文献报道。而HA组病例的肝功能则在2年随访期间内并无显著恶化。以上结果提示相对于HA组而言,SPH组病人并未获得长期肝功能改善的益处。同时,在本研究中SPH组严重并发症的风险约为HA组的3.5倍,这提示附加的脾切除术显著增加了手术风险。
本研究对部分无瘤生存期大于2年的病例随访结果表明,SPH组病人的血小板改善是持久性的;而HA组病人的血小板水平并无显著恶化,这提示通过脾切除来预防血小板水平恶化并无必要性。
虽然脾切除有降低门静脉压力的作用。但现在的肝硬化门静脉高压症诊疗指南中并不推荐用脾切除术来预防食管胃底曲张静脉出血;对于轻中度门静脉高压症病人,内镜联合药物治疗是目前首选预防方案。
研究报道脾切除存在独特的风险,如PVT及术后爆发性感染,这些并发症有时候是致命的[14-15]。本研究中SPH组病例PVT发生率为14.0%,与上述文献报道相近,无术后爆发性感染的发生。虽然由于死亡病例少,术后合并PVT病人的围手术期死亡风险升高约26.8倍这一统计数据存在因偶然事件造成误差的可能,不一定反映真实情况,但PVT导致的围手术期死亡风险可能增大。
现已阐明,抗病毒治疗对预防HCC复发有肯定作用[16-17]。目前的抗乙肝病毒药物对血细胞无明显影响,但是抗丙肝病毒药物则可能会导致严重的低白细胞血症及低血小板血症[16-17]。故从预防肿瘤复发的角度而言,合并丙型肝炎性门静脉高压症的HCC病人,可施行积极的脾切除术。
本研究中,SPH组及HA组病例的无瘤生存时间及总生存时间差异并无统计学意义,这提示脾切除对于长期生存无影响。
总之,本研究结果显示对于合并轻中度门静脉高压症的HBV-HCC/PH病人行附加脾切除术对长期肝功能、无瘤生存率及总生存率并无明显影响;相反,其导致手术风险显著增加。而在现代治疗条件下,这类病人肝硬化病程进展较慢,通过施行脾切除来预防血小板水平恶化及食管胃底曲张静脉出血并无必要。对于这类病人,应慎行脾切除术。
1 吴孟超,陈汉,沈锋.原发性肝癌的外科治疗——附5524例报告.中华外科杂志,2001,39:25-28.
2 Bruix J,Sherman M,Llovet JM,et al.EASL Panel of Experts on HCC.Clinical management of hepatocellular carcinoma.Conclusions of the Barcelona-2000 EASL conference.European Association for the Study of the Liver.J Hepatol,2001,35:421-430.
3 Shimada M,Hashizume M,Shirabe K,et al.A new surgical strategy for cirrhotic patients with hepatocellular carcinoma and hypersplenism: performing a hepatectomy after a laparoscopic splenectomy. Surg Endosc,2000,14:127-130.
4 Akahoshi T,Hashizume M,Tanoue K,et al.Role of the spleen in liver fibrosis in rats may be mediated by transforming growth factor beta-1. J Gastroenterol Hepatol,2002,17:59-65.
5 Sugawara Y,Yamamoto J,Shimada K,et al.Splenectomy in patients with hepatocellular carcinoma and hypersplenism.J Am Coll Surg,2000,190:446-450.
6 Wu CC,Cheng SB,Ho WM,et al.Extend the patient selection criteria. Appraisal of concomitant splenectomy in liver resection for hepatocellular carcinoma in cirrhotic patients with hypersplenic thrombocytopenia. Surgery,2004,136:660-668.
7 Kim SH,Kim do Y,Lim JH,et al. Role of splenectomy in patients with hepatocellular carcinoma and hypersplenism. ANZ J Surg,2013,83:865-870.
8 Hayashi H,Takamura H,Yamaguchi Y,et al. Recent role of Hassab's operation for cirrhotic patients: combination with endoscopic procedure for varices. Asian J Surg,2012,35:57-61.
9 Rahbari NN,Mehrabi A,Mollberg NM,et al. Hepatocellular carcinoma: current management and perspectives for the future. Ann Surg,2011,253:453-469.
10Chen XP,Qiu FZ.A simple technique ligating the corresponding inflow and outflow vessels during anatomical left hepatectomy. Langenbecks Arch Surg,2008,393:227-230.
11Wong JS,Wong GL,Chan AW,et al.Liver stiffness measurement by transient elastography as a predictor on posthepatectomy outcomes.Ann Surg,2013,257:922-928.
12Chen XP,Wu ZD,Huang ZY,et al. Use of hepatectomy and splenectomy to treat hepatocellular carcinoma with cirrhotic hypersplenism. Br J Surg,2005,92:334-339.
13高杰, 朱继业. 卫生部《原发性肝癌诊疗规范(2011年版)》解读. 中华普通外科杂志,2012,8:693-695.
14Kawanaka H,Akahoshi T, Kinjo N, et al. Impact of antithrombin III concentrates on portal vein thrombosis after splenectomy in patients with liver cirrhosis and hypersplenism. Ann Surg,2010,251:76-83.
15Hanazaki K, Kajikawa S,Adachi W,et al.Portal vein thrombosis may be a fatal complication after synchronous splenectomy in patients with hepatocellular carcinoma and hypersplenism. J Am Coll Surg,2000,191:341-342.
16Yin J,Li N,Han Y, et al.Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis B virus-related hepatocellular carcinoma: a two-stage longitudinal clinical study. J Clin Oncol,2013,31:3647-3655.
17Kubo S,Takemura S,Sakata C,et al.Adjuvant Therapy after Curative Resection for Hepatocellular Carcinoma Associated with Hepatitis Virus. Liver Cancer,2013,2:40-46.
