局部进展期直肠癌新辅助治疗后临床完全有效的回顾性分析
2014-02-27李桉树刘兴华杨溢铭陶凯雄王国斌
李桉树 刘兴华 杨溢铭 陶凯雄 王国斌
多学科综合治疗方式使得T1N1~T2N1期直肠癌患者5年总生存率提高至85.1%[1]。有报道称,部分局部进展期直肠癌患者行新辅助治疗后可使肿瘤分期不同程度地降低,部分患者可获得临床完全有效(clinically Complete Response,cCR),少部分患者甚至达到病理学完全消失(pathologic Complete Response,pCR),对改善患者预后有重要作用[2]。虽然,局部进展期直肠癌的新辅助治疗加直肠全直肠系膜切除(TME)的综合治疗模式,已逐渐成为“标准化”治疗方案[3-4],但仍有学者提出pCR或者部分cCR直肠癌患者只需要采取保守治疗方案[5-8],本文将结合我院37例临床资料,旨在为局部进展期直肠癌的治疗提供临床依据。
资料与方法
一、临床资料
1.一般资料 本组37例,其中男性24例,女性13例;年龄34~62岁,平均(55.0±6.3)岁,直肠术前病理证实癌变。多数患者因腹泻与便秘交替出现就诊31例(83.8%),同时合并有大便带血24例(64.9%),乏力23例(62.2%),肛门坠胀18例(48.6%),腹胀17例(45.9%),体重减轻11例(29.7%),不全性肠梗阻2例(5.4%)。入组患者均不合并有其他恶性肿瘤病史及控制不良高血压、心脏病、糖尿病和严重肺部疾病者等不适合行新辅助治疗的疾病。
2.辅助检查 患者均常规进行直肠镜检,且病理学检查证实癌变。入院后行全胸正位片、腹部及盆腔增强CT或MRI、直肠腔内超声内镜检查。影像学检查提示肿瘤体积小于5 cm×4 cm×2 cm,且未广泛浸润周围组织。
3.cTNM分期、分级 根据cTNM按AJCC第七版入组患者直肠癌分期见表1。
二、新辅助治疗方案
使用西门子M6740直线加速器,采用盆腔前、后对穿照射和等中心剂量,单日剂量2 Gy,每周5次,总剂量>24 Gy、小于<50 Gy。同期使用mFolFox6型或XeLox化疗2~4个周期。治疗方案包括以下2种:
1.患者自愿完成mFolFox6方案(6例)2~4个周期或XeLox方案(8例)2~4个周期,不选择行手术治疗。4~6周后进行盆腔CT或MRI、电子肠镜、腔内超声内镜及血液肿瘤标记物检查。(A组,14例,37.8%)
2.患者术前完成mFolFox6方案(9例)4周期或Xelox方案(14例)2~4个周期后休息6~8周行标准腹腔镜辅助下TME。(B组,23例,62.2%)
三、治疗后疗效评价
患者新辅助治疗后进行CT或MRI检查提示直肠及周围无明显占位,电子结肠镜检无明显占位情况,并进行既往占位部位局部组织活检排除癌变组织达到cCR要求;pCR患者术后组织病理学处理,按Dworak肿瘤消退分级(tumor regression grading,TRG)[9]为RG4级。观察两组患者2年无瘤生存率(disease free survival,DFS)、2年局部复发率(local recurrence,LR)、2年无远处转移生存率(metastasis free survival,MFS)。
四、随访方式
参考2010年NCCN结直肠癌指南随访方式,诊疗结束后第3、9、15、21个月进行随访,随访内容包括血液肿瘤标记物检查、生活质量的询问;在诊疗结束后第6、12、18、24个月进行随访,随访内容包括血液肿瘤标记物检查、直肠指诊、电子结肠镜、盆腔CT或MRI及胸部CT(如患者经济困难,可考虑胸片、B超检查)。
五、统计学方法
结 果
一、新辅助治疗后短期临床症状缓解情况
25例患者在新辅助治疗开始2周期后临床症状明显缓解,12例患者临床症状无明显缓解,其中2例患者临床症状加重,主要以肛门坠胀、血便为主要表现。25例症状明显缓解患者进行上述治疗后21例患者达到研究设计的cCR;16例患者新辅助治疗4周期后,通过复查评价后达到cCR。新辅助治疗结束后6周,入组患者再次进行疗效评估中复查,均为临床症状完全缓解。
二、生存情况
37例患者随访满2年均生存,无死亡病例,总局部复发率16.2%(6/37),无远处转移者占94.6%(35/37)。
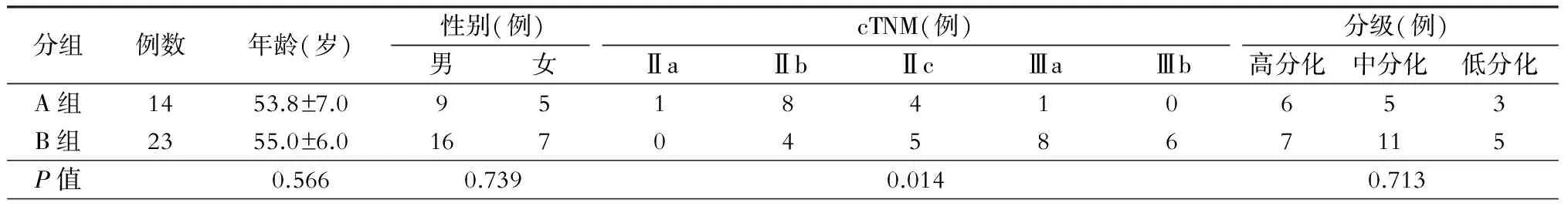
表1 入组患者首次入院一般资料情况
A组共计14例,其中1例47岁体质量指数(BMI)为31.7 kg/m2,男性,cTNM分期Ⅲa期(T2N1M0,低分化腺癌),第12个月随访发现局部复发伴肝脏多发转移,转肿瘤科行FolFiri治疗,随访第24个月带瘤生存。1例,52岁(BMI为27.4 kg/m2),女性Ⅱc期(T4bN0M0,印戒细胞癌)患者在治疗结束后第15个月因食欲减退伴乏力再次入院就诊出现局部复发伴肝脏单发转移,行经腹盆腔肿块切除加双侧附件切除加肝脏转移瘤射频消融术,术后转肿瘤科进行FolFiri化疗,第18和24个月随访无瘤生存。3例分别为Ⅱb期(女,54岁,T4aN0M0,低分化腺癌,BMI22.0 kg/m2)、Ⅱb期(男,54岁,T4aN0M0,中分化腺癌,BMI26.8 kg/m2)ⅡC期(男,60岁,T4bN0M0,中分化腺癌,BMI29.1 kg/m2)于治疗结束后第18、24、15个月出现局部复发情况,行经腹盆腔肿块切除术,术后给予Xelox方案辅助治疗6次,第24个月随访无病生存。
B组腹腔镜下TME术组23例,术后pCR 65.2%(15/23),2年随访,其中1例患者在随访第24个月局部复发(女,54岁,cTNM分期Ⅲb期T2N2bM0,低分化腺癌,BMI23.9 kg/m2),行腹腔镜下腹会阴联合切除术,术后给予Xelox方案辅助治疗6次。T1-2直肠癌患者具有81.8%(9/11)的cCR和pCR符合率。T1-4N1-2a期患者淋巴结阳性率为35.7%(5/14)。(表2)

表2 入组患者诊疗后情况[例(%)]
讨 论
目前规范化的TME手术是全球主要治疗直肠癌的方法。局部复发和转移是影响直肠癌患者术后生存的主要因素,直肠癌患者治疗后约80%复发在2年内,仅2%~5%的复发发生于5年以后[10]。自2006年NCCN直肠癌指南推荐“术前同期放化疗加手术加术后辅助治疗”作为局部晚期期直肠癌(T3-4或N+)的治疗方案以来,为了减少局部复发,提高生存率以及提高低位直肠癌的保肛率[11],对于局部进展期直肠癌,手术治疗结合多学科的辅助治疗已经逐渐取代了单一手术治疗[12-13]。伴随放化疗技术的发展与成熟,直肠癌新辅助治疗在往后的治疗过程中将扮演越来越重要的角色,通过治疗获得cCR患者的比率还会不断提高。如何理性地面对获得cCR患者以及选择合适的治疗方式,是目前治疗直肠癌需要解决的主要问题。
自2010年5月开展新辅助治疗以来,笔者所在单位科室临床诊疗过程中观察到部分局部进展期直肠癌敏感患者行新辅助治疗后,可使肿瘤分期不同程度的降低。11.7%(79/674,其中42例患者诊疗后失访未入组)的患者在新辅助治疗后4~6周,通过盆腔MRI或增强CT和直肠腔内超声加活检可获得cCR。但值得注意的是,此次B组65.2%的cCR患者术后切除标本病理检查才能达到pCR。术后切除组织标本证实为pCR患者中,仍有半数以上病理报告提示有直肠组织重度不典型增生、直肠溃疡性变、直肠及周围组织纤维增生等情况出现。因此,这种差异提示着局部进展期直肠癌新辅助治疗患者虽然获得了cCR,但仍有部分患者体内存在着肿瘤细胞。通过国外学者临床研究发现[14],此差异与淋巴结转移瘤对放化疗敏感性较原发灶低有关,T2-3期原发病灶完全缓解的病案中淋巴结阳性率一般在15%~25%。我们的B组研究资料显示:T1-4N1-2a期患者淋巴结阳性率为35.7%(5/14)。因此,有理由推断原发病灶和转移性淋巴结对放化疗敏感不一致,以及A组无法确定cCR患者为真正的pCR,是cCR患者复发和转移的主要原因。
针对直肠癌cCR患者如何准确预测cCR是否为pCR及外科手术干预与否,是直肠癌诊疗过程中最具争议的议题。Habr-Gama等[15]研究发现:新辅助治疗后获得cCR的直肠癌患者与实行了标准TME手术患者对照分析,发现总生存率(overall surviral,OS)与LR无统计学意义,cCR患者长期随访即使复发也可以采用补救治疗而不影响患者总生存期。伴随着研究的开展,笔者所在单位研究组发现cCR患者手术组与非手术组的LR具有统计学意义(P=0.040),但由于本组研究样本量较少且为回顾性研究,因此LR结果可能存在一定的偏倚,需要后期展开多中心及大样本量调查研究。值得注意的是,术前T4a-b、T3及组织高恶性分化的cCR者,出现的LR呈弥漫浸润型生长,因此针对此类患者的治疗应当谨慎。而入组的高分化腺癌患者2年LR率、MSF率及DFS为0,究竟该类患者只需采取保守治疗?同样需要大样本量调查才能得知。通过B组患者的数据显示,T1-2直肠癌患者具有较高的cCR和pCR符合率(81.8%,9/11)。
在前期研究中,笔者所在研究小组预测cCR是否达到pCR,目前主要依靠MRI加腔内超声内镜加组织取样活检或PET-CT。根据国外研究学者结果提示[16-18]:目前常规MRI预测新辅助治疗cCR是否为pCR的表现是不一致的,需要重新定义无肿瘤细胞残留的MRI表现;18F标记的氟化脱氧葡萄糖(18F-FDG-PET)可反映直肠癌放化疗后的组织病理学反应,新辅助治疗后12周其准确性达到85%,敏感性达到93%。因此,近2年的研究中针对经济条件较好的患者已经采取此类影像学诊断方式筛查。同时,研究方案中添加靶基因的检验(如:Kras、Braf),以便往后的研究目的基因突变与直肠癌综合治疗后预后的相关性。
传统意义上肿瘤疾病的根治离不开外科手术的干预。根据笔者单位研究组研究结果显示:目前手术干预与否,应从cT分期、肿瘤恶性程度、影像学诊断依据和患者年龄四个方面来综合考虑。目前研究组暂订患者满足以下因素之一,建议cCR患者行TME手术:①cT3-4直肠癌;②组织恶性程度较高,如低/未分化腺癌等;③有家族史或家族性多发结肠息肉;④新辅助治疗后影像学检查如MRI或PET-CT提示有可疑;⑤年轻(<50岁)及肥胖患者。
1 Gunderson LL,Jessup JM,Sargent DJ,et al.Revised tumor and node categorization for rectal cancer based on surveillance, epidemiology, and end results and rectal pooled analysis putconmes.J Clin Oncol,2010,28:256-263.
2 Glynne Jones R,Wallace M,Livingstone JI,et al.Complete clinical response after preoperative chemoradiation in rectal cancer: is a "wait and see" policy justified? Dis Colon Rectum,2008,51:10-9; discussion 19-20.
3 Sauer R,Becker H,Hohenberger W,et al.Preoperative versus postoperative chemoradiotherapy for rectal cancer.N Engl J Med, 2004,351:1731-1740.
4 Sauer R,Liersch T,Merkel S,et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol,2012,30:1926-1933.
5 Sipa F,Chessin DB,Shia J,et al.A pathologic complete response of rectal cancer to preoperative combined-modality therapy results in improved oncological outcome compared with those who achieve no downstaging on the basis of preoperative endorectal ultrasonography. Ann Surg Oncol,2006,13:1047-1053.
6 Mass M,Nelemans PJ,Valentini V,et al.Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer:a pooled analysis of individual patient data.Lancet Oncol,2010,11:835-844.
7 de Campos-Lobato LF,Stocehi L,da Luz Moreira A,et al.Pathologic complete responseafter neoadjuvant treatment for rectal cancer decreases distant recurrence and could eradicatelocal recurrence. Ann Surg Oncol,2011,18:1590-1598.
8 Martin ST,Heneghan HM,Winter DC.Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer.Br J Surg,2012, 99:918-928.
9 Rödel C,Martus P,Papadoupolos T,et al. Prognostic significance of tumor regression after preoprative chemoradiotherapy for rectal cancer.J Clin Oncol,2005,23:8688-8696.
10汪建平.不断提高结直肠癌复发与转移的外科治疗水平.中华普通外科手术学杂志(电子版),2010,4:1-3.
11Roh MS,Colangelo LH,O'Connell MJ,et al.Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum:NSABP R-03.J Clin Oncol,2009, 27:5124-5130.
12Center MM,Jemal A,Smith RA,et al.Worldwide variations in colonrectal cancer. CA Cancer J Clin,2009,59:366-378.
13Van-Gossum A,Navas MM,Fernandez U,et al.Capsule endoscopyversus colonoscopy for the detection of polyps and cancer. N-Engl-J-Med,2009,361:264-270.
14Bonnen M,Crane C,Vauthey JN,et al.Long-term results using local excision after preoperative chemoradiation among selected T3 rectal cancer patients. Int J Radiat Oncol Biol Phys,2004,60:1098-1105.
15Habr-Gama,Perez RO,Nadalin W,et al.Long-term results of preoperative chemoradiation for distal rectal cancer correlation between final stage and Survival.J Gastrointest Surg,2005,9:90-101.
16Franklin JM,Anderson EM,Gleeson FV.MRI features of the complete histopathological response of locally advanced rectalcancer to neoadjuvant chemoradiotherapy.Clin Radiol,2012,67:546-552.
17deGeus-Oei LF,Vriens D,van Laarhoven HW,et al.Monitoringandpredicting responsetotherapywith 18F-FDG PET in colorectal cancer: a systematic review. J Nucl Med,2009,50 Suppl 1:43S-54S.
18Perez RO,Habr-Gama A,Gama-Rodrigues J,et al.Accuracy ofpositron emission tomography/computed tomography andclinical assessment in the detection ofcompleterectal tumor regression after neoadjuvant chemoradiation: Long-term results of a prospective trial(National Clinical Trial 00254683).Cancer,2012,118: 3501- 3511.
