原发性肝癌合并脾功能亢进外科治疗的Meta分析
2014-02-27沈艺南杨田张汉魏勇鹏王舟翀施洋卢军华杨广顺吴孟超
沈艺南 杨田 张汉 魏勇鹏 王舟翀 施洋 卢军华 杨广顺 吴孟超
原发性肝癌(主要是指肝细胞癌)作为我国最常见的恶性肿瘤之一,其发病率仅次于肺癌,居第二位。具有慢性肝病背景的肝癌患者往往由于合并肝硬化,因此同时伴有门静脉高压症,后者以脾功能亢进和食管、胃底静脉曲张为主要表现[1]。有研究显示,约85%~90%的肝癌患者伴有不同程度的肝硬化,其中约30%合并有脾功能亢进[2-3]。以前认为,肝癌合并肝硬化与脾功能亢进是手术禁忌,因为有可能会引起诸如上消化道出血、肝功能衰竭等严重并发症,甚至危及生命[4]。因此临床上多数是采用非手术治疗,但效果往往会很差;另外由于术后脾功能亢进的持续存在,少数只做肝切除治疗的患者预后并不理想[2]。然而,近十余年来,由于肝脏外科手术水平以及围手术期管理水平的提高,许多外科医生在肝脏肿瘤切除时,同期切除脾脏以治疗肝癌合并脾功能亢进。尽管一些发表的回顾性研究认为该术式可能具有比较好的临床效果[5-7],但由于是回顾性研究,且大多数研究的样本量有限,因此对于肝脾联合切除的疗效还不能充分地进行论证和评价。为此,我们认为有必要通过一项Meta分析对已有的研究结果进行系统定量的综合分析,从而为肝癌合并脾功能亢进的外科治疗提供更加科学的参考依据。
资料与方法
一、纳入与排除标准
1.纳入标准 ①原始资料为已公开发表的文献;②原始文献为设计良好的随机对照研究(randomized controlled trials,RCT)或高质量的非随机对照研究(non-randomized comparative studies,NRCs);③研究对象的肝癌诊断明确(包括术前影像学检查、肝炎指标、血清甲胎蛋白、术后病理提示为肝细胞癌)的患者;④符合脾切除指征[8]:[a.食管胃底静脉曲张:(i)内窥镜无效的难治性食管胃底静脉曲张,(ii)BRTO无效的胃底静脉曲张;b.门静脉高压及脾肿大所致的顽固性腹水;c.脾功能亢进:(i)血小板减少所致的出血倾向,(ii)干扰素治疗丙型肝炎所致的全血细胞减少,(iii)肝癌化疗所致的全血细胞减少;d.活体肝移植中受者体型偏小];⑤干预措施为肝癌联合脾脏同期切除,对照组行单纯肝癌切除;⑥术前未进行其他肝癌治疗手段(包括TACE、PMCT、化疗等);⑦文献语种限英文和中文。
2.排除标准 ①原始文献内容不是比较肝癌合并肝硬化与脾功能亢进行肝脾同期联合切除与单纯肝癌切除对预后的影响;②非开腹手术如腹腔镜;③肝癌与脾脏非同期切除;④重复发表、信息量少、质量差的文献;⑤可能存在其他可影响预后的治疗因素。
二、检索策略
1.所用资料来源 以(hepatectomy) OR (splenectomy) AND (hepatocellular carcinoma) AND (hypersplenism)检索PubMed(1960年1月至2014年1月)、Embase(1984年1月至2014年1月)、Cochrane Library(1991年1月至2014年1月),以(肝切除术) OR (脾切除术) AND (肝细胞癌) AND (脾功能亢进)检索中国期刊全文数据库(1994年1月至2014年1月)、中国生物医学文献数据库(1978年1月至2014年1月)、数字化期刊全文数据库(1997年1月至2014年1月)以及中文科技期刊全文数据库(1989年1月至2014年1月)。在主题检索前,先搜集检索词的同义词,以提高同义词查全率的方式提高目标文献的检出率。
2.二次扩大检索 根据以上检索所得文献的参考文献进行扩大检索以避免遗漏,从而提高符合条件文献的检出率。
三、质量评价和资料提取
1.质量评价 研究质量的评价(assessment of quality)是评估单个研究在设计、实施和分析过程中,防止或减少偏倚或系统误差的情况。对入选研究使用改良Sackett’s分级法进行质量评价。
2.资料提取 按照事先制定好的纳入和排除标准筛选文献,通过阅读文献题目和摘要,排除明显不符合纳入标准的文献。阅读可能符合纳入标准的文献全文,以确定其是否符合纳入标准。按预先设计的表格提取数据,提取资料包括:①一般资料:题目、作者、发表日期、文献来源等;②研究特征:病例数、性别比、平均年龄、Child分级、肿瘤大小、手术方式;③结局指标:围手术期病死率、术后并发症、术后白细胞计数(×109/L)、术后血小板计数(×109/L)、术后5年生存率。缺乏的资料尽量与作者联系予以补充。
四、统计分析方法
采用Cochrane协作网提供的RevMan5.2.7统计软件进行Meta分析。首先对多个研究结果进行异质性检验(tests for heterogeneity),若多个同类研究具有同质性(P>0.10,I2<50%),则使用固定效应模型(fixed effect model)计算合并统计量。若多个同类研究具有异质性(P<0.10,I2>50%),则分析可能导致其发生的原因,然后对这些原因引起的异质性采用亚组分析(subgroup analysis)。若经过这些方法分析和处理后,仍然存在异质性,则使用随机效应模型(random effect model)。二分类变量采用比值比(odds ratio,OR)为疗效分析统计量;数值变量采用均数差(mean difference,MD)或标准化均数差(standardized mean difference,SMD)。各效应量均以95%可信区间(confidence interval,CI)表示。使用漏斗图观察Meta分析结果是否存在偏倚,如发表偏倚或者其他偏倚。对Meta分析结果进行敏感性分析(sensitivity analysis)以观察其是否稳定和可靠。
结 果
一、文献检索结果
初检47篇原始文献,通过阅读题目与摘要,根据纳入和排除标准排除文献32篇,其中重复发表2篇、动物研究1篇、非开腹手术9篇、不符合纳入标准研究20篇,剩余15篇。进一步阅读全文后排除文献7篇,包括无对照研究4篇、肝癌切除与脾脏切除非同期进行2篇、结局指标不完善1篇。最终纳入8篇文献(表1),共772例患者,其中353例行肝脾联合切除术,单纯行肝癌切除术的有419例。
二、纳入文献的一般情况和质量评价
纳入的8个研究中,切脾组与未切脾组中患者的性别、年龄、术前肝功能Child-Pugh分级、肿瘤大小等方面,差异无统计学意义(表2)。入选文献均为NRCs文献,对其进行异质性检验后发现术后血小板计数具有异质性(P<0.05),使用随机效应模型进行合并计算。其余各观察指标均无显著异质性,使用固定效应模型进行合并计算。各漏斗图显示图形并不完全对称,提示可能存在一定的发表偏倚。
三、Meta分析结果
1.围手术期病死率比较 4项研究[3-4,10,13]报道了围手术期病死率,根据Meta分析结果可认为这4项研究具有同质性(异质性检验χ2=2.29,P=0.51,I2=0%),因此,合并效应量OR采用固定效应模型,OR合并=1.04,95%CI=0.3~3.58,P=0.96,无统计学意义,即肝脾联合切除较单纯肝切除术对改善围手术期病死率无明显效果(图1)。
2.术后并发症比较 8项研究[2-4,9-13]均报道了术后并发症,排除一项数据变异较大的韩国研究[13]。根据Meta分析结果,认为剩余7项研究具有同质性(异质性检验χ2=4.97,P=0.55,I2=0%),因此,合并效应量OR采用固定效应模型,OR合并=0.90,95%CI=0.63~1.29,P=0.56,无统计学意义,即肝脾联合切除较单纯肝切除术对改善术后并发症无明显效果(图2)。
3.术后白细胞计数及血小板计数比较 分别有2项研究[2,9]和3项研究[2,4,9]报道了术后白细胞计数及血小板计数。根据Meta分析结果,前者具有同质性(异质性检验P=0.63)故采用固定效应模型,而后者具有异质性(异质性检验P<0.05),采用随机效应模型。95%CI分别为5.13~5.82、116.61~233.18,均有统计学意义。故认为肝脾联合切除较单纯肝切除术可显著提高术后白细胞及血小板计数(表3)。

表1 文献检索结果

表2 纳入文献的一般情况

表3 术后白细胞计数及血小板计数比较

图1 围手术期病死率比较
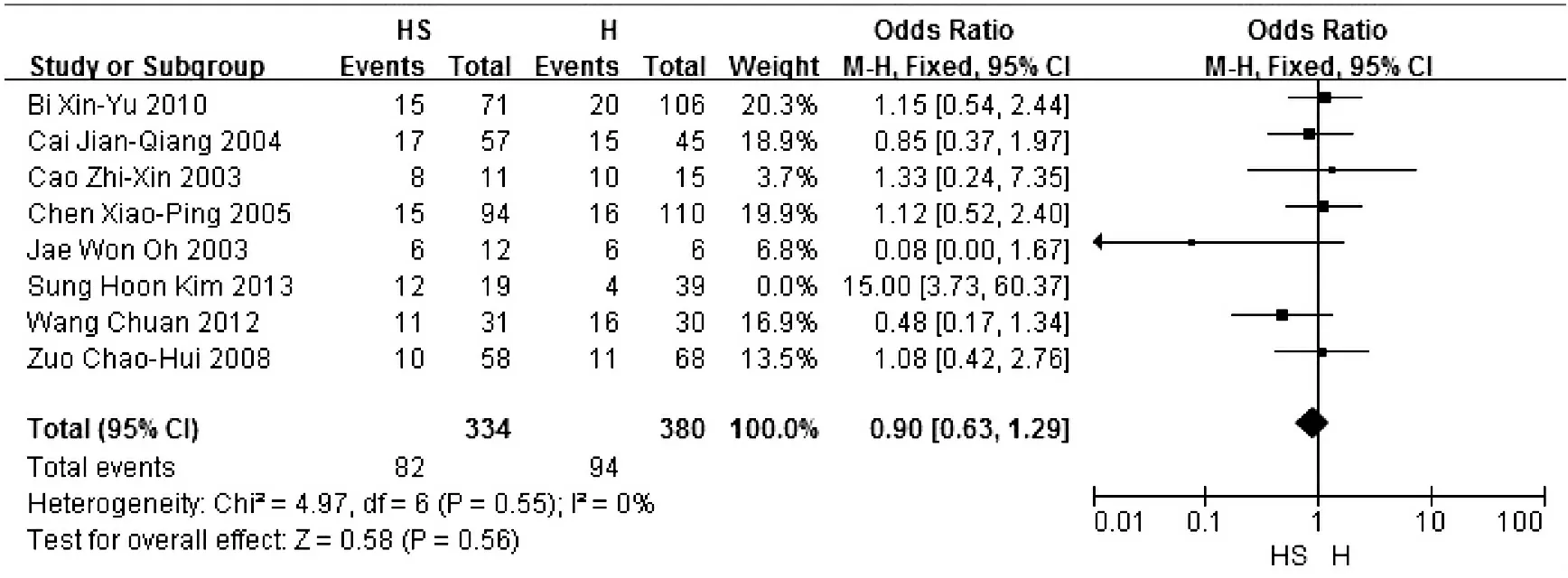
图2 术后并发症比较
4.术后5年生存率比较 3项研究[2-3,13]报道了术后并发症,根据Meta分析结果,认为这7项研究具有同质性(异质性检验χ2=1.92,P=0.38,I2=0%),因此,合并效应量OR采用固定效应模型,OR合并=1.53,95%CI=0.99~2.36,P=0.05,故无统计学意义,即肝脾联合切除较单纯肝切除术对术后5年生存率方面无明显差异(图3)。
四、敏感性分析

图3 术后5年生存率比较
对以上各Meta分析结果做敏感性分析,排除质量较差的文献、数据变异较大的文献[4,9]以及样本量较小的文献[13]后,各观察指标未发生移转且变化较小,可认为Meta分析结果较为可靠。
讨 论
肝移植被认为是治疗HCC的一种理想的治疗方式。然而,由于供体的匮乏、医疗费用昂贵以及技术复杂等原因,肝癌切除术在许多国家仍然是最主要的治疗手段[14]。门静脉高压是慢性肝脏疾病严重的并发症之一。在过去,肝癌伴门静脉高压被视为肝癌切除术的禁忌证,认为其可能加大了患者在术后发生肝功能衰竭的概率[15]。如今,已有研究证明,伴随门静脉高压的患者行肝癌切除术后是可以有比较好的预后的,因此,目前认为门静脉高压并非肝癌切除的绝对禁忌证[16-18]。
有学者认为,与传统肝癌切除术相比,肝脾联合切除术用于治疗肝癌合并肝硬化与脾功能亢进,其术后并发症及手术死亡率并未有显著提升[2,19-20]。而在动物模型中,脾切除显著改善了肝硬化病情[21],同时减轻了肝脏的损伤并促进了肝切除后肝细胞的再生[22]。此外,脾切除可不同程度地降低门静脉压力,对预防和减少食管胃底静脉曲张破裂出血有一定的作用[2]。
Meta分析的结果证实了上述部分研究。首先在围手术期病死率方面,分析结果差异无统计学意义(OR合并=1.04,95%CI=0.3~3.58,P=0.96),可见,肝脾联合切除术并未显著提高手术的风险性。同样在并发症方面,分析结果显示差异无统计学意义(OR合并=0.90,95%CI=0.63~1.29,P=0.56),故肝脾联合切除术并不一定提高了患者术后并发症发生的概率。术后白细胞计数及血小板计数存在统计学意义,提示两者在术后发生了显著的提升。而化疗在肝癌的治疗中占有极其重要的地位,术后患者白细胞计数及血小板计数的回升有利于化疗的实施[2]。令人遗憾的是,肝脾联合切除术与单纯肝癌切除术相比,5年生存率并无明显提高。但是,有研究证明前者可提高患者5年的无瘤生存率[2]。另外,蔡建强等[3]报道,行肝脾联合切除术后,患者3年及5年的肿瘤复发率均明显低于单纯行肝癌切除术的患者。
本次Meta分析共纳入了8项研究,研究方法均为NRCs且质量一般,故存在实施偏倚、选择偏倚以及测量偏倚的可能性较大。由于各研究机构的设备资源不一,且实施者的技术水平存在差异,故其异质性可能会对结果造成一定影响。另一方面,本次分析所纳入的研究均来自东亚地区(6项来自我国,2项来自韩国),故本次研究的临床证据在国外患者临床治疗的推广方面可能存在限制。此外,相当部分肝癌合并肝硬化脾亢的患者伴有不同程度的食管-胃底静脉曲张,而其破裂出血引起的上消化道出血是肝癌病人的四大死亡原因之一。因此,在积极处理肝癌病灶的同时,采取适当的治疗措施对于提高原发性肝癌的总体疗效意义重大,而在肝脾联合切除的基础上行门奇静脉断流术便是首选治疗[23]。但本次纳入文献大多数未提及该术式,故难以统计。另一方面,门静脉血栓形成是脾切除术后的常见并发症,其临床表现为不明原因的发热、腹痛、恶心以及呕吐[24],同时可能进一步增加门静脉的压力且对肝功能造成严重影响,并提高了发生上消化道出血以及急性肠梗阻的风险。本次分析所纳入的研究中,共2项[3,12]对该并发症进行了报道。其中Kim等[13]在其研究中指出,HS组在术后发生门静脉血栓的患者多达8例(占该组人数的42.1%),而H组仅发生2例(占该组人数的5.1%),P=0.001。而另1项[3]研究未报道具体临床数据,故本次Meta分析难以对此进行统计分析。因此,对于肝脾联合切除是否增加门静脉血栓形成的风险需要更多的高质量研究。
综上,通过本次Meta分析发现,肝脾联合切除术与单纯肝癌切除术相比,其在围手术期并发症发生率、围手术期死亡率及术后5年生存率方面均无明显差异。但是由于术后白细胞及血小板的回升,有利于术后按计划进行化疗,同时患者的免疫功能可能得到改善,从而提高了机体抗肿瘤能力。由于纳入研究均为回顾性研究,且研究质量均显一般,故本次分析的证据强度受限。因此,尚需要有更多相关的高质量临床研究,尤其是前瞻性对照性研究,以进一步明确两种术式对肝癌合并脾功能亢进患者的预后疗效。
1 Schuppan D,Afdhal NH. Liver cirrhosis. Lancet,2008,371:838-851.
2 Chen XP,Wu ZD,Huang ZY,et al.Use of hepatectomy and splenectomy to treat hepatocellular carcinoma with cirrhotic hypersplenism.Br J Surg,2005,92:334-339.
3 蔡建强,胡敬群,毕新宇,等.腹部外科肝脾联合切除术治疗肝癌合并肝硬化脾功能亢进的远期疗效.中华医学杂志,2004,84:6-8.
4 Oh JW,Ahn SM,Kim KS,et al.The role of splenectomy in patients with hepatocellular carcinoma and secondary hypersplenism.Yonsei Med J,2003,44:1053-1058.
5 左朝晖,王心见,莫胜川,等.原发性肝癌伴脾功能亢进的治疗(附140例报告).中国医师杂志,2005,7:1083-1084.
6 杨广顺,杨宁.肝脾联合切除治疗肝癌与门静脉高压.中国实用外科杂志,2005,25:454-456.
7 杨田,卢军华,杨广顺,等.肝癌切除联合脾切除贲门周围血管离断术的临床应用.中华外科杂志,2009,47:1035-1036.
8 Ikegami T,Shimada M, Imura S.Recent role of splenectomy in chronic hepatic disorders.Hepatology Research,2008,38: 1159-1171.
9 Cao ZX,Chen XP,Wu ZD.Effects of splenectomy in patients with cirrhosis undergoing hepatic resection for hepatocellular carcinoma. World J Gastroenterol,2003,9:2460-2463.
10左朝晖,张柏和,姜小清,等.肝癌伴脾功能亢进症行肝脾联合切除术后肝功能和免疫功能的变化.中国普通外科杂志,2008,17:6-9.
11毕新宇,赵建军,阎涛,等.肝癌合并肝硬化脾功能亢进的围手术期处理.中华外科杂志,2010,48:1539-1541.
12Wang C,Li C,Wen TF,et al.Safety of synchronous hepatectomy and splenectomy for patients with hepatocellular carcinoma and hypersplenism.Hepatogastroenterology,2012,59:526-528.
13Kim SH,Kim dY,Lim JH,et al.Role of splenectomy in patients with hepatocellular carcinoma and hypersplenism.ANZ J Surg,2013,83: 865-870.
14Llovet JM,Fuster J,Bruix J.Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma:resection versus transplantation. Hepatology (Baltimore, Md.),1999,30:1434-1440.
15Bruix J,Castells A,Bosch J,et al.Surgical resection of hepatocellular carcinoma in cirrhotic patients: prognostic value of preoperative portal pressure. Gastroenterology,1996,111:1018-1022.
16Choi GH,Park JY,Hwang HK,et al.Predictive factors for long-term survival in patients with clinically significant portal hypertension following resection of hepatocellular carcinoma. Liver Int,2011,31:485-493.
17Cucchetti A,Ercolani G,Vivarelli M,et al.Is portal hypertension a contraindication to hepatic resection. Ann Surg,2009,250:922-928.
18Capussotti L,Ferrero A,Vigano L,et al.Portal hypertension: contraindication to liver surgery.World J Surg,2006,30:992-999.
19Shimada M,Hashizume M,Shirabe K,et al.A new surgical strategy for cirrhotic patients with hepatocellular carcinoma and hypersplenism. Performing a hepatectomy after a laparoscopic splenectomy. Surg Endosc,2000,14:127-130.
20Sugawara Y,Yamamoto J,Shimada K,et al.Splenectomy in patients with hepatocellular carcinoma and hypersplenism. J Am Coll Surg, 2000,190:446-450.
21Akahoshi T,Hashizume M,Tanoue K,et al.Role of the spleen in liver fibrosis in rats may be mediated by transforming growth factor beta-1.J Gastroenterol Hepatol,2002,17:59-65.
22Arakawa Y,Shimada M,Uchiyama H,et al.Beneficial effects of splenectomy on massive hepatectomy model in rats. Hepatol Res,2009,39:391-397.
23杨广顺,钱毅,卢军华,等.肝癌切除附加脾切除、门奇断流治疗肝癌合并门脉高压症(附67例报告).中国肝胆外科杂志,2004, 10: 656-659.
24Rattner DW,Ellman L,Warshaw AL.Portal vein thrombosis after elective splenectomy. An underappreciated, potentially lethal syndrome. Arch Surg,1993,128:565-570.
