敲减SOX2对肝细胞癌肿瘤干细胞特性的影响
2014-02-27张占国吴延诲梁慧芳张必翔
张占国 吴延诲 梁慧芳 张必翔
肿瘤干细胞是一群处于肿瘤细胞之中,具有自我更新能力及增殖分化能力的细胞亚群,往往具有一定的干细胞标记物及特异性的分子表达水平[1-2]。Sox2是一种早已被很多人熟知的干细胞相关性转录因子,其在正常细胞及组织发育及肿瘤的复发转移及再生过程中起到非常重要的作用[3-10]。在此我们探讨sox2在肝细胞癌中的作用及机制。
材料与方法
一、实验材料及细胞培养
人肝细胞癌PLC/PRF/5细胞购于美国ATCC,此细胞系应用于很多研究当中[11-13]。培养液成分为DMEM加10%胎牛血清(Gibco),37 ℃ 5% CO2细胞培养箱无菌培养。抗体sox2抗体购于BD公司,β-actin抗体购于Sigma,辣根过氧化酶标记羊抗兔二抗购于Santa Cruz公司。
二、Western blot技术
长至70%~80%满地细胞经胰酶消化或成球细胞经磷酸缓冲液(PBS)洗涤后加细胞裂解液在冰面上裂解30 min。裂解得到的蛋白样品加入上样缓冲液后沸水煮5 min。20 μg样品上样于每个孔。经SDS分离胶电泳分离后转于PVDF膜上,5%脱脂牛奶封闭后,一抗孵育过夜。再经过二抗孵育后ECL发光检测信号强度。
三、肿瘤成球实验
PLC/PRF/5细胞经胰酶消化后充分打散,滤过200目滤网得到单细胞悬液,悬浮生长于低黏附细胞培养6孔板中,每组3个复孔。培养液为无血清的DMEM/F12加1∶50 B27,20 ng/ml EGF,20 ng/ml bFGF及1X胰岛素。悬浮培养10 d后在Gel counter机器上检测肿瘤成球的大小及多少进行比较。
四、动物及分组
25只4~6周龄雌性SPF级裸鼠购于北京华阜康公司,并饲养于华中科技大学动物实验中心SPF级动物房内。随机分成5组,每组5只用于皮下成瘤实验。
五、裸鼠皮下成瘤实验
PLC/PRF/5细胞及成球细胞经胰酶消化后与matrigel(BD)按1∶1混合后终浓度为1×107/ml。1×106个细胞/100 μl细胞注射到裸鼠后腿部皮下,长到可以触摸到的肿瘤后,开始每周测量一次,肿瘤体积按照肿瘤长径×短径2×π/6计算。
六、数据处理
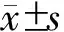
结 果
一、PLC/PRF/5细胞sox2基因敲减水平检测
对PLC/PRF/5细胞sox2基因慢病毒稳定转染进行敲减,用于慢病毒包装的质粒是我们实验室自己构建的可诱导性敲减shRNA质粒,敲减结果见图1。PLC/PRF/5成球细胞比其2D培养细胞的sox2表达相比明显提高(图1)。
二、细胞成球试验
表明敲减sox2的PLC/PRF/5细胞成球能力明显低于PLC/PRF/5原代细胞。100 ng/ml多氧西林诱导敲减sox2的PLC/PRF/5细胞成球数量大约为(13.0±7.1)个/5000细胞和(51.0±11.7)个/5000细胞,明显低于未加多氧西林诱导的对照组。10 ng/ml诱导组与对照组相比无明显差异;50 ng/ml诱导组在成球大小明显小于对照组。(图1、2)。
三、在体内试验中sox2促进肿瘤形成能力
sox2敲减后的PLC/PRF/5细胞进行裸鼠皮下成瘤实验。实验结果表明sox2敲减组肿瘤形成能力明显低于野生型组,P<0.01。由成球细胞形成的肿瘤明显大于对照未敲减细胞,P<0.05(图3)。
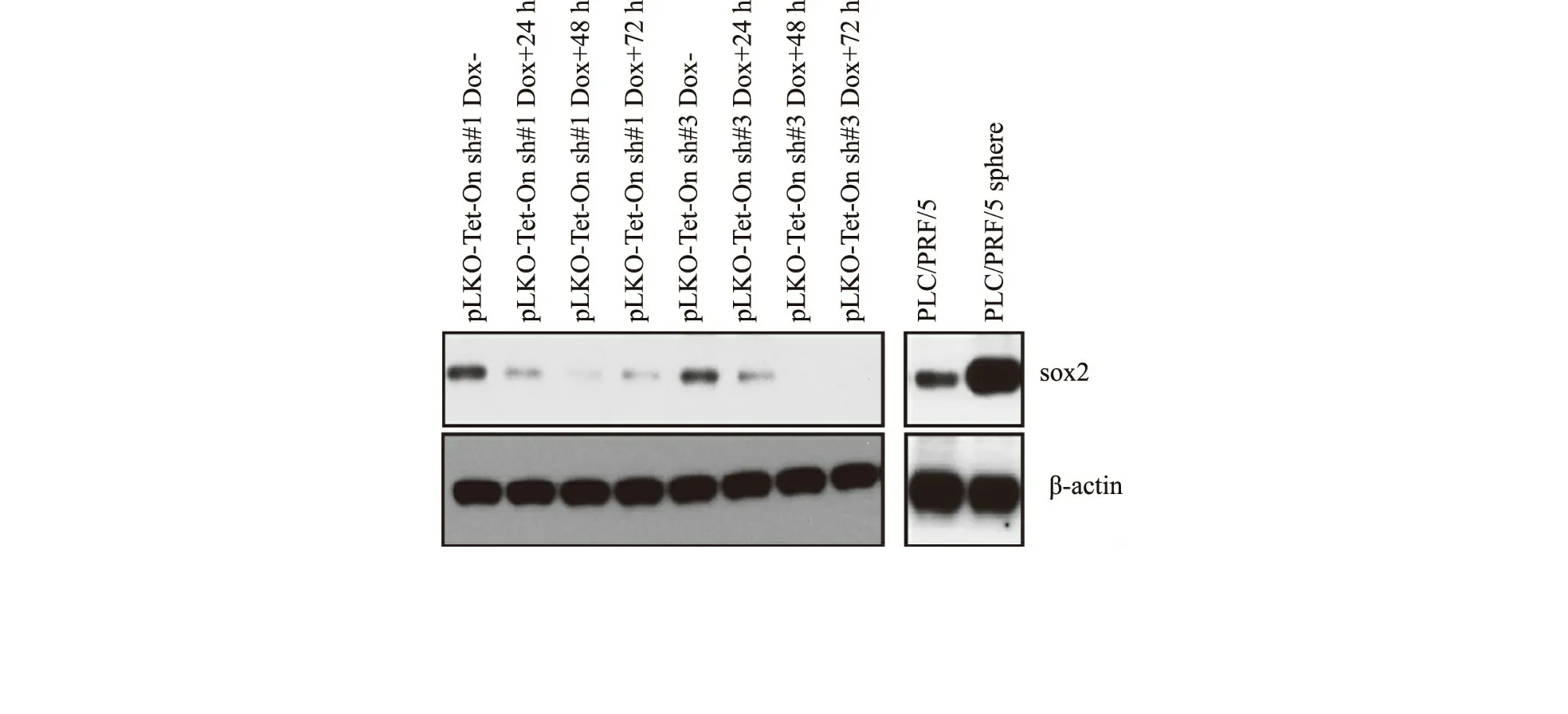
图1 PLC/PRF/5细胞稳定转染sox2敲减质粒慢病毒系统后,加100μg/L多氧西林继续培养24、48及72h后,利用West⁃ernblot方法检测转染细胞中sox2的表达水平;利用Westernblot技术检测PLC/PRF/5细胞与成球细胞中sox2的表达水平
讨 论
在细胞调控过程中转录因子作为信号通路的最终部分在正常细胞及肿瘤细胞中均起到非常重要的作用。sox2是某些转录因子核心组成部分,负责维持正常胚胎细胞及胚胎性癌细胞的自我更新能力及未分化状态[14]。在正常细胞中,其作用常表现为维持细胞干性、促进细胞自我更新及维持分化潜能。在肿瘤细胞中,则表现为无限的增殖能力及自我更新和分化成癌细胞的能力。正因为如此,sox2一直被认为是致癌性的转录因子和关键癌症干细胞(CSC)的生物标记物。这一现象已经被广泛发现与具有干细胞特性的癌细胞之中[15]。sox2在肝癌中的研究相对来说较少,在肝癌干细胞中的作用研究更是少之又少[15-17]。此外, sox2是成体干细胞表型维持的一个重要因素,并在细胞命运决定中扮演主要角色。肿瘤的恶性增生表明sox2很有可能是一个中心调控因子,其作用涉及到肿瘤形成能力、肿瘤细胞具有干性的亚群,这一直被认为是肿瘤干细胞特性[18]。这一特性可以促发多种肿瘤细胞增殖、侵袭及转移[19-20]。在正常干细胞中被sox2调控的很多基因很多情况下是发生异常调控的,异常调控发生后导致各种疾病及肿瘤发生。
肿瘤细胞成球实验是最早应用于神经干细胞发现及培养的方法,后来被广泛应用于各种类型正常干细胞及肿瘤干细胞的干性能力评估[21-22]。其中乳腺细胞成球试验、肝癌细胞成球试验及胰腺癌细胞成球试验已经成功运用于研究这三种肿瘤干细胞干性的标准方法[23-24]。在无血清的培养环境中,具有自我更新能力的肿瘤细胞或者正常组织细胞存活下来,并实现自我复制增殖,在悬浮生长环境中由单个细胞分裂产生的细胞往往会成球状排列,这也是成球试验的一个特性。在此,我们利用肝癌细胞成瘤实验证实sox2对肝细胞癌干细胞的调控功能,发现异常表达的sox2可以明显促进肝癌细胞的干性。而具有干性的肝癌细胞球sox2表达明显高于正常细胞系。在此我们的这一发现说明,具有干性的成球细胞具有较高的sox2表达,这一点从某种意义上验证了sox2在肝癌干性细胞的维持中发挥作用。
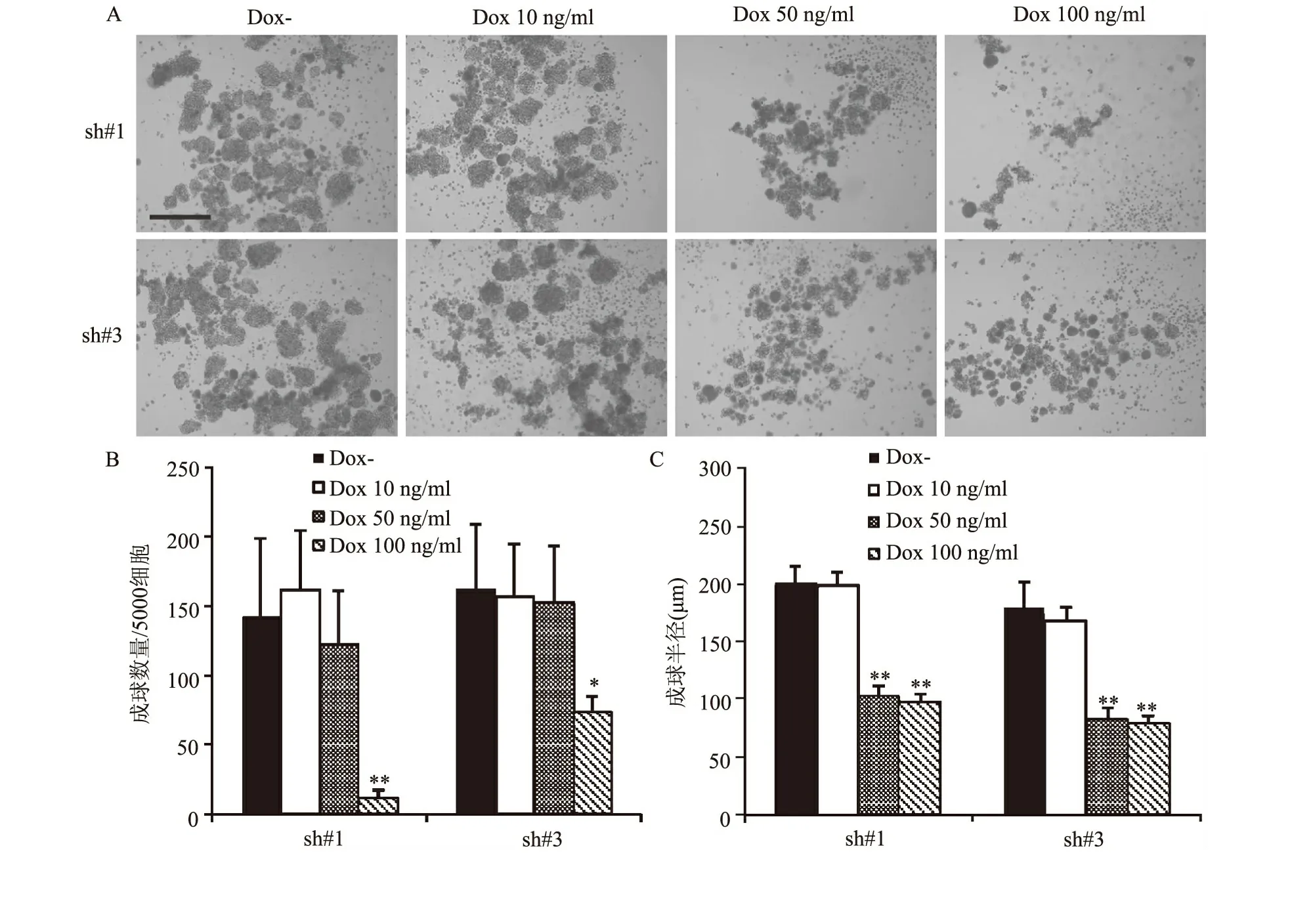
图2 A所示为稳定转染后PLC/PRF/5细胞成球实验的代表性图片,黑色短线条代表长度为500μm;B柱状图所示为成球的数量多少;C柱状图为成球的半径的统计分析
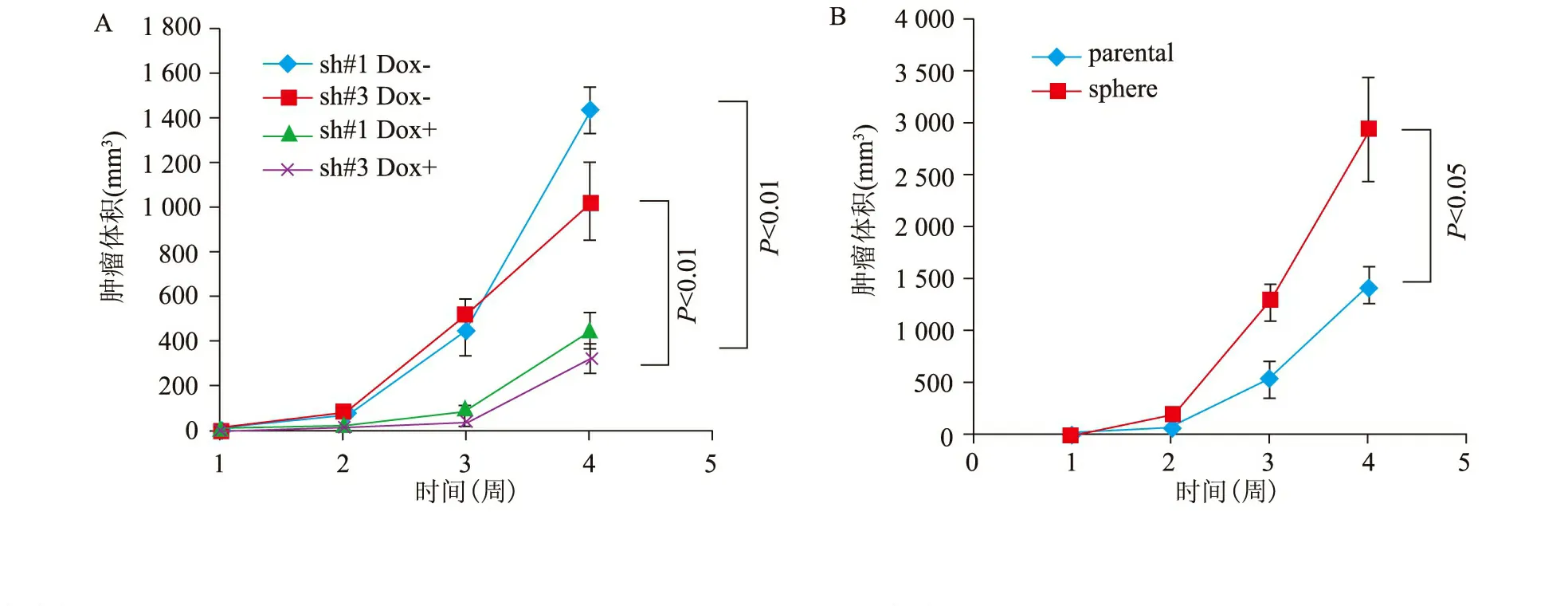
图3 Sox2对肿瘤形成能力的影响,诱导敲减sox2的小鼠灌胃多氧西林组小鼠皮下肿瘤生长速度明显高于喂水的对照组(A);PLC/PRF/5成瘤细胞与普通二维培养细胞的肿瘤形成能力比较(B)
可诱导性基因敲减系统是我们实验室建立的一套以慢病毒为载体的稳定的基因敲减系统。载体质粒上具有识别多氧西林等一些小分子化合物的靶点,与此类化合物结合后转录因子被激活,进而发生基因转录,表达敲减目的基因的发夹样结构的干扰RNA(shRNA)。稳定表达的shRNA进入细胞中与特异性基因的特殊区段结合,影响该基因的翻译,进而发挥基因敲减作用。我们利用可诱导性敲减系统对人肝细胞癌PLC/PRF/5细胞中sox2进行敲减,敲减后的细胞经过多氧西林诱导,以Western blot技术检测其敲减效果良好。并且发现敲减后细胞成球能力明显减弱。此外,动物实验表明sox2敲减后细胞在裸鼠体内成瘤能力明显降低。本研究仅在现象水平上对sox2在肝癌肿瘤相关干性维持中的作用加以说明,没有深入探讨机制,这也是我们以后的研究目标所在。我们的结果为后续机制的研究提供了必不可少的强有力的事实依据。综上所述,sox2可能在肝癌干细胞特性维持中发挥一定作用,是否为主要调控转录因子,我们尚需进一步研究。
1 Kasai T,Chen L,Mizutani A,et al.Cancer stem cells converted from pluripotent stem cells and the cancerous niche.J Stem Cells Regen Med,2014,10:2-7.
2 van Rijn SJ,Tryfonidou MA,Hanson JM,et al.Stem cells in the canine pituitary gland and in pituitary adenomas.Vet Q,2013,33:217-224.
3 Weina K,Utikal J.SOX2 and cancer:current research and its implications in the clinic.Clin Transl Med,2014,3:19.
4 Lee SH,Oh SY,Do SI,et al.SOX2 regulates self-renewal and tumorigenicity of stem-like cells of head and neck squamous cell carcinoma.Br J Cancer,2014,10.1038/bjc.2014.528.
5 Zhang S,Cui W.Sox2,a key factor in the regulation of pluripotency and neural differentiation.World J stem cells,2014,6:305-311.
6 Siegle JM,Basin A,Sastre-Perona A,et al.SOX2 is a cancer-specific regulator of tumour initiating potential in cutaneous squamous cell carcinoma.Nat Commun,2014,5:4511.
7 Becher OJ,Holland EC.Sox2,a marker for stem-like tumor cells in skin squamous cell carcinoma and hedgehog subgroup medulloblastoma.EMBO J,2014,33:1984-1986.
8 Wang X,Ji X,Chen J,et al.SOX2 enhances the migration and invasion of ovarian cancer cells via Src kinase.PloS One,2014,9:e99594.
9 Boumahdi S,Driessens G,Lapouge G,et al.SOX2 controls tumour initiation and cancer stem-cell functions in squamous-cell carcinoma.Nature,2014,511:246-250.
10Prior HM,Walter MA.SOX genes:architects of development.Mol Med,1996,2:405-412.
11Zhang F,Qi Y,Harrison TJ,et al.Hepatitis E genotype 4 virus from feces of monkeys infected experimentally can be cultured in PLC/PRF/5 cells and upregulate host interferon-inducible genes.J Med Virol,2014,86:1736-1744.
12Deng Q,Li KY,Chen H,et al.RNA interference against cancer/testis genes identifies dual specificity phosphatase 21 as a potential therapeutic target in human hepatocellular carcinoma.Hepatology,2014,59:518-530.
13MacNab GM,Alexander JJ,Lecatsas G,et al.Hepatitis B surface antigen produced by a human hepatoma cell line.Br J Cancer,1976,34:509-515.
14Liu K,Lin B,Zhao M,et al.The multiple roles for Sox2 in stem cell maintenance and tumorigenesis.Cell Signal,2013,25:1264- 1271.
15Sun C,Sun L,Li Y,et al.Sox2 expression predicts poor survival of hepatocellular carcinoma patients and it promotes liver cancer cell invasion by activating Slug.Med Oncol,2013,30:503.
16Huang P,Qiu J,Li B,et al.Role of Sox2 and Oct4 in predicting survival of hepatocellular carcinoma patients after hepatectomy.Clin Biochem,2011,44:582-589.
17Xu XL,Xing BC,Han HB,et al.The properties of tumor-initiating cells from a hepatocellular carcinoma patient's primary and recurrent tumor.Carcinogenesis,2010,31:167-174.
18Masui S,Nakatake Y,Toyooka Y,et al.Pluripotency governed by Sox2 via regulation of Oct3/4 expression in mouse embryonic stem cells.Nat Cell Biol,2007,9:625-635.
19Han X,Fang X,Lou X,et al.Silencing SOX2 induced mesenchymal-epithelial transition and its expression predicts liver and lymph node metastasis of CRC patients.PloS One,2012,7:e41335.
20Girouard SD,Laga AC,Mihm MC,et al.SOX2 contributes to melanoma cell invasion.Lab Invest,2012,92:362-370.
21Fang X,Yoon JG,Li L,et al.The SOX2 response program in glioblastoma multiforme:an integrated ChIP-seq,expression microarray,and microRNA analysis.BMC Genomics,2011,12:11.
22He G,Cao X,He M,et al.Casticin inhibits self-renewal of liver cancer stem cells from the MHCC97 cell line.Oncol Lett,2014,7:2023-2028.
23Lamb R,Lisanti MP,Clarke RB,et al.Co-ordination of cell cycle,migration and stem cell-like activity in breast cancer.Oncotarget,2014,5:7833-7842.
24Hashimoto N,Tsunedomi R,Yoshimura K,et al.Cancer stem-like sphere cells induced from de-differentiated hepatocellular carcinoma-derived cell lines possess the resistance to anti-cancer drugs.BMC Cancer,2014,14:722.
