表面活性剂SDS辅助微波提取金佛手总黄酮工艺及抗氧化活性评价
2014-02-27赵丽丽蔡露茜叶竞雄赵玉玲
赵丽丽,蔡露茜,叶竞雄,冯 洁,赵玉玲,*
(1.浙江中鼎检测技术有限公司,浙江 义乌 322000;2.浙江师范大学化学与生命科学学院,浙江 金华 321004)
表面活性剂SDS辅助微波提取金佛手总黄酮工艺及抗氧化活性评价
赵丽丽1,蔡露茜2,叶竞雄2,冯 洁2,赵玉玲2,*
(1.浙江中鼎检测技术有限公司,浙江 义乌 322000;2.浙江师范大学化学与生命科学学院,浙江 金华 321004)
通过单因素试验和正交试验设计,分别研究了表面活性剂十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)质量分数、料液比、微波功率和微波时间对金佛手总黄酮提取量的影响。确定微波提取最佳工艺条件为表面活性剂SDS质量分数0.6%、料液比1∶20(g/mL)、微波功率50 W、微波时间30 s,在此工艺条件下金佛手总黄酮提取量为18.706 0 mg/g。金佛手总黄酮对DPPH自由基和ABTS自由基清除率分别为79.15%和65.25%,其抗氧化活性略低于槲皮素。结果表明,金佛手总黄酮具有显著抗氧化活性,可作为抗氧化剂应用到食品和医药领域。
金佛手总黄酮;表面活性剂SDS;微波提取;抗氧化活性
佛手为芸香科柑橘属植物,主产于热带和亚热带,在我国浙江、福建、广东、四川、云南等地均有栽培[1]。“金佛手”是指产于浙江金华的佛手。佛手主要化学成分为香豆素类和黄酮类[2-4],具有舒肝和胃、行气止痛、祛湿化痰等功效。黄酮类是指以黄酮(2-苯基-苯并-g-吡喃酮)为母体的一大类化合物,广泛分布于植物界,是许多中草药的有效成分。黄酮类化合物作为天然抗氧化剂中重要的一部分,其抗氧化方面的研究已经有了很大的发展[5-10]。目前对金佛手的研究主要集中在化学成分、挥发油及佛手多糖等方面[11-12],而对金佛手总黄酮的提取工艺及抗氧化活性评价则几乎空白。
表面活性剂辅助微波提取植物中的总黄酮已见报道[13-15],提取得到的总黄酮具有较强清除自由基的能力[16-18],本研究在前期工作的基础上[19],利用表面活性剂十二烷基磺酸钠辅助微波提取金佛手中的总黄酮,采用单因素及正交试验对提取条件进行优化,并对其抗氧化活性进行了研究,旨在为金佛手的进一步开发应用提供理论基础。
1 材料与方法
1.1 材料与试剂
外观如观音手,色泽金黄油亮的成熟佛手鲜果,购自浙江金华花卉市场。
槲皮素标准品(纯度>98%) 中国食品药品检定研究院;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2’-azinobis (3-ethylbenzothiazolingsulfonic acid),ABTS)、十二烷基磺酸钠(sodium dodecyl sulfonate,SDS) 美国Sigma公司;无水乙醇、氢氧化钠、硝酸铝、亚硝酸钠、二氧化锰均为国产分析纯;实验用水为自动三重纯水蒸馏器烧制蒸馏水。
1.2 仪器与设备
BS124S电子分析天平 赛多利斯科学仪器北京有限公司;Lambda25紫外-可见分光光度计 美国Perkin Elmer公司;KD23B-DA美的微波炉 佛山市顺德区美的微波电器制造有限公司;R1001V旋转蒸发仪、DEF-300真空干燥箱 郑州长城科工贸有限公司;Science-IID细胞破碎仪 上海京工实业有限公司;SZ-97A自动三重纯水蒸馏器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 制样
将新鲜金佛手削皮切小片,平铺于托盘中,于53 ℃温度条件下置于烘箱中放24 h。取出后,磨粉过60 目筛备用。
1.3.2 金佛手总黄酮的提取工艺
精密称取金佛手粉1 g共9 份,按照一定料液比加入不同质量分数SDS溶液浸泡24 h。在微波炉中进行提取,用真空泵抽提过滤,将提取液用旋转蒸发仪减压浓缩。滤液转移入100 mL容量瓶,用体积分数60%乙醇溶液稀释至刻度。
1.3.3 槲皮素标准溶液的配制
精密称取槲皮素标准品0.050 0 g,用体积分数60%乙醇溶液溶解,在100 mL容量瓶中定容,摇匀,得到质量浓度0.500 0 mg/mL的槲皮素标准液。
1.3.4 测定波长的选择
分别取样液和槲皮素标准液各10 mL于50 mL容量瓶中,用体积分数50%乙醇水溶液稀释至约25 mL,加入1.4 mL亚硝酸钠(质量分数5%)摇匀,静置6 min;然后加入1.4 mL硝酸铝(质量分数10%),摇匀,静置6 min;最后加入10 mL氢氧化钠(1 mol/L),然后补加50%乙醇溶液至刻度,静置10 min。以50%乙醇溶液为空白参比,在紫外-可见分光光度计上扫描300~700 nm波长范围内的图谱(图1)。金佛手样品液在250~350 nm波长范围内有最大吸收峰,槲皮素标准溶液在280~300 nm和320 nm左右波长处有吸收峰。黄酮类化合物具有羰基与两芳香环形成的共轭体系,在紫外区产生特征吸收。故对提取样品液选择在吸收波长300 nm条件下定量测定。

图1 槲皮素标准品(A)和金佛手样液(B)的吸收光谱Fig.1 Absorption spectra of quercetin standard and flavonoids extracted from fingered citron
1.3.5 标准曲线及回归方程的建立
分别取0、4.00、8.00、12.00、16.00、20.00 mL槲皮素标准液于50 mL容量瓶中,按照1.3.4节的方法,以试剂做空白参比,紫外-可见分光光度计上测300 nm波长处吸光度,记录数据。以槲皮素标准液质量浓度(mg/mL)为横坐标,以吸光度为纵坐标,绘制标准曲线。
1.3.6 金佛手总黄酮提取量测定
分别取待测提取液各10 mL,按1.3.4节方法测定提取液的吸光度,根据标准曲线回归方程及式(1)计算金佛手总黄酮提取量。
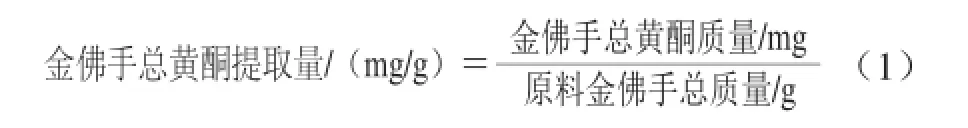
1.3.7 金佛手总黄酮提取的单因素试验
1.3.7.1 SDS质量分数对总黄酮提取量的影响
精密称取金佛手粉1 g五份,以1∶15的料液比分别加入质量分数为0.4%、0.6%、0.8%、1.0%、1.2%的SDS溶液,浸泡24 h。微波功率50 W、微波时间50 s,过滤、定容,测定总黄酮提取量。
1.3.7.2 料液比对总黄酮提取量的影响
精密称取金佛手粉1 g五份,以1∶5、1∶10、1∶15、1∶20、1∶25的料液比加入质量分数0.6%的SDS溶液,浸泡24 h。微波功率50 W、微波时间50 s,过滤、定容,测定总黄酮提取量。
1.3.7.3 微波功率对总黄酮提取量的影响
精密称取金佛手粉1 g五份,以1∶15的料液比加入质量分数0.6%的SDS溶液,浸泡24 h。微波功率分别为10、30、50、80、100 W,微波时间50 s,过滤、定容,测定总黄酮提取量。
1.3.7.4 微波时间对总黄酮提取量的影响
精密称取金佛手粉1 g五份,以1∶15的料液比加入质量分数0.6%的SDS溶液,浸泡24 h。微波功率50 W,微波时间分别为10、30、50、70、90 s,过滤、定容,测定总黄酮提取量。
1.3.8 正交试验设计
在单因素试验基础上,选择SDS质量分数、料液比、微波功率和微波时间4 个因素,按照正交试验四因素三水平设计(表1),以金佛手中总黄酮提取量为指标,进行正交试验。

表1 正交试验因素水平表Table 1 Factors and levels used in orthogonal array design
1.3.9 金佛手总黄酮抗氧化活性测定
1.3.9.1 金佛手总黄酮对DPPH自由基清除能力测定
佛手总黄酮清除自由基能力通过佛手黄酮与DPPH作用进行测定[20-21]。参照罗丽萍[22]的方法:准确配制浓度为2×10-4mol/L的DPPH溶液和质量浓度分别为2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0 mg/L的金佛手黄酮溶液。比色管中准确量入2 mL DPPH溶液和2 mL金佛手黄酮溶液,25 ℃水浴中放置30 min,517 nm波长处测其吸光度。金佛手黄酮对DPPH自由基的清除率可用式(2)计算:
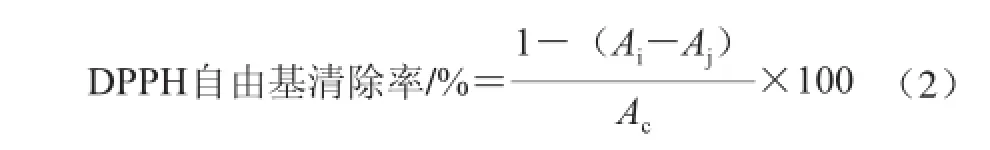
式中:Ai为2 mL金佛手黄酮溶液+2 mL DPPH溶液吸光度;Aj为2 mL金佛手黄酮溶液+2 mL 95%乙醇溶液吸光度;Ac为2 mL DPPH溶液+2 mL 95%乙醇溶液吸光度。
1.3.9.2 金佛手总黄酮对ABTS自由基清除能力的测定
黄酮类化合物的抗氧化活性测定采用ABTS方法[23]。具体步骤为:ABTS溶解在水中,最终浓度为7 mmol/L,加入适量的二氧化锰以产生ABTS自由基,含有ABTS自由基的溶液可在室温下避光保存12 h以上,然后用针头过滤器过滤,室温下避光再保存6 h。ABTS自由基可在室温下避光保存2 d以上。测定黄酮类化合物的抗氧化活性之前,先用乙醇稀释ABTS自由基使之吸光度为0.70±0.02(25 ℃,734 nm波长处)。测试时,取1 mL稀释ABTS自由基溶液加入到10 μL溶解在乙醇中的黄酮类化合物溶液中,2 min后记下吸光度。金佛手黄酮对ABTS自由基的清除率可用式(3)计算。
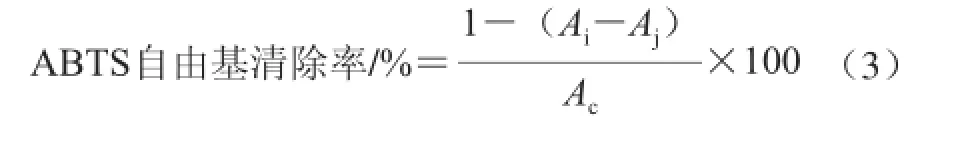
式中:Ai为10 μL金佛手黄酮溶液+1 mL ABTS溶液吸光度;Aj为10 μL金佛手黄酮溶液+1 mL 95%乙醇溶液吸光度;Ac为1 mL ABTS溶液+10 μL 95%乙醇溶液吸光度。
1.4 数据处理
2 结果与分析
2.1 标准曲线方程
在0~0.20 mg/mL范围内,槲皮素质量浓度与吸光度之间具有良好线性关系,线性相关性为0.999 8,线性回归方程y=6.106 2x-0.010 3,其中x表示槲皮素质量浓度,y表示300 nm波长处的吸光度。
2.2 金佛手总黄酮提取的单因素试验
2.2.1 SDS质量分数对金佛手总黄酮提取量的影响

图2 SDS质量分数对总黄酮提取量的影响Fig.2 Effect of SDS concentration on the extraction efficiency of total flavonoids
由图2可知,随着SDS质量分数的增加,金佛手总黄酮提取量逐渐增加,在SDS的质量分数达到0.6%~0.8%时提取量达到最大值(平行测样3 次),随后,总黄酮提取量随着SDS质量分数增加而略有降低。其原因可能是随着表面活性剂增加,溶液中胶束数量也在增加,从而增强了溶解能力,因此导致总黄酮提取量增加较快。由于金佛手中黄酮含量有限,因此当SDS质量分数继续增加时,则总黄酮提取量没有增加。考虑到经济性,选取SDS质量分数为0.6%进行总黄酮的提取。
2.2.2 料液比对总黄酮提取量的影响

图3 料液比对总黄酮提取量的影响Fig.3 Effect of material-to-liquid ratio on the extraction efficiency of total flavonoids
由图3可知,最佳料液比是1∶20(g/mL)。总黄酮提取量随着液体含量的增加出现递增的趋势,但当料液比在1∶20之后时,提取量开始下降。可能因为金佛手总黄酮中还存在棕榈酸等水溶性物质,若是溶液含水过少,则原料与溶液接触面不够,进而影响这部分黄酮类化合物的溶解及浸出。当液体含量过高时,溶剂吸收的能量增加,减少了金佛手原料对于能量的吸收而导致产率偏低,并且过多的溶剂会在后续的浓缩步骤中消耗过多的能量,因此选择料液比1∶20进行黄酮的提取。
2.2.3 微波功率对总黄酮提取量的影响
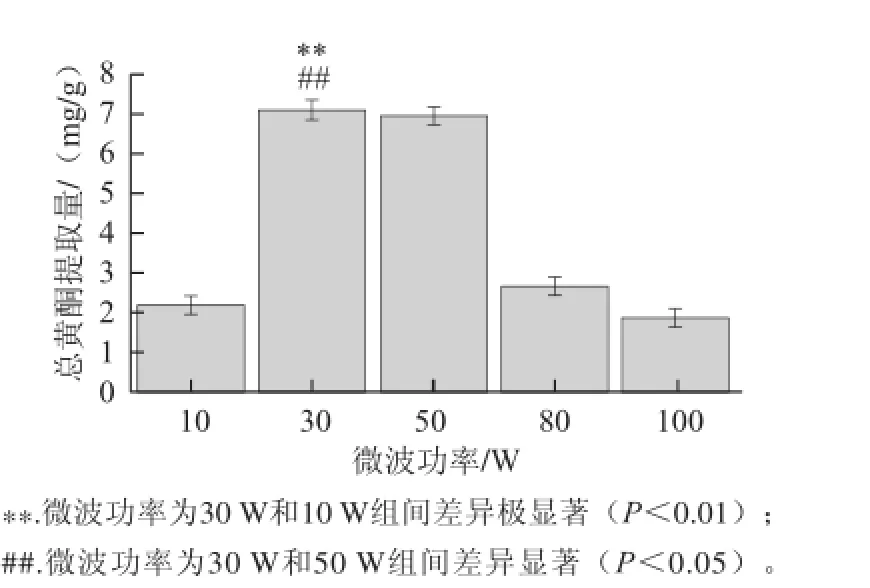
图4 微波功率对总黄酮提取量的影响Fig.4 Effect of microwave power on the extraction yield of total flavonoids
由图4可知,微波功率为30 W时的总黄酮提取量达到最大值。当微波功率大于30 W,提取量出现下降趋势。其原因可能是随着微波功率的升高,原材料破壁速度加快,黄酮溶出增加。但由于本研究使用的是普通微波炉,当微波功率增大时,一方面会有部分原料液损失,另一方面则是由于温度过高会导致部分黄酮类化合物分解或者结构改变,从而导致总黄酮提取量降低。
2.2.4 微波时间对总黄酮提取量的影响
由图5可知,最佳微波时间是50 s。微波时间越长,理论总黄酮提取量应该越多,但是随着微波时间的延长,提取容器中温度的急剧上升也可能导致部分黄酮类化合物的损失。

图5 微波时间对总黄酮提取量的影响Fig.5 Effect of microwave irradiation time on the extraction yield of total flavonoids
2.3 正交试验
L9(34)正交试验得到不同条件下佛手中总黄酮提取量及极差分析见表2,方差分析见表3。

表3 正交试验结果方差分析Table 3 Analysis of variance for the experimental results of orthogonal array design
结果表明,4 种因素对金佛手总黄酮提取量的影响次序依次为:料液比(B)>微波功率(D)>SDS质量分数(A)>微波时间(C)。最佳工艺条件为:B3D1A1C2,即在SDS溶液质量分数0.6%、料液比1∶20(g/mL)、微波炉中以30 W功率提取50 s的条件下,重复提取3 次,得到金佛手中总黄酮平均提取量为18.706 0 mg/g。
2.4 金佛手总黄酮抗氧化活性测定
2.4.1 金佛手总黄酮对DPPH自由基清除能力的测定
DPPH常用来筛选自由基清除剂以及评价物质的抗氧化活性[24]。金佛手黄酮对DPPH自由基的清除作用如图6所示。随着金佛手黄酮及槲皮素质量浓度的增加,对DPPH自由基清除率也在增加,在质量浓度为20 mg/L时,清除率分别为79.15%和86.80%(有显著性差异)。因此,金佛手黄酮对DPPH自由基具有良好的清除能力,清除效果略弱于槲皮素。

图6 金佛手总黄酮对DPPH自由基的清除作用Fig.6 DPPH radical scavenging activity of total flavonoids from fingered citron
2.4.2 金佛手总黄酮对ABTS自由基清除能力的测定
生物样品的总抗氧化能力通常用其对ABTS自由基的清除能力来表示。反应中,ABTS首先经过氧化生成稳定的蓝绿色ABTS水溶性自由基,待测物的加入可以使ABTS水溶性自由基的颜色减弱,其734 nm波长处的特征吸光度降低,根据吸光度的降低可以判断待测物的总抗氧化能力[25]。金佛手总黄酮对ABTS自由基的清除能力如图7所示。槲皮素和金佛手黄酮对ABTS自由基均有较强清除能力,且呈剂量依赖效应,在质量浓度为20 mg/L时,清除率分别为68.50%和65.25%(有显著性差异)。由此可见,金佛手黄酮对ABTS自由基具有较强清除能力,清除效果略低于槲皮素。

图7 金佛手总黄酮对ABTS自由基的清除作用Fig.7 ABTS radical scavenging activity of total flavonoids from fingered citron
3 结 论
研究结果表明,表面活性剂辅助微波提取金佛手中总黄酮的最佳工艺条件为SDS质量分数0.6%、料液比1∶20(g/mL)、微波功率30 W、微波时间50 s,在此条件下,金佛手中总黄酮提取量为18.706 0 mg/g,略低于已有研究[17]。分析可能是因为本研究中使用的是普通微波炉,无法对提取液进行长时间加热,导致在提取过程中,提取液有所损失,总黄酮并无完全溶出;微波技术和超声波技术的工作原理不同,也是导致SDS辅助微波提取金佛手中总黄酮得率较低的原因。对SDS辅助微波提取得到的金佛手总黄酮进行抗氧化活性检测,发现金佛手黄酮具有较强的清除DPPH自由基和ABTS自由基的能力,其抗氧化机理有待进一步研究。
[1] 宋立人. 现代中药学大辞典: 上册[M]. 北京: 人民卫生出版社, 2001: 1071.
[2] 松野隆男. 柑桔类成分的研究: 第五报[J]. 药学杂志, 1959, 79(4): 540-541.
[3] 高幼衡, 徐鸿华, 刁远明, 等. 佛手化学成分的研究: Ⅰ[J]. 中药新药与临床药理, 2002, 13(5): 315-316.
[4] 张颖, 孔令仪. 佛手化学成分的研究[J]. 中国现代中药, 2006 , 8(6): 16-17.
[5] ZHAO Yuling, LI Hailing, GAO Zhonghong, et al. Effects of flavonoids extraced from Scutellaria baicalensis Georgi on Hemin-nitrite-H2O2induces liver injury[J]. European Journal of Pharmacology, 2006, 536(1): 192-199.
[6] YAO Xincheng, ZHU Ling, CHEN Yuxin, et al. In vivo and in vitro antioxidant activity and α-glucosidase, α-amylase inhibitory effects of flavonoids from Cichorium glandulosum seeds[J]. Food Chemistry, 2013, 139(1): 59-66.
[7] ZHANG Huafeng, ZHANG Xiang, YANG Xiaohua, et al. Microwave assisted extraction of flavonoids from cultivated Epimedium sagittatum: extraction yield and mechanism, antioxidant activity and chemical composition[J]. Industrial Crops and Products, 2013, 50: 857-865.
[8] ITIDEL C, CHOKRI M, MOHAMED B, et al. Antioxidant activity, total phenolic and flavonoid content variation among Tunisian natural populations of Rhus tripartita (Ucria) Grande and Rhus pentaphylla Desf[J]. Industrial Crops and Products, 2013, 51: 171-177.
[9] YANG Yifei, MU Shaolin. Antioxidant activities and radical scavenging activities of flavonoids studied by the electrochemical methods and ESR technique based on the novel paramagnetic properties of poly(aniline-co-5-aminosalicylic acid)[J]. Electrochimica Acta, 2013, 109: 663-670.
[10] SAINT T, THITIMA L, NUANCHAWEE W, et al. Eriosema chinense: a rich source of antimicrobial and antioxidant flavonoids[J]. Phytochemistry, 2013, 96: 353-359.
[11] 赵兴杰, 籍保平, 赵磊, 等. 佛手挥发油不同提取方法的比较研究[J].食品科学, 2007, 28(4): 167-170.
[12] 章斌, 李远志, 陈宇, 等. 复合酶法提取广佛手多糖的工艺研究[J].安徽农业科学, 2010, 38(15): 7833-7835; 7873.
[13] 王纯荣, 郑国栋, 颜贤仔. 表面活性剂协同微波提取大豆荚黄酮的研究[J]. 江西农业大学学报, 2011, 33(1): 151-156.
[14] 王纯荣, 颜贤仔, 查龙华. 表面活性剂-微波法提取野生刺五加黄酮工艺[J]. 食品科技, 2011, 36(5): 203-207.
[15] 董树国, 陆钊, 曹宏梅. 表面活性剂辅助提取桑叶总黄酮的工艺研究[J]. 安徽农业科学, 2011, 39(32): 19778-19780.
[16] 李彩霞, 高海宁, 焦扬, 等. “黑美人”土豆黄酮提取及抗氧化活性[J]. 食品科学, 2013, 34(4): 88-93.
[17] 吴韶梅, 哈婧, 刘小争, 等. 芹菜叶提取物抗氧化作用研究[J]. 食品科学, 2010, 31(9): 103-105.
[18] 周小琦, 方敏, 宫智勇. 玫瑰花中总黄酮提取工艺及抗氧化与抑菌作用的研究[J]. 食品科学, 2010, 31(20): 102-105.
[19] 陈洁, 吕天喜, 叶竞雄, 等. 金佛手总黄酮的超声提取工艺研究[J].食品工业科技, 2012, 33(5): 262-264.
[20] BRAND-WILLIAMS W, CUVERLIER M E, BERSER C. Use of a free radical method to evaluate antioxidant activity[J]. Lebensmittel Wissenseaft and Technologic, 1995, 28(1): 25-30.
[21] 严建刚, 张名位, 杨公明, 等. 芹菜黄酮的提取条件及抗氧化活性研究[J]. 西北农业科技大学学报: 自然科学版, 2005, 33(1): 32-36.
[22] 罗丽萍. 甘薯叶柄藤中试综合提取的活性多糖、类黄酮构成及生理活性研究[D]. 南昌: 南昌大学, 2006: 70.
[23] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9/10): 1231-1237.
[24] 胡博然, 朱勇, 徐洁, 等. 电子自旋共振法和分光光度法测定酿酒葡萄籽原花青素抗氧化活性[J]. 食品科学, 2013, 34(1): 33-37.
[25] 孟庆焕, 王化, 王洪政, 等. 牡丹种皮黄酮提取及对ABTS自由基清除作用[J]. 植物研究, 2013, 33(4): 504-507.
Microwave Extraction Assisted with the Surfactant Sodium Dodecyl Sulphate and Antioxidant Activity Evaluation of Total Flavonoids from Fingered Citron (Citrus medica var. sarcodactylis)
ZHAO Li-li1, CAI Lu-xi2, YE Jing-xiong2, FENG Jie2, ZHAO Yu-ling2,*
(1. Zhejiang Zhongding Detect Technology Co. Ltd., Yiwu 322000, China; 2. College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004, China)
In the present study, the impacts of SDS concentration, material-to-liquid ratio, microwave power, and irradiation time on the extraction of total flavonoids from the fruits of fingered citron (Citrus medica var. sarcodactylis) were explored by single factor and orthogonal array designs. Results indicated that the optimal extraction conditions were determined as follows: SDS concentration, 0.6%; material-to-liquid ratio, 1:20 (g/mL); microwave power, 50 W; and irradiation time, 30 s. The yield of total flavonoids under the optimized conditions was 18.706 0 mg/g. The total flavonoids scavenged 79.15% of DPPH radical and 65.25% of ABTS radical, showing a slightly weaker radical scavenging activity than quercetin. Therefore, the total flavonoids from fingered citron have potent antioxidant activity and can be used as antioxidants in the food and medicine fields.
total flavonoids from fingered citron; SDS; microwave extraction; antioxidant activity
R284.2
A
1002-6630(2014)18-0047-05
10.7506/spkx1002-6630-201418009
2014-01-03
浙江省自然科学基金项目(Q12C050001);金华市科学技术研究计划项目(2012-3-073);浙江师范大学博士科研启动基金项目(ZC304009077);浙江师范大学开放实验项目(72)
赵丽丽(1983—),女,工程师,硕士,研究方向为生化检测。E-mail:zlili0307@163.com
*通信作者:赵玉玲(1977—),女,讲师,博士,研究方向为生物无机化学。E-mail:yulingzhao@zjnu.cn
