纤维素酶辅助提取芦笋黄酮及其抗氧化活性分析
2014-02-27董孝元方冬芬朱轶婷吴周和
董孝元,方冬芬,杨 梅,朱轶婷,吴周和,*
(1.湖北工业大学生物工程学院,湖北 武汉 430068;2.湖北省卫生厅卫生监督局,湖北 武汉 430070)
纤维素酶辅助提取芦笋黄酮及其抗氧化活性分析
董孝元1,方冬芬2,杨 梅1,朱轶婷1,吴周和1,*
(1.湖北工业大学生物工程学院,湖北 武汉 430068;2.湖北省卫生厅卫生监督局,湖北 武汉 430070)
以黄酮得率为指标,利用纤维素酶协同乙醇提取法从芦笋中提取黄酮,采用响应面设计优化最佳提取工艺参数。结果表明:当液料比50∶1(mL/g)、酶添加量0.20%、乙醇体积分数38.90%、酶解时间1.50 h、酶解温度50.0 ℃、pH 5.0时,芦笋黄酮最高得率为3.99%。当样品质量浓度达到100 μg/mL时,芦笋黄酮对羟自由基的清除率为46.08%,芦笋黄酮对超氧阴离子自由基的清除率为59.42%。小鼠体外抗氧化实验表明,20 μg/mL芦笋黄酮处理组超氧化物歧化酶(SOD)活力提高16.85%,丙二醛(MDA)含量减少2.49%。以D-半乳糖法亚急性衰老小鼠为模型,高剂量组小鼠血清和肝组织液SOD活力分别提高11.69%和27.62%,MDA含量分别减少38.04%和37.95%。
芦笋;黄酮;提取;抗氧化性
芦笋学名石刁柏,又名龙须菜、文山竹、细百叶等,是百合科天门冬属多年生宿根性草本植物,已有2000多年的栽培历史,原产于地中海沿岸和小亚细亚一带,20世纪由欧洲传入我国,现在国内各蔬菜产区均有种植。芦笋是一种质地优良、营养丰富的保健型蔬菜,其中多种活性成分和微量元素含量高于一般的果蔬。鲜芦笋含有的优质蛋白质、钙、铁、胡萝卜素以及维生素,而其中含有的丰富天冬氨酸、赖氨酸、黄酮类化合物及芦丁、槲皮素、甘露聚糖、甾体皂苷、多糖及叶酸等活性成分[1-3]。
芦笋中的黄酮类成分主要有芦丁、槲皮素、香橼素、山柰素等[4-6],能够清除人体中超氧阴离子自由基、抗衰老和增加机体免疫力,具有抗肿瘤活性[7]、降血压、降血脂、增进冠状动脉血流量、软化血管和防治冠心病、心绞痛等作用。研究[8]表明芦笋可有效阻止肿瘤细胞的增殖,对抑制子宫颈癌、肝癌及可移植性肿瘤等有特殊疗效,抑癌率达到32.4%。不同类型的黄酮类化合物极性不同,选择的提取溶剂也不同[9],芦笋黄酮的提取方法主要有溶剂萃取法[10]、碱性稀醇提取法、酸性乙醇提取法[11]、微波辅助提取法[12]、超声波辅助提取法[13]。
研究表明,在动物和人类代谢过程中产生活性氧(羟自由基、过氧化氢和超氧阴离子自由基)和活性氮(一氧化氮)。过量的自由基产生可以超过抗氧化酶如谷胱甘肽过氧化物酶、过氧化氢酶和超氧化物歧化酶及抗氧化物质如谷胱甘肽、VE或VC的生理抗氧化能力。由此,蛋白质、脂肪和DNA将成为自由基的攻击的目标,导致酶、细胞膜和基因物质的损伤和功能失调[14-15]。自由基和活性氧加速衰老和组织损伤,引起心血管疾病、炎症,导致神经退化性紊乱和癌症[16-17]。目前研究黄酮类化合物抗肿瘤、抗突变、抗动脉硬化,降低毛细血管的渗透性和脆性等功能主要基于其抗氧化活性[18]。
本实验以芦笋为原料,通过添加纤维素酶探索出一条新的提取芦笋黄酮的工艺路线,利用纤维素酶缩短提取时间,提取率也有提高。同时检测芦笋黄酮的体外和体内抗氧化能力,以期为进一步开发芦笋功能性食品提供依据。
1 材料与方法
1.1 材料与试剂
新鲜芦笋干燥粉碎过60目筛。
AlCl3、无水乙醇、冰醋酸、肝素钠、磷酸氢二钠、磷酸二氢钠、邻苯三酚、抗坏血酸、硫酸亚铁、过氧化氢、乙二胺四乙酸二钠、番红、D-半乳糖等均为分析纯;超氧化物歧化酶测试盒、微量丙二醛测试盒、纤维素酶(15 U/mg) 武汉市创新化工生物技术有限公司。
1.2 仪器与设备
BP211D电子天平 德国Sartorius公司;TGL-16C高速台式离心机 上海安亭仪器厂;KQ-300DE数控超声波清洗器 昆山市超声仪器有限公司;UV-2000紫外光谱分析仪 尤尼柯(上海)仪器有限公司;WH-3型微型旋涡混合仪 北京长源实验设备厂;DY89-Ⅱ型电动玻璃匀浆机 中山市衡新电子有限公司。
1.3 方法
1.3.1 标准曲线的制作
以芦丁为标准样品,称取芦丁8.0 mg,用20%乙醇溶解定容至100 mL,分别准确吸取芦丁标准液0.0、1.0、2.0、3.0、4.0、5.0 mL于6只比色管中,分别加入20%乙醇定容至5.0 mL,再分别滴加3.0 mL AlCl3溶液显色,最后用蒸馏水定容至10.0 mL,摇匀,在417 nm波长处测定吸光度,以芦丁质量浓度ρ为横坐标,吸光度A为纵坐标绘制标准曲线。其回归方程为:A=1.847 1ρ+0.006 8(R2=0.999 2)。
1.3.2 芦笋黄酮提取工艺
新鲜芦笋经干燥、粉碎,然后纤维素酶水解,乙醇溶剂回流提取,取上清液,分离定容,采用AlCl3显色法测定芦笋黄酮的含量,按式(1)计算芦笋黄酮得率。

式中:m1为黄酮的质量/g;m2为样品的质量/g。
1.3.3 单因素试验
准确称取芦笋粉末2.0 g,用乙醇溶液溶解,通过改变液料比、纤维素酶添加量、酶解时间、酶解温度、乙醇溶液体积分数、溶液pH值,进行单因素试验,根据提取液中黄酮含量,确定出各因素试验的最佳值。
1.3.4 优化试验
固定酶解温度50 ℃、溶液pH 5.0,选取液料比、酶添加量、酶解时间、乙醇体积分数4个因素,以芦笋黄酮得率为评价指标进行优化试验,试验结果采用响应面法进行分析,以获得提取芦笋黄酮的最佳条件[19-20]。响应面的因素水平见表1。

表 1 响应面试验因素水平Table 1 Factors and levels used in response surface analysis
1.3.5 芦笋黄酮体外抗氧化实验
1.3.5.1 清除羟自由基的测定
参照靳菊清等[21]的方法,称取纯化后浓缩干燥的芦笋黄酮10.0 mg,配制成20、40、60、80、100 μg/mL的溶液,在10 mL比色管中依次加入pH 7.4磷酸缓冲液1.0 mL,4.0 mmol/L EDTA-Na2-Fe2+1.00 mL,0.55 mg/mL番红0.5 mL,3.20 mmol/L H2O21.0 mL,样液加入6.5 mL。空白组不加入样液,对照组不加入EDTANa2-Fe2+溶液,加入蒸馏水定容至10.0mL。各组反应体系建立后充分混匀,在35 ℃条件水浴中恒温20 min,在520 nm波长处测定其吸光度。以VC溶液作为其抗氧化性的对照实验。按式(2)计算羟自由基清除率。
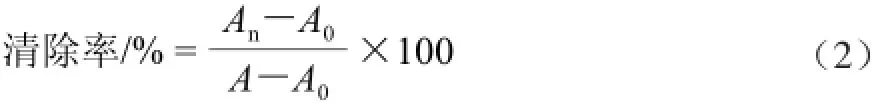
式中:A为对照组吸光度;A0为空白组吸光度;An为实验组吸光度。
1.3.5.2 清除超氧阴离子自由基的测定
参照刘文颖等[22]的方法,称取纯化后浓缩干燥的芦笋黄酮10.0 mg,配制成20、40、60、80、100 μg/mL的溶液,将0.05 mol/L Tris-HC1溶液4.5 mL置于25 ℃条件水浴中加热20 min后,加入1.0 mL双蒸馏水,水浴平衡20 min后,再加入25 mmol/L邻苯三酚溶液0.4 mL,迅速混匀,混匀立即于波长325 nm处测定吸光度,每30 s测定1次吸光度,共测240 s,计算邻苯三酚的自氧化速率A0,测定加入样液的邻苯三酚自氧化速率Aj,以双蒸馏水代替邻苯三酚,做空白实验。以VC溶液作为其抗氧化性的对照实验。按式(3)计算超氧阴离子自由基清除率。
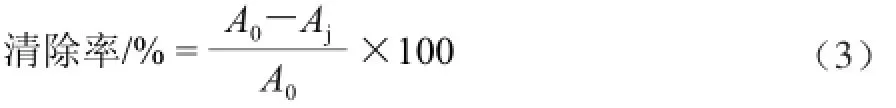
1.3.5.3 超氧化物歧化酶(superoxide dismutase,SOD)活力的测定
参照崔京伟等[23]的方法,小鼠摘除眼球,眼眶取血,将血液取至已加入肝素钠溶液的离心管中,4 000 r/min离心15 min,分离血清,取小鼠血清30 μL,加入不同质量浓度的芦笋黄酮于试管中混匀,37 ℃条件下水浴2 h,使其充分氧化。将试管在漩涡混匀器充分混匀,室温放置10 min,在550 nm波长处测各管吸光度,按式(4)计算SOD活力。式中:A0为对照管吸光度;Aj为测定管吸光度;N为反应体系的稀释倍数。

1.3.5.4 丙二醛(malondialdehyde,MDA)含量的测定参照庞中磊等[24]的方法,取小鼠血清液0.1 mL,加入不同质量浓度的芦笋黄酮于试管中混匀,37 ℃条件下水浴2 h,测定小鼠血清中MDA含量。将试剂混匀,
95 ℃条件下水浴40 min,取出后流水冷却,在532 nm波长处测各管吸光度。0

式中:Ai为测定管吸光度;Ai0为测定空白管吸光度;Aj为标准管吸光度;Aj0为标准空白管吸光度;ρ0为标准液质量浓度。
1.3.6 芦笋黄酮体内抗氧化实验
1.3.6.1 D-半乳糖亚急性衰老小鼠模型的建立[22]
将体质量为(20±2)g健康成年小鼠,适应性饲养7 d,动物在整个实验过程中饲养于温度恒定在23~25 ℃的动物房内,并能自由取食和饮水,饲料为同济医学院动物房提供,水为自来水。一周后,将小鼠随机分为5组,分别为模型对照组、空白对照组、芦笋黄酮低、中、高剂量组。除空白对照组外,其余各组每天颈背部皮下注射D-半乳糖溶液(0.1 g/kg),空白对照组注射同等剂量生理盐水,低、中、高剂量组每天分别按100、200、400 mg/kg剂量灌胃,空白对照组和模型对照组每天用同等剂量的蒸馏水灌胃,连续注射、灌胃40 d。
1.3.6.2 样液的制备
小鼠在末次给药、注射12 h后,摘除眼球,眼眶取血,将血液取至已加入肝素钠溶液的离心管中,4 000 r/min离心15 min,分离血清,随即将小鼠脱颈处死,解剖取其肝组织,在冰冷的生理盐 水中漂洗,除去残留血液,滤纸吸干水分并称质量,冰浴条件下匀浆,制成1%的悬浮液,离心,取其上清液备用。
1.3.6.3 超氧化物歧化酶活力的测定
参照崔京伟等[23]的方法,测定小鼠血清和肝组织超氧化物歧化酶活力。
1.3.6.4 MDA含量的测定
参照杨国强等[25]的方法,测定小鼠血清和肝组织MDA含量。
2 结果与分析
2.1 单因素试验
2.1.1 液料比对芦笋黄酮得率的影响

图1 液料比对芦笋黄酮得率的影响Fig.1 Effect of liquid/material ratio on the yield of flavonoids
准确称取芦笋粉2.0 g,按照液料比为20∶1、30∶1、40∶1、50∶1、60∶1(mL/g)依次添加0.2%的纤维素酶且调pH 5.0的20%乙醇水溶液,充分振荡摇匀,50 ℃条件下恒温水浴水解2 h,沸水浴中灭活8 min,冷却,离心,吸取上清液,定容测定其吸光度A。由图1可以看出,芦笋黄酮得率随着提取液用量的增加而升高,在50∶1(mL/g)时上升趋势减缓,随后基本平衡,说明一定比例的溶剂已将有效成分基本溶出,故选择液料比为50∶1(mL/g)。
2.1.2 酶添加量对芦笋黄酮得率的影响

图2 酶添加量对芦笋黄酮得率的影响Fig.2 Effect of enzyme dose on the yield of flavonoids
固定液料比50∶1(mL/g),依次精确加入0.1%、0.2%、0.3%、0.4%、0.5%纤维素酶。从图2可以看出,纤维素酶含量从0.1%~0.2%时,得率逐步增大, 酶添加量继续增加,芦笋黄酮得率并没有增加,因此选择酶添加量为0.2%。
2.1.3 酶解温度对芦笋黄酮得率的影响

图3 酶解温度对芦笋黄酮得率的影响Fig.3 Effect of hydrolysis temperature on the yield of flavonoids
由图3可知,酶解温度在20~50 ℃间,芦笋黄酮得率随着温度升高而增大,当温度大于50 ℃时,得率快速下降。温度升高,分子运动速度加快,渗透扩散,溶解速度加快,同时温度可引起细胞膜结构的变化,使黄酮类化合物由芦笋的植物细胞扩散到溶液中,但是过高温度可引起蛋白质变性,纤维素酶活性降低,导致其得率降低。因此,最佳温度选择50 ℃。
2.1.4 pH值对芦笋黄酮得率的影响

图4 pH值对芦笋黄酮得率的影响Fig.4 Effect of hydrolysis pH on the yield of flavonoids
由图4可知,当提取溶液pH值在3.5~5.0范围时,芦笋黄酮得率随pH值升高而增大。随后,pH值升高得率降低。在pH 5.0时,芦笋黄酮的得率最大。这是由于pH值增加,纤维素酶的活性逐步增强,在pH 5.0左右,酶的活性达到最佳,其后随pH值增加而酶的活性降低,因此选择最佳pH 5.0为宜。
2.1.5 乙醇体积分数对芦笋黄酮得率的影响
由图5可以看出,乙醇体积分数增加,芦笋黄酮得率增大,当乙醇体积分数达到40%时,芦笋黄酮得率最大,但超过40%后,芦笋黄酮得率有所下降,这是由于一些醇溶性杂质、色素等成分溶出量增加,体积分数过高使得纤维素酶的活力降低,从而导致黄酮得率下降,故乙醇体积分数选择40%。
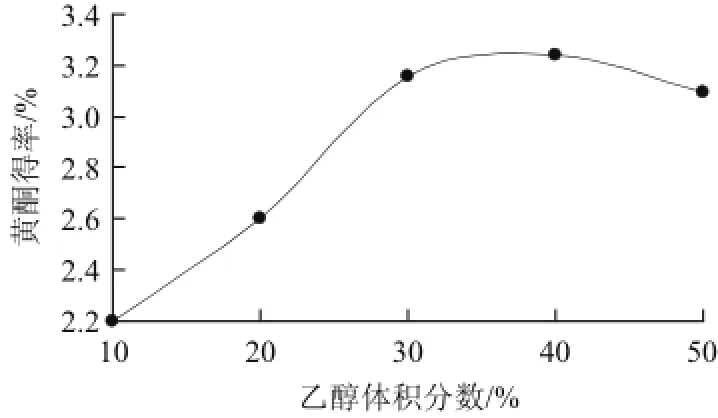
图5 乙醇体积分数对芦笋黄酮得率的影响Fig.5 Effect of ethanol concentration on the yield of flavonoids
2.1.6 酶解时间对芦笋黄酮得率的影响

图6 酶解时间对芦笋黄酮得率的影响Fig.6 Effect of hydrolysis time on the yield of flavonoids
由图6可以看出,芦笋黄酮的得率在1 h较低,在1~2 h之间,随时间的延长而增大,2 h明显增加,在2 h之后得率增长缓慢,说明当提取到一定的时间时,芦笋中黄酮类化合物基本全部溶出,从时间效益来考虑确定酶解时间确定为2 h。
2.2 芦笋黄酮类化合物提取的响应面分析
2.2.1 响应面试验
根据表2试验结果,经回归拟合后,各试验因子对响应值的影响可通过以下回归方程表示:
由表3可知,各因素影响程度从大到小依次为:酶解时间X3>乙醇体积分数X4>液料比X1>酶添加量X2。二次项X1X4对Y值的影响显著(P<0.1),说明该回归模型不是简单的线性关系,各因素之间具有一定的交互作用,回归模型得到F1=8.49,相应的概率值0.000 34,失拟性检验分析得相应的概率为0.000 45,说明该方程的模型拟合程度很好,无失拟性因素存在,回归模型与实测值能较好地拟和。对回归方程可信度进行分析,见表4,相关系数R2=90.83%,表明该模型拟合较好,并且该实验Y的变异系数较低,为3.28%,说明该模型的可靠性良好。

表 2 响应面试验设计与结果Table 2 Experimental design and results for response surface analysis

表 3 回归方程的方差分析Table 3 Analysis of variance for the regression equation
根据所建立的数学模型结合SAS软件给出的最大响应面值对应的X的编码值X1=0.012,X2=-0.028, X3=0.26,X4=-0.028,通过对编码值进行换算,得液料比50.61∶1(mL/g)、酶添加量0.19%、酶解时间1.49 h、乙醇体积分数38.90%,代入回归方程计算得到芦笋黄酮得率4.02%。

表 4 回归模型可信度分析Table 4 Reliability analysis of the regression model
2.2.2 验证实验
为了检验模型预测的准确性,在上述优化条件下共重复4次平行验证实验,同时考虑到实际操作的便利,以液料比50∶1(mL/g)、酶添加量0.2%、乙醇体积分数38.90%、酶解时间1.5 h、酶解温度50 ℃、pH 5.0进行实验,芦笋黄酮得率平均值为3.99%,与理论预测值相近,在误差允许的范围内,该模型拟合效果较好,故采用响应面法可以得到准确可靠的工艺参数。
2.3 芦笋黄酮的抗氧化活性

图7 芦笋黄酮对羟自由基的清除能力Fig.7 Scavenging activity of asparagus flavonoids on hydroxyl free radicals
由图7可看出,高质量浓度的VC对羟自由基的清除率达到60%左右,芦笋黄酮对羟自由基的有一定的清除作用,当样品质量浓度达到100 μg/mL时,芦笋黄酮对羟自由基的清除率达到46.08%。
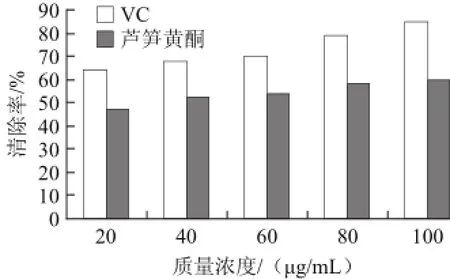
图8 芦笋黄酮对超氧阴离子自由基的清除能力Fig.8 Scavenging activity of asparagus flavonoids on superoxide anion free radicals
由图8可看出,当VC质量浓度为60 μg/mL时,对超氧阴离子自由基的清除率为84.73%,芦笋黄酮均对超氧阴离子自由基有一定的清除作用,且随着质量浓度的增加清除率在不断上升,在实验质量浓度内都呈现了较好的量效关系,当样品质量浓度达到100 μg/mL时,芦笋黄酮对超氧阴离子自由基的清除率达到59.42%。

图9 芦笋黄酮对体外小鼠血清超氧化物歧化酶(SOD)活力的影响Fig.9 Effect of asparagus flavonoids on SOD activity in mouse serum
由图9可见,不同质量浓度芦笋黄酮对小鼠血清SOD活力有提高作用,5、10、20 μg/mL芦笋黄酮处理组小鼠血清SOD的活力相对于空白对照组提高0.52%、5.93%、16.85%。
芦笋黄酮降低了小鼠血清中的MDA含量,当样品质量浓度为20 μg/mL时,芦笋黄酮使小鼠血清中的MDA含量降低2.49%。

图10 芦笋黄酮对小鼠血清和肝组织SOD活力的影响Fig.10 Effect of asparagus flavonoids on SOD activity in mouse serum and liver tissue

图11 芦笋黄酮对小鼠血清和肝组织MDA含量的影响Fig.11 Effect of asparagus flavonoids on the content of MDA in mouse serum and liver tissue
由图10可知,芦笋黄酮低剂量组、中剂量、高剂量组对小鼠血清中SOD活性相对于模型对照组分别提高3.33%、14.98、11.69%;芦笋黄酮低剂量组、中剂量、高剂量组对小鼠肝脏组织液中SOD活性相对于模型对照组提高11.58%、24.51%、27.62%
由图11可见,芦笋黄酮低剂量、中剂量组、高剂量组小鼠血清MDA含量相对于模型对照组降低分别为17.15%、30.01%、38.04%。芦笋黄酮低剂量、中剂量组、高剂量组小鼠肝组织MDA含量相对于模型对照组降低分别为10.60%、17.61%、37.95%。
3 结 论
先经单因素试验初步确定影响因素,再用响应面法建立二次回归模型,确定出芦笋黄酮的最佳提取工艺为液料比50∶1(mL/g)、酶添加量0.2%、乙醇体积分数38.90%、酶解时间1.5 h、酶解温度50 ℃、pH 5.0,总黄酮得率平均值为3.99%。当样品质量浓度达到100 μg/mL时,芦笋黄酮对羟自由基的清除率分别为46.08%;当样品质量浓度达到100 μg/mL时,芦笋黄酮对超氧阴离子自由基的清除率分别59.42%;测定血清中SOD活力和MDA含量。结果表明芦笋黄酮能提高小鼠血清中SOD活力,减少MDA含量。采用D-半乳糖法建立小鼠亚急性衰老模型,测定小鼠血清和肝组织液中SOD活力和MDA含量,结果表明芦笋黄酮能提高小鼠血清和肝组织液中SOD活性,有效地减少MDA含量,具有较强的抗脂质过氧化的能力。
[1] 顾关云, 蒋昱. 芦笋的化学成分和生物活性[J]. 国外医药: 植物药分册, 2007, 22(2): 47-50.
[2] LOPEZ G, ROS G, RINCON F, et al. Amino acids and in vitro protein digestibility changes in green asparagus (Asparagus officinalis, L.) during growth and processing[J]. Food Researeh International, 1996, 29(7): 617-625.
[3] 鞠玉栋. 芦笋的化学成分及其药理作用[J]. 中国园艺文摘, 2011(2): 125-126.
[4] 孙春艳, 赵伯涛, 郁志芳, 等. 芦笋的化学成分及药理作用研究进展[J]. 中国野生植物资源, 2004, 23(5): 1-5.
[5] 王建梅, 孙涛. 芦笋中黄酮类物质的分析方法研究[J]. 中国食物与营养, 2003, 9(8): 39-40.
[6] 刘树兴, 齐香君, 庞振, 等. 芦笋中芦丁的提取及鉴定[J]. 食品工业科技, 2001, 22(4): 39-41.
[7] MAKRIS P D, ROSSITER J T. Domestic processing of onion bulbs (Allium cepa) and asparagus spears (Asparagus off i cinalis): effect on fl avonol content and antioxidant status[J]. Journal of Agricultural and Food Chemistry, 2001, 49(7): 3216-3222.
[8] 李永琴, 杨勤, 张静, 等. 黔园九号芦笋抗小鼠肿瘤作用及毒性研究[J].贵阳医学院学报, 1995, 20(1): 21-23.
[9] 魏丽娜. 芦笋老茎中黄酮类物质的提取分离与纯化研究[D]. 西安:陕西科技大学, 2012.
[10] 宋佳. 芦笋废弃物中黄酮化合物的纯化及性质研究[D]. 无锡: 江南大学, 2012.
[11] 范小华, 郭清坤, 吴锦文, 等. 酸性乙醇提取芦笋下脚料黄酮的工艺研究[J]. 福建轻纺, 2010(6): 32-35.
[12] 王欣. 诸葛菜总黄酮提取、纯化及抗氧化性研究[D]. 杨凌: 西北农林科技大学, 2008.
[13] 李化. 超声技术在中草药成分提取中的应用[J]. 中药材, 2001, 24(4): 299-303.
[14] FANG Yunzhong, YANG Sheng, WU Guoyao. Free radicals, antioxidants, and nutrition[J]. Nutrition, 2002, 18(10): 872-879.
[15] JACOB R A, BURRI B J. Oxidative damage and defense[J]. American Journal of Clinical Nutrition, 1996, 63: 985-990.
[16] KELLY F J. Use of antioxidants in the prevention and treatment of disease[J]. Journal of International Food Chemistry, 1998, 10: 21-23.
[17] MIDDLETON E, KANDASWMI C, THEOHARIDES T C. The effects plant flavonoids on mammalian cells: implications for inf l ammation, heart disease, and cancer[J]. Pharmacological Reviews, 2000, 52: 673-781.
[18] 黄利华, 刘欣, 陈永泉, 等. 荸荠总黄酮的提取方法对比及抗氧化活性研究[J]. 食品科技, 2009, 34(5): 191-195.
[19] 汪远征, 徐雅静. SAS软件与统计应用教程[M]. 北京: 机械工业出版社, 2007.
[20] 潘丽军, 陈锦权. 试验设计与数据处理[M]. 南京: 东南大学出版社, 2008. [21] 靳菊清, 丁冬宁, 边晓丽. 银杏叶多糖的化学及清除羟基自由基作用[J]. 西安医科大学学报, 2000, 21(5): 417-419.
[22] 刘文颖, 林峰, 金振涛, 等. 玉米低聚肽的体外抗氧化作用[J]. 食品科学, 2011, 32(5): 22-26.
[23] 崔京伟, 常元勋. 大鼠血清和某些器官超氧化物歧化酶活力的测定方法[J]. 毒理学杂志, 2007, 21(3): 233-235.
[24] 庞中磊, 唐文. 柚皮中活性物质的抗氧化性活性物质研究[J]. 食品工业, 2012, 33(2): 86-90.
[25] 刘国强, 杨加文, 安利国. 芦笋黄酮对D-半乳糖衰老小鼠大脑皮层SOD、MDA的影响[J]. 科学信息: 学术研究, 2008(2): 119-120.
Extraction and Antioxidant Activity of Asparagus Flavonoids
DONG Xiao-yuan1, FANG Dong-fen2, YANG Mei1, ZHU Yi-ting1, WU Zhou-he1,*
(1. College of Bioengineering, Hubei University of Technology, Wuhan 430068, China; 2. Health Inspection and Supervision Bureau, Health Department of Hubei Province, Wuhan 430070, China)
The present study was carried out to obtain the optimal process conditions for extracting the maximum amount of flavonoids from asparagus. For the extraction of flavonoids, dried and powdered asparagus was refluxed with aqueous ethanol following hydrolysis with cellulase. Various process parameters were optimized by response surface methodology. Results indicated that the optimal extraction conditions were enzymatic hydrolysis at an enzyme dose of 0.20% for 1.5 h at pH 5.0 followed by refluxing with 38.90% ethanol at a solvent-to-solid ratio of 50:1 (mL/g). Under these conditions, the maximum extraction yield of flavonoids from asparagus was 3.99%. The flavonoids extracted from asparagus at the concentration of 100 μg/mL were able to scavenge 46.08% hydroxyl radical and 59.42% superoxide anion radical. In vitro antioxidant tests showed that treatment with concentration of 20 μg/mL flavonoids resulted in a 16.85% increase in superoxide dismutase (SOD) activity and a 2.49% reduction in malondialdehyde (MDA) content of mouse serum. SOD activity in serum and liver tissue homogenate supernatant from D-galactose induced mouse aging model was increased by 11.69% and 27.62% as a result of this treatment, and MDA content was reduced by 38.04% and 37.95%, respectively.
asparagus; flavonoid; extraction; antioxidant activity
TS201.2
A
1002-6630(2014)06-0017-07
10.7506/spkx1002-6630-201406004
2012-09-13
湖北省自然科学基金项目(2010CDB02506)
董孝元(1988—),男,硕士,主要从事食品生物与活性成分研究。E-mail:674089612@qq.com
*通信作者:吴周和(1961—),男,教授,学士,主要从事天然产物化学研究。E-mail:wuzhouhe@mail.hbut.edu.cn
