响应面法优化酶法提取芋头淀粉工艺参数
2014-02-27姜绍通殷嘉忆王华林姜苏薇
姜绍通,殷嘉忆,王华林,姜苏薇,郑 娟
(合肥工业大学农产品加工研究院,安徽省农产品精深加工重点实验室,安徽 合肥 2300 09)
响应面法优化酶法提取芋头淀粉工艺参数
姜绍通,殷嘉忆,王华林,姜苏薇,郑 娟
(合肥工业大学农产品加工研究院,安徽省农产品精深加工重点实验室,安徽 合肥 2300 09)
采用碱性蛋白酶 作为蛋白质酶解剂,对提取芋头淀粉的工艺进行研究。在单因素试验基础上,采用响应面设计优化提取芋头淀粉的工艺参数。结果表明:芋头淀粉酶法提取的最佳工艺参数为酶解时间137 min、酶用量0.9%、酶解温度41 ℃、pH 10,在 此条件下芋头淀粉的实际提取率达88.92%。碱性蛋白酶法制得的芋头淀粉主要理化指标为蛋白质含量0.08%、白度94.45%、平均粒径1.23 μm。扫描电子显微镜图显示该提取方法未对淀粉颗粒造成损伤。
芋头;淀粉;碱性蛋白酶;提取;响应面法
芋头(Colocasia esculenta (L.)Schott)别名芋魁,俗称芋艿,属天南星科草本植物[1]。芋头在我国种植范围广,但其深加工开发程度远不及甘薯、马铃薯等根茎类农作物[2]。芋头块茎中含水量高,不易贮藏,据报道平均30%的芋头在储存过程中腐烂[3],造成了极大的资源浪费。因此对芋头进行深加工十分必要。
芋头块茎中含有大量淀粉[4],这些淀粉颗粒非常细小,不同品种的芋头淀粉粒径分布在1.5~10 øm之间[5-7],是理想的化妆品扑粉、脂肪替代品和载体材料[8],具有良好的应用前景。目前,国内外对芋头淀粉提取主要有水提过筛法[5]、己二酸钙法[9]、稀氨水法[10],但是由于芋头淀粉被大量的黏蛋白所形成的网状结构紧紧包裹[11-12],导致这些方法的提取率均不高。
Lumdubwong[13]、LI Yue[14]等用蛋白酶法提取与大米蛋白质紧密结合的大米淀粉,获得了较高的提取率。鉴于此,考虑到芋头组织中的多酚氧化酶使其在pH 6.0~8.8范围内极易发生酶促褐变[15],本实验采用碱性蛋白酶法提取芋头淀粉,通过Box-Behnken响应面法优化提取工艺参数[16],并分析测定所得芋头淀粉的理化指标,为芋头淀粉的生产提供参考依据。
1 材料与方法
1.1 材料与试剂
芋头:莱阳孤芋,购于合肥市周谷堆农产品批发市场;碱性蛋白酶 南京庞博生物工程有限公司;氢氧化钠、盐酸、3,5-二硝基水杨酸、苯酚、酒石酸钾钠、无水硫酸铜、硫酸钾、硼酸、甲基红、溴甲酚绿(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FK-A组织捣碎机、JJ-1型数显电动搅拌器 江苏金坛市金城国盛实验仪器厂;JMS-50C胶体磨 廊坊市廊通机械有限公司;HH-2数显恒温水浴锅 国华电器有限公司;FE20实验室pH计 梅特勒-托利多仪器(上海)有限公司;CR22GⅡ超速冷冻离心机 日本Hitachi公司;DHG-9240A型电热恒温鼓风干燥箱 上海一恒科技有限公司;UDK152全自动凯氏定氮仪 意大利VELP公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器责任有限公司;SU8020场发射扫描电镜 日本日立公司;Mastersizer 2000激光粒度分析仪 英国Malvern公司。
1.3 方法
1.3.1 芋头淀粉提取
新鲜芋头去皮切丝,取200 g,按照1∶4(g/mL)的料液比加入蒸馏水,用组织捣碎机打浆后,过胶体磨3 次,置于设定温度的恒温水浴锅中并不断搅拌,用NaOH调节pH值至设定值,加入一定量的碱性蛋白酶(本实验所用碱性蛋白酶酶活为198 000 U/g)进行提取一定时间后,料液依次过80、200、325目筛,收集滤液,过滤后的滤渣加水再次过滤,反复多次至滤渣加水后上层基本澄清。提取过程中用稀酸和稀碱维持pH值恒定。将收集的滤液离心(3 000 r/min)15 min,弃上清液,用蒸馏水洗涤沉淀物,再次离心(3 000 r/min)15 min,重复洗涤3 次。将沉淀物于45 ℃热风干燥16 h,即得芋头淀粉。
1.3.2 酶法提取芋头淀粉工艺参数优化试验

表 1 单因素试验因素与水平Table 1 Factors and levels used in single factor design

表 2 响应面试验因素与水平Table 2 Factors and levels used in Box-Behnken experimental design
以提取率为考察指标,优化酶法提取芋头淀粉工艺参数的工况和试验参数如表1、2所示。固定料液比1∶4(g/mL)。
1.3.3 酶活力测定
采用GB/T 23527—2009《蛋白酶制剂》中的福林酚法。
1.3.4 淀粉含量的测定
采用GB/T 5009.9—2008《食品中淀粉的测定》酸水解法[17]。

1.3.5 理化指标测定
水分含量的测定:采用GB/T 5009.3—2010《食品中水分的测定》常压烘箱干燥法;灰分含量的测定:采用GB/T 5009.4—2010《食品中灰分的测定》灼烧质量法;脂肪含量的测定:采用GB/T 5009.6—2003《食品中脂肪的测 定》索氏抽提法;蛋白质含量的测定:采用GB/T 5009.5—2010《食品中蛋白质的测定》凯氏定氮法;白度的测定:采用GB/T 22427.6—2008《淀粉白度测定》。
1.3.6 颗粒形貌分析[18]
采用场发射扫描电镜观察芋头淀粉的颗粒形貌。取微量样品,用导电胶布固定于样品台上,按压均匀后,用洗耳球吹去多余未黏牢的淀粉。将样品台置于离子溅射喷镀仪中镀金处理,处理好的样品用场发射扫描电镜观察并拍照颗粒形貌,放大倍数20 000倍,加电压1 000 V。
1.3.7 粒度分布测定
取100mg淀粉样品分散均匀于100 mL去离子水中,然后转移至Mastersizer 2000型激光粒度分析仪的分散盒中进样分析,经计算机软件分析结果,得到样品的粒径分布数据。
2 结果与分析
2.1 单因素试验
2.1.1 酶解时间对芋头淀粉提取率的影响
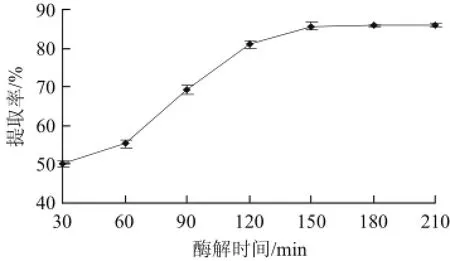
图1 酶解时间对芋头淀粉提取率的影响Fig.1 Effect o f enzymatic hydrolysis time on the extraction yield of taro starch
由图1可以看出,酶解条件为芋头200 g,料液比1∶4(g/mL)、酶用量0.9%、酶解温度40 ℃、酶解pH 10,当酶解时间在30~150 min范围时,芋头淀粉提取率随着酶解时间的延长而增加,当酶解时间大于150 min时,芋头
淀粉提取率基本保持不变。原因可能是随着酶解时间的延长,蛋白质网状结构逐渐被碱性蛋白酶破坏,对淀粉的束缚力变小[19],有利于芋头淀粉颗粒的溶出,导致芋头淀粉提取率升高。但在酶解足够的时间以后,蛋白质网状结构基本被酶解充分,酶解时间再延长,芋头淀粉提取率也不再升高。因此,适宜的酶解时间为150 min。
2.1.2 酶用量对芋头淀粉提取率的影响

图2 酶用量对芋头淀粉提取率的影响Fig.2 Effect of enzyme dosage on th e extraction yield of taro starch
由图2可以看出,酶解条件为芋头200 g、料液比1∶4(g/mL)、酶解时间150 min、酶解温度40 ℃、酶解pH 10。在一定范围内,芋头淀粉的提取率随着酶用量的增加而升高,当酶用量为0.9%时,提取率最高,之后增加碱性蛋白酶的用量,提取率反而开始下降。可能的原因是当酶浓度较低时,随着酶用量的升高,酶与底物的接触面积增大,有助于蛋白质的酶解,芋头淀粉提取率提高[20]。但当酶浓度达到过饱和时,酶与底物产生竞争,对蛋白酶产生一定的抑制作用,一部分酶分子没有与底物接触的机会,导致蛋白质酶解率降低,淀粉提取率下降[21]。因此,选择加酶量0.9%为宜。
2.1.3 酶解温度对芋头淀粉提取率的影响
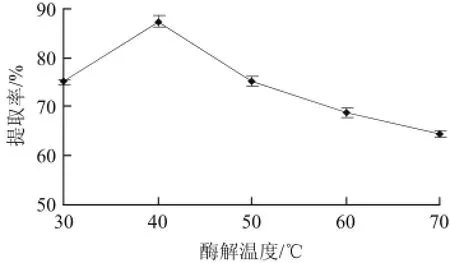
图3 酶解温度对芋头淀粉提取率的影响Fig.3 Effect of enzymatic hydrolysis temperature on the extraction yield of taro starch
适宜的温度对酶活性具有重要影响,寻找酶最适反应温度也就成为酶反应中非常关键的步骤。由图3可以看出,酶解条件为芋头200 g、料液比1∶4(g/mL)、酶解时间150 min、酶用量0.9%、酶解pH 10。温度从30 ℃升高到40 ℃,芋头淀粉提取率呈上升趋势,而当温度继续升高,淀粉提取率逐渐下降。这可能是因为,在低于酶的最适温度时,温度升高,酶反应速度加快,而当温度再升高至超过酶的最适温度时,蛋白酶逐渐开始变性,部分失去活性,降低了酶反应速度[22],结果导致了蛋白质酶解不完全,淀粉的提取率降低。因此确定最适酶解温度为40 ℃。
2.1.4 酶解pH值对芋头淀粉提取率的影响
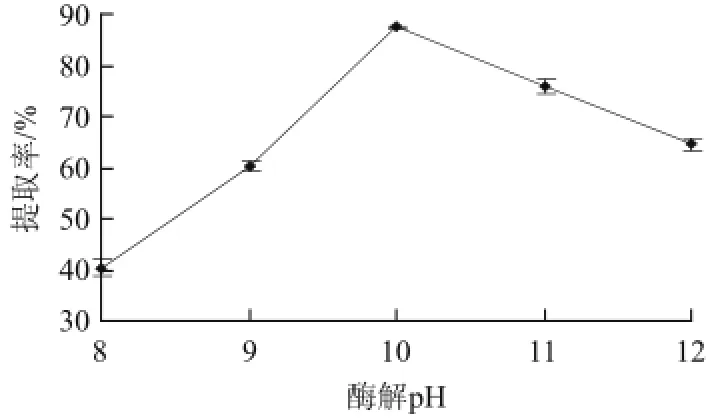
图4 酶解pH值对芋头淀粉提取率的影响Fig.4 Eff ect of enzymatic hydrolysis pH on the extraction yield of taro starch
由图4可以看出,酶解条件为芋头200 g,料液比1∶4(g/mL)、酶解时间150 min、酶用量0.9%、酶解温度40 ℃。pH值从8增加到10时,淀粉提取率逐渐提高;当pH值为10时,芋头淀粉提取率最高;而后随着pH值的增加,淀粉提取率降低。说明此碱性蛋白酶的最适pH值接近10,在pH 10附近时,蛋白酶对蛋白质的酶解效果最好,淀粉提取率也相应最高[23]。因此,适宜的pH值为10。
2.2 响应面试验设计及结果分析
2.2.1 Box-Behnken试验回归模型的建立及显著性检验

表 3 响应面试验设计与结果Table 3 Experimental design and results for response surface analysis
以淀粉提取率为响应值,利用Design-Expert软件优化芋头淀粉提取工艺参数。通过29 次试验得到芋头淀粉提取的最佳工艺条件,响应面试验设计及结果见表3。固定料液比为1∶4(g/mL)。
2.2.2 回归模型的有效性及显著性分析
利用Design-Expert 8.0软件对表3数据进行多元回归拟合,获得pH值、酶解温度、酶用量、酶解时间与芋头淀粉提取率之间的二次多项回归方程:

该模型的方差分析结果见表4。

表 4 回归方程的方差分析Table 4 Analysis of variance for the regression equation
由表4可知,回归模型极显著(P<0.000 1),失拟检验不显著,说明回归模型与实际情况拟合得很好,实验误差小,可用此模型对芋头淀粉的提取率进行分析和预测。模型中一次项X1、X2极显著,X3显著;交互项X1X3、X1X4极显著;二次项X21、X22、X23、X42均极显著。
为更直观地反映pH值与酶用量(X1X3)、pH值与酶解时间(X1X4)交互作用对芋头淀粉提取率的影响规律,分别将模型中其他两个因素固定在0水平,绘制出相应的三维曲面图,如图5、6所示。
图5表明了固定酶解温度40 ℃、酶解时间140 min时,pH值和加酶量交互作用对淀粉提取率的影响。可以看出pH值在9 ~10范围内,酶用量为芋头质量的0.6%~0.9%范围内时,两者存在着增效作用,提取率随着pH值和酶用量的增大而增加;而pH值在10~11范围内,酶用量在0.9%~1.2%范围内时,提取率随着2个因素的增大反而开始降低。

HX1)与酶用量(X3)交互作用对芋头淀粉提取率影响的响应面Fig.5 Response surface plot for the effect of pH (X1) and enzyme dosage (X3) on the extraction yield of taro starch

HX1)与酶解时间(X4)交互作用对芋头淀粉提取率影响的响应面Fig.6 Response surface plot for the effect of pH (X1) and enzymatic hydrolysis time (X4) on the extraction yield of taro starch
固定温度40 ℃、加酶量0.9%时,pH值与酶解时间交互作用对淀粉提取率的影响如图6所示。当pH值一定时,芋头淀粉提取率随着酶解时间的延长变化不明显;酶解时间一定时,提取率随着pH值的增加先升高后降低。
由Design-Expert 8.0软件分析可知,最大响应值对应的因素条件为:酶解时间137.33 min、酶用量0.89%、酶解温度40.58 ℃、pH 10.04,芋头淀粉提取率预测值为88.77%。
2.2.3 验证实验
为了验证回归模型预测值的准确性,对响应面分析得到的最佳工艺条件进行验证实验,考虑到实验的可操作性,将最佳工艺条件修正为:酶解时间137 min、酶用量0.9%、酶解温度41 ℃、pH 10,经过3 次平行重复实验,得到芋头淀粉提取率平均值为88.92%,该值落在预测值的95%预测区间[86.18, 91.35]内,说明优化得到的淀粉提取工艺条件参数准确可靠,该回归模型具有较好的预测效果。
2.3 芋头淀粉的主要理化指标由表5可知,碱性蛋白酶法制得的芋头淀粉纯度很高,其中蛋白质含量仅为0.08%,明显低于稀氨水法(蛋白质含量0.29%)[10]、水提过筛法(蛋白质含量0.53%)[5]
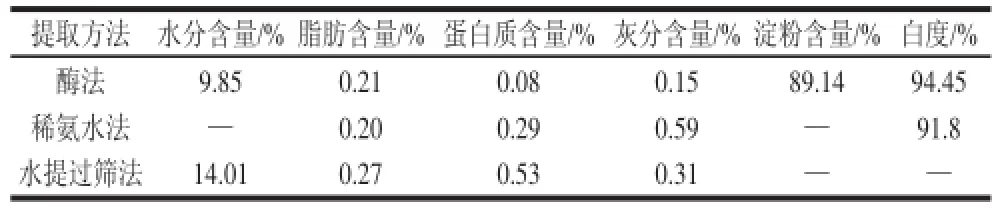
表 5 芋头淀粉的主要理化指标Table 5 Major physical and chemical indices of taro starch
等制得的芋头淀粉的蛋白质含量,有助于芋头淀粉的保藏运输。且酶法提取的芋头淀粉无需2 次除蛋白,可以直接用作要求蛋白含量在0.5%以下的变性淀粉或淀粉糖的原料[24]。碱性蛋白酶法制得的芋头淀粉白度优于稀氨水法(白度91.8%)[10],色泽洁白有光泽,具有开发成为化妆品扑粉的潜质。
2.4 芋头淀粉的颗粒性质
2.4.1 颗粒形貌分析

图7 芋头淀粉的扫描电镜图(×20 000)Fig.7 SEM images of taro starch (× 20 000)
由图7可以看出,芋头淀粉表面结构光滑、完整、无裂痕,证明用碱性蛋白酶法提取芋头淀粉,未对淀粉颗粒本身造成不良影响。而早期采用微波协同提取的方法,使得淀粉发生降解,淀粉颗粒表面出现凹坑,淀粉明显受到损伤[18,25]。芋头淀粉颗粒多为多面体形或近球形,多面体形比例较高且颗粒较大,近球形比例较小且颗粒相对较小。
2.4.2 粒度分布测定

表 6 芋头淀粉粒度分析数据Table 6 Distribution analysis of taro starch
由图8可以看出,芋头淀粉的粒度体积表现为双峰分布,第1个峰集中出现的峰值粒径为0.1 μm,第2个峰高于第1个峰,峰值粒径为1.5 øm。淀粉的体积平均粒径、表面积平均粒径、d(0.5)、d(0.9)值见表6。由表6可以看出,与其他市售淀粉如平均粒径20 øm的木薯淀粉[26]和平均粒径15 øm的玉米淀粉[26]相比,芋头淀粉平均粒径非常小,可进一步开发作为吸附载体、脂肪替代品。
3 结 论
通过响应面试验获得了酶法提取芋头淀粉的最佳工艺参数:酶解时间137 min、酶用量0.9%、酶解温度41 ℃、pH 10,该条件下芋头淀粉提取率达88.92%,建立的回归模型具有较好的预测效果。
采用最佳工艺条件制得的芋头淀粉主要理化指标为:水分含量9.85%、蛋白质含量0.08%、灰分含量0.15%、淀粉含量89.14%。制得的芋头淀粉洁白有光泽,颗粒细小,扫描电镜图显示该方法对淀粉颗粒未造成不良影响。
[1] 中科院植物研究所. 中国高等植物图鉴: 第五册[M]. 北京: 科学出版社, 1980.
[2] 戎群洁, 王鸿飞. 芋头淀粉与其他淀粉物理特性比较研究[J]. 粮油食品科技, 2007, 15(1): 48-49.
[3] ABOUBAKAR, NJINTANG Y N, SCHER J, et al. Physicochemical, thermal properties and microstructure of six varieties of taro (Colocasia esculenta L. Schott) flours and starches[J]. Journal of Food Engineering, 2008, 86(2): 294-305.
[4] LU Tingjiang, LIN Henghua, CHEN Jiaci. Characteristics of taro (Colocasia esculenta) starches planted in different seasons and their relations to the molecular structure of starch[J]. Journal of Agircultural and Food Chemistry, 2008, 56(6): 2208-2215.
[5] ELEVINA P, FORREST S S, EMPERATRIZ P D D. Characterization of some properties of starches isolated from Xanthosoma sagittifolium (Tannia) and Colocassia esculenta (Taro)[J]. Carbohydrate Polymers, 2005, 60(2): 139-145.
[6] SAMUEL S, EMMANUEL K S. Starch structure and some properties of cocoyam (Xanthosoma sagittifolium and Colocasia esculenta) starch and raphides[J]. Food Chemistry, 2002, 79(4): 435-444.
[7] 姜瑞敏, 史美丽, 陈玉珍, 等. 芋头淀粉性能及化学组成的研究[J].莱阳农学院学报, 1998, 15(2): 128-131.
[8] 刘垚, 高群玉. 小颗粒淀粉性质和应用综述[J]. 粮食与饲料工业, 2007(8): 22-23.
[9] MOORTHY S N. Extraction of starches from tuber crops us ing ammonia[J]. Carbohydrate Polymers, 1991, 16(4): 391-398.
[10] 孙忠伟. 芋头淀粉的提取及其性质的研究[D]. 无锡: 江南大学, 2004.
[11] 曹新志, 刘芳, 武玉娟, 等. 芋头淀粉性质的研究[J]. 农产品加工: 学刊, 2012(4): 57-60.
[12] 范迎菊, 陈艳丽. 芋头淀粉提取工艺及其性质的研究[J]. 山东农业科学, 2004(5): 48-61.
[13] LUMDUBWONG N, SEIB P A. Rice starch isolation by alkaline protease digestion of wet-miled rice flour[J]. Journal of Cereal Science, 2000, 31: 63-74.
[14] LI Yue, SHOEMAKER C F, MA Jianguo. Effects of Alcalase/ Protease N treatment on rice starch isolation and their effects on its properties[J]. Food Chemistry, 2009, 114(3): 821-828.
[15] 何士敏, 严德兵, 李昌满, 等. 芋中多酚氧化酶的某些催化特性检测[J]. 植物生理学通讯, 2006, 42(6): 1173-1175.
[16] MONTGOMERY D C. Design and analysis of experiments[M]. New York: John Wiley and Sons, 2005.
[17] 伟宁. 大米淀粉的酶法提取及米淀粉微球的制备工艺研究[D]. 哈尔滨: 哈尔滨商业大学, 2010.
[18] 刘婷婷, 宋春春, 王大为. 微波辅助提取马铃薯淀粉及其特性研究[J]. 食品科学, 2013, 34(6): 106-111.
[19] 李大峰, 贾冬英, 姚开, 等. 白芷淀粉的提取工艺研究[J]. 现代食品科技, 2011, 27(2): 203-205.
[20] 马娇, 陶海腾, 徐同成, 等. 响应面法优化超声波辅助水酶法提取小麦胚芽油的研究[J]. 中国粮油学报, 2013, 28(12): 57-62.
[21] 韩伟, 马婉婉, 骆开荣. 酶法提取技术及其应用[J]. 机电信息, 2010(17): 15-18.
[22] 陈潇逸, 王超, 张帆, 等. 微波预处理水酶法提取杨梅核仁油的研究[J].中国粮油学报, 2013, 28(11): 37-40.
[23] 李志忠, 徐娜, 任海伟, 等. 酶法提取白酒丢糟中蛋白质的工艺研究[J].农业机械, 2013(35): 45-48.
[24] 张燕萍. 变性淀粉制造与应用[M]. 北京: 化学工业出版社, 2001.
[25] 罗志刚. 微波对马铃薯淀粉性质的影响[J]. 食品与发酵工业, 2007, 33(4): 50-52.
[26] 沈钟苏, 陈全斌, 湛志华. 荔浦芋淀粉的理化性质研究[J]. 食品科学, 2005, 26(11): 72-75.
Optimization of Enzymatic Extraction Parameters for Taro Starch
JIANG Shao-tong, YIN Jia-yi, WANG Hua-lin, JIANG Su-wei, ZHENG Juan
(Key Laboratory for Agriculture Processing Product of Anhui Province, Institute of Agricultural Products Proc e ssing Technology, Hefei University of Technology, Hefei 230009, China)
Taro starch is wrapped around taro protein, thus leading to low extraction yield of taro starch. In the present study, the extraction of taro starch was investigated by using alkaline protease to hydrolyze taro protein. Based on single factor experiments, various process parameters were opt imized by response surface methodology. The results revealed that the optimum hydrolysis parameters for enzymatic extra ction of taro starch were determined as pH 10, 41 ℃, 137 min and an enzyme dose of 0.9%. The experimentally observed maximum yield of ta ro starch under these con ditions was 88.92%. Physicochemical analyses showed that the taro starch obt ained exhibited a protein content of 0.08%, a whiteness of 94.45% and an average particle size of 1.23 μm. Scanning electron microscopy observation indicated that the extraction process did not damage starch granules.
taro; starch; alkaline protease; extraction; response surface methodology
TS235.9
A
1002-6630(2014)06-0024-06
10.7506/spkx1002-6630-201406005
2013-08-04
安徽省科技专项(13Z03042)
姜绍通(1954—),男,教授,本科,研究方向为农产品生物化工。E-mail:jiangshaotong@163.com
