响应面法优化长柄扁桃中苦杏仁苷的提取工艺
2014-02-25许宁侠申烨华
许宁侠,陈 邦,申烨华,*
(1.西安外事学院医学院,陕西西安710077;2.西北大学合成与天然功能分子化学教育部重点实验室,化学与材料科学学院,新药研究所,陕西西安710069)
响应面法优化长柄扁桃中苦杏仁苷的提取工艺
许宁侠1,2,陈 邦2,申烨华2,*
(1.西安外事学院医学院,陕西西安710077;2.西北大学合成与天然功能分子化学教育部重点实验室,化学与材料科学学院,新药研究所,陕西西安710069)
为了综合利用长柄扁桃,提高利用价值,本实验通过响应面实验设计,以苦杏仁苷提取率为响应值,对长柄扁桃中苦杏仁苷的提取参数进行优化。优化后的最佳工艺条件为:乙醇浓度90%,料液比1∶6g/mL,提取时间55min,苦杏仁苷的提取率为提取率为86.91%。
长柄扁桃,苦杏仁苷,响应面
长柄扁桃属蔷薇科桃属[1],具有很强的沙漠生存能力和固沙作用,在沙漠的防治方面起到了重要的作用。其种仁中化学成分丰富,有脂肪油、蛋白质、挥以油及糖苷类等。种仁压榨后的油粕中,苦杏仁苷的含量为3.7%[2],含量较为丰富。苦杏仁苷(amygdalin)广泛存在于杏、苹果、山楂等蔷薇科植物的种子中,属于芳香族氰苷分子,分子式为C20H27NO11,由一单元苯甲醛、一单元氢氰酸和两单元葡萄糖组成[3],在临床上有镇咳、平喘、抗炎、镇痛、抗肿瘤、降血糖和抗溃疡等作用[4]。目前苦杏仁苷的提取主要来自于苦杏仁等原料,本课题组对长柄扁桃中苦杏仁苷的提取尚属首次。对长柄扁桃中的苦杏仁苷进行有效的提取,即可增加苦杏仁苷的来源,还可提高长柄扁桃植株的综合利用价值。长柄扁桃植株的利用研究较多,除了植株可固沙防沙,其种仁可榨油,油粕可提取蛋白粉、苦杏仁苷,果壳可制备活性炭。所以对长柄扁桃中苦杏仁苷进行提取,可提高其利用价值和经济效益,还有助于种植区的可持续发展。在后期的研究工作中,应对苦杏仁苷的分离纯化技术进行研究,为苦杏仁苷的临床应用提供条件。
响应面分析法广泛应用于多因素间相互作用的研究,以回归方程作为函数估算的工具,研究多因子与响应值之间、因子与因子之间的相互关系,并进行优化,可在整个区域上研究因素的最佳组合[5-6]。本课题以苦杏仁苷提取率为指标,利用响应面实验优化长柄扁桃中苦杏仁苷的提取工艺。
1 材料与方法
1.1 材料与仪器
长柄扁桃种仁 榆林神木;水 为超纯水;乙醇 天津市化学试剂厂,分析纯;甲醇 西安试剂厂,色谱纯;苦杏仁苷标准品 陕西省药品生物制品检验所,含量大于98%,批号:110820-201004。
P230型高效液相色谱、UV230紫外-可见检测器、SinoChrom ODS-BP色谱柱(200mm×4.6mmi.d.,10μm)、EC2000色谱工作站 大连伊利特仪器有限公司;KQ250B型超声波清洗器 昆山禾创超声仪器有限公司;101-1AB型电热鼓风干燥箱 天津市泰斯特仪器有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;WND-100型高速中药粉碎机 浙江省兰溪市伟能达电器有限公司。
1.2 实验方法
1.2.1 苦杏仁苷的提取方法 长柄扁桃种仁干燥灭酶,粉碎后石油醚去油,抽滤,挥尽石油醚,为脱脂粕。称取脱脂粕适量,用乙醇加热回流提取,提取过程不断搅拌,提取3次,合并滤液。提取液过滤后趁热抽滤。利用HPLC对提取液中的苦杏仁苷含量进行检测[7]。
1.2.2 单因素实验 通过对苦杏仁苷的提取因素进行筛选后,乙醇浓度、料液比与提取时间对提取率影响显著,在进行响应面设计前,先分别考察乙醇浓度、料液比和提取时间对苦杏仁苷提取率的影响。
在提取过程中,以料比为1∶10,改变乙醇浓度,搅拌回流,提取90min,研究乙醇浓度(60%、70%、80%、90%、100%)对提取率的影响;以乙醇浓度为80%,提取时间为90min,研究不同料液比(1∶5、1∶10、1∶15、1∶20、1∶25g/mL)对提取率的影响;以料液比1∶10,乙醇浓度为80%,分别回流不同时间(10、30、60、90、120min),研究提取时间对提取率的影响。
1.2.3 响应面实验设计水平 在单因素实验中,通过改变乙醇浓度、料液比和提取时间,以提取液中的苦杏仁苷含量作为指标进行研究,根据Box-Benhnken的中心组合实验原理[8],每个因素选3个水平,每个因素水平分别以-1、0、+1进行编码,以提取率为响应值,实验设计见表1。

表1 响应面实验因素水平Table.1 Factors and levels of the response surface experiment
1.2.4 苦杏仁苷含量的高效液相测定 色谱条件:SinoChrom ODS-BP(200mm×4.6mm i.d.,5μm)色谱柱;UV1201紫外可见检测器,检测波长220nm;流动相为V(甲醇)∶V(水)=30∶70,流速1.0mL/min;进样量10μL。
对照品溶液的配制:准确称取苦杏仁苷标准品50.00mg于100.0mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得500μg/mL苦杏仁苷对照品溶液,使用前经0.22μm微孔滤膜滤过。
1.2.5 苦杏仁苷提取率的计算 利用HPLC对提取液的苦杏仁苷的含量进行测定,按下式计算苦杏仁苷的提取率:
提取率(%)=(提取液中苦杏仁苷含量(g/mL)×提取液体积(mL))/(脱脂粕质量(g)×脱脂粕中苦杏仁苷含量(g/g))×100
2 结果与分析
2.1 苦杏仁苷标准曲线的绘制
将苦杏仁苷对照品分别配制成浓度为50、100、150、200、250μg/mL的溶液,按色谱条件进样测定。以对照品溶液浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得回归方程为Y=4.7117X-10.124(R2=0.9993),说明在50~250μg/mL线性关系良好。
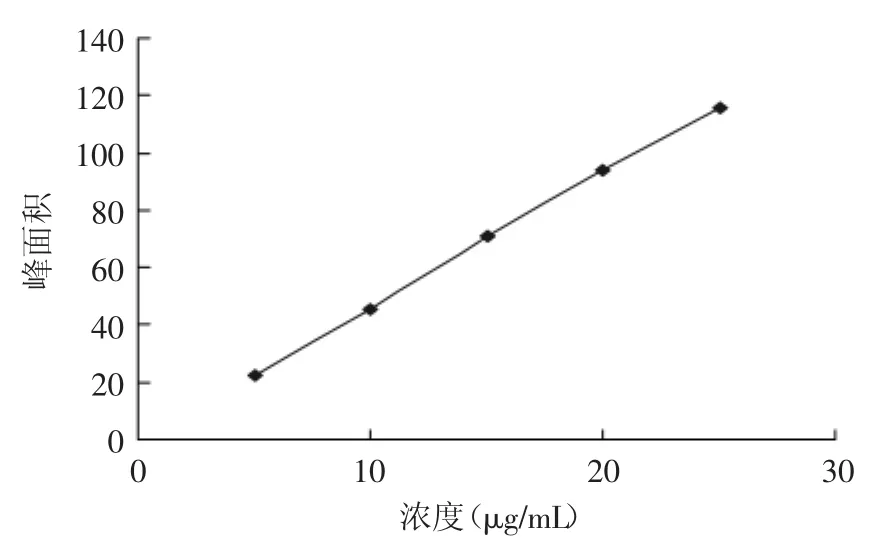
图1 苦杏仁苷标准曲线Fig.1 The standard curve of amygdalin
2.2 单因素实验结果与分析
2.2.1 乙醇浓度对提取的影响 由图2可知,当乙醇浓度为60%~80%时,苦杏仁苷的提取率随乙醇浓度的增加而增加,在80%左右达到稳定,当浓度超过80%后,提取率虽然有所增加,但增加幅度不大。原因可能是苦杏仁苷在80%乙醇时基本上已经溶出,再增加乙醇浓度对苦杏仁苷的提取率影响不大;同时考虑到乙醇浓度过大,会增加经济成本,所以选取为70%、80%、90%的乙醇浓度作为响应面分析来确定最优的提取浓度。
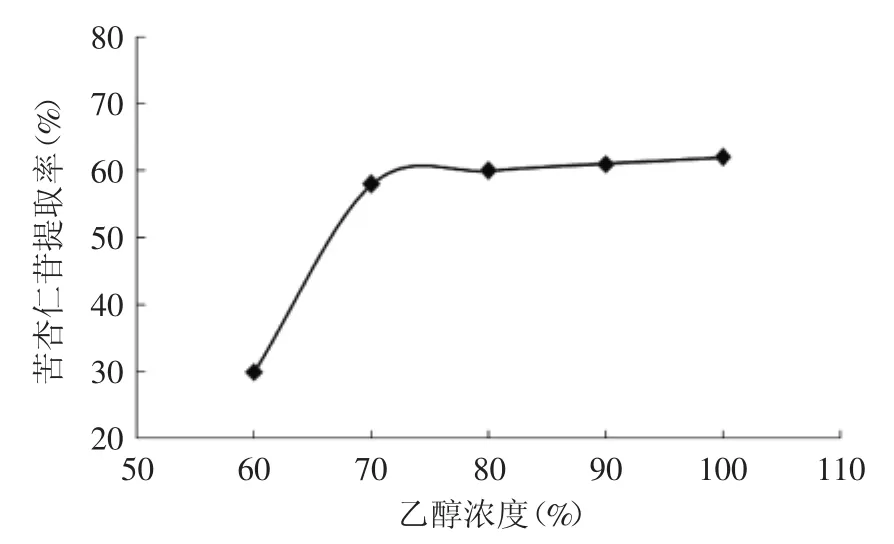
图2 乙醇浓度对提取的影响Fig.2 The effect of ethanol concentration to extraction of amygdalin
2.2.2 料液比对提取的影响 由图3可知,当料液比从1∶5增加到1∶15时,提取率也相应增加,当料液比为1∶15达到最大,当高于1∶15时,提取率反而有所下降。这是因为随着料液比的增大,浓度差提高,有利于传质,而当料液比达到1∶15后,苦杏仁苷的溶出已经基本达到了动态平衡状态,再增加料液比,溶剂量增加,还会加大溶剂回收或浓缩溶液的工作量。综合考虑,料液比选择1∶10、1∶15、1∶20作为响应面分析的条件,以确定最优的料液比。
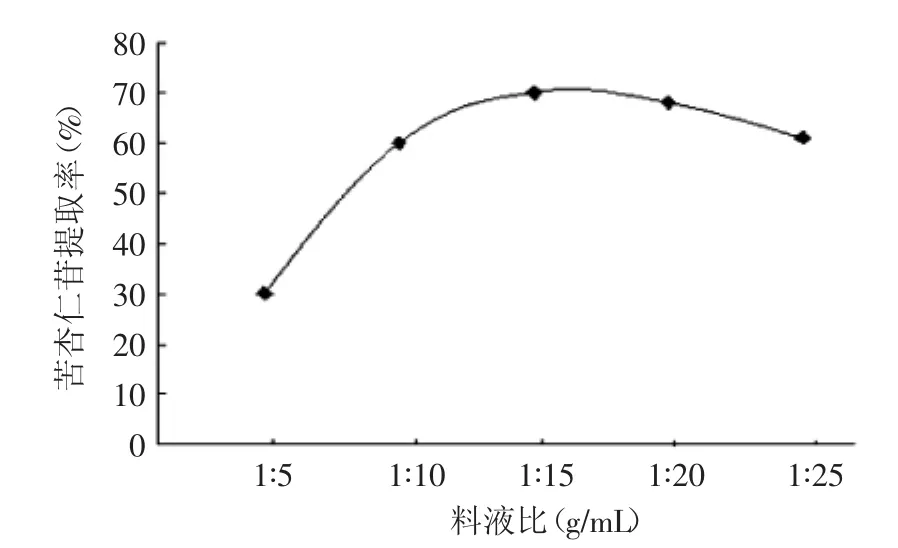
图3 料液比对提取的影响Fig.3 The effect of liquid ratio to extraction of amygdalin
2.2.3 提取时间对提取的影响 由图4可知,随着提取时间的延长,提取率也相应增加,在60min左右即可达到较高值,再延长时间,提取率有所下降,这是因为苦杏仁苷的浸出需要一定的时间,所以适当延长提取时间,提取的时间越长,提取率就越高;在60min时,溶剂与溶质之间的物料传递比较充分,提取率也相应增加;达到最大值后,再延长时间,提取率不再增加,反而会增加杂质的溶出量,同时时间延长还会增加提取成本,所以综合考虑,继续选择提取时间以30、60、90min作响应面分析以确定最优的提取时间。
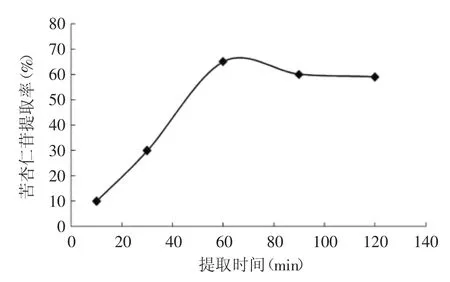
图4 时间对提取的影响Fig.4 The effect of extraction time to amygdalin
2.2 响应面实验结果
利用SAS软件进行分析结果见表2,得二次回归方程为:
Y=2.43+0.045A+0.11B+0.094C-0.025AB+0.13AC+ 0.012BC-0.089A2-0.10B2-0.15C2
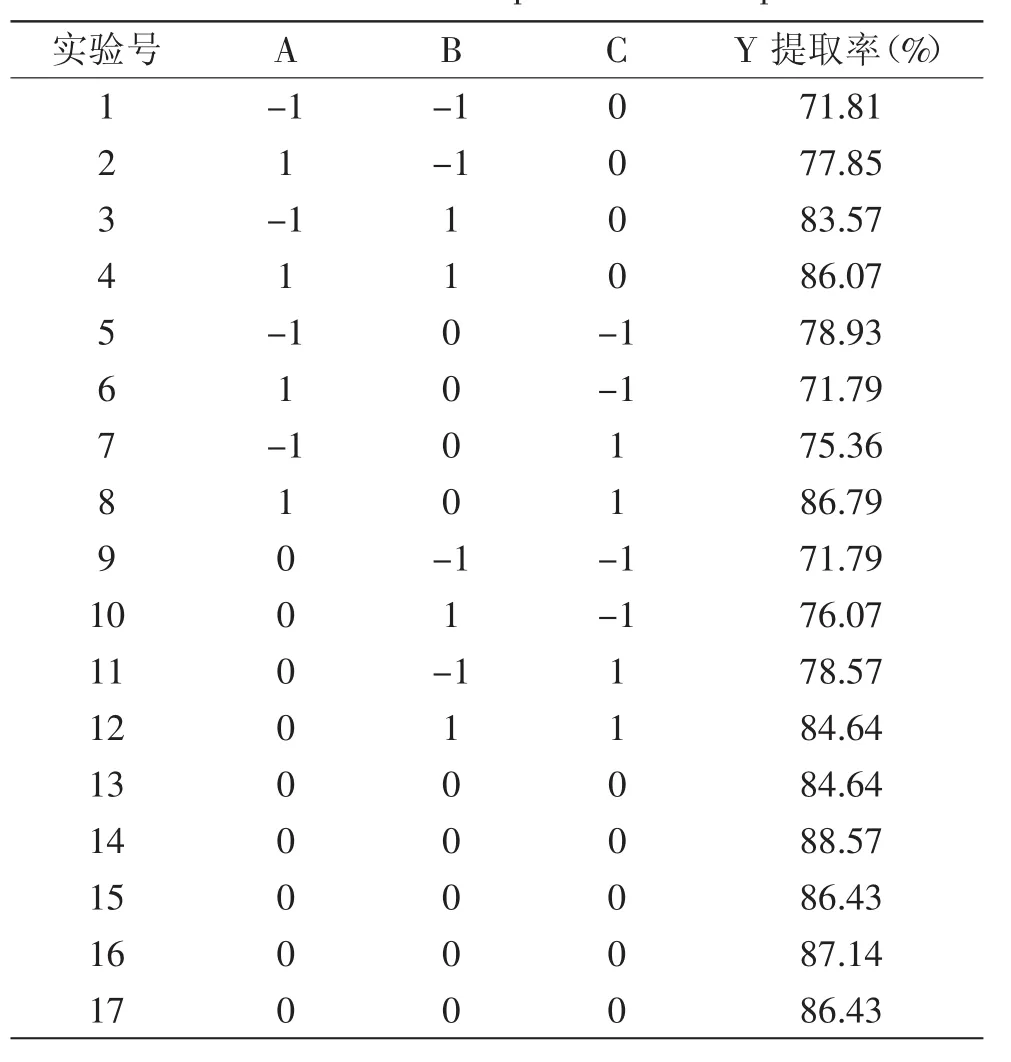
表2 响应面实验结果Table.2 Results of the response surface experiment

表3 回归方程各项的方差分析Table.3 Analysis of variance(ANOVA)for optimization of amygdalin
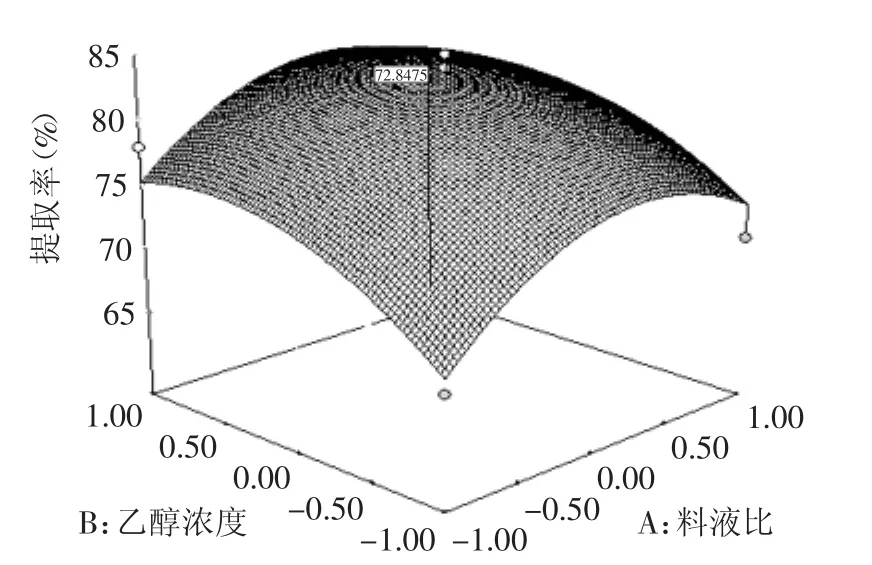
图5 乙醇浓度与料液比对苦杏仁苷的影响Fig.5 The effect of Ethanol concentration and Solid-Liquid ratio on amygdalin extraction
从表3的分析结果可以看出,整体模型的“Pro>F”值为0.0005,小于0.01,说明该二次方程模型高度显著,此模型是可靠的,模型的决定系数是95.86%,说明此模型的相关度很好,即相应值的变化有95.86%是来自于所选变量,同时CV值为0.1874,大于0.05,模型失拟项不显著,说明实际值与预测值有很好的拟合度。回归方程中各变量对指标(响应值)影响的显著性,也可由Pro>F值来判断,由表3可以看出,各因素中一次项B、C是极显著的,二次项A2、B2、C2也是极显著的,交互项AC也是极显著的,即各实验因素对响应值的影响不是简单的线性关系,二次项对响应值也有影响。由F值可知,三个因素的影响顺序为:乙醇浓度>提取时间>料液比。交互项响应曲面图见图5~图7。

图6 提取时间与料液比对苦杏仁苷的影响Fig.6 The effect of time and solid-liquid ratio on amygdalin extraction

图7 提取时间与乙醇浓度对苦杏仁苷的影响Fig.7 The effect of time and ethanol concentration on amygdalin extraction
比较响应面最高点,利用回归方程可确定苦杏仁苷的最佳提取工艺是:料液比为1∶5.9,乙醇浓度为92.0%,提取时间为54.6min,在此条件下,提取率为87.53%。
取长柄扁桃脱脂粕3份,根据实验生产条件,校正料液比为1∶6,乙醇浓度为90%,提取时间为55min,按此工艺进行提取,测得苦杏仁苷的实际提取率分别为86.42%、86.81%、87.50%,平均为86.91%,结果表明,实际提取率与理论提取率相对误差为0.71%,说明响应面法对苦杏仁苷提取工艺的优化条件是可行的。
3 结论
对长柄扁桃中苦杏仁苷进行提取,通过单因素实验及响应面设计,通过响应面分析法对乙醇浓度、料液比和提取时间进行优化,确定最佳的提取工艺条件为料液比为1∶6g/mL,乙醇浓度为90%,提取时间为55min,以此条件下提取苦杏仁苷的提取率(86.91%)与理论提取率(87.53%)相差不大,说明此工艺在实际生产中是合理可行的,也可为大生产提供理论依据。
[1]苏贵兴,姚玉卿.我国的野生扁桃资源[J].野生植物研究,1983(2):7-11.
[2]张萍,申烨华,王晓玲,等.高效液相色谱法测定长柄扁桃仁中的苦杏仁苷[J].分析实验室,2007,26(10):50-83.
[3]CHO A Y,CHUNG J,RHIM J H,et al.Detection of abnormally high amygdalin content in food by an enzyme immunoassay[J]. Molecules and Cells,2006,21(2):313-318.
[4]南京药学院.药物化学[M].北京:人民卫生出版社,1978:524.
[5]张红城,尹策,董捷,等.杏花花粉中苦杏仁苷的提取工艺的研究[J].食品科学,2007,28(7):236-241.
[6]白海波,南志成,宁子荣.杏仁提取条件探讨[J].中国现代应用药学杂志,2002,12(19):476-477.
[7]刘萍.长柄扁桃中苦杏仁苷及蛋白粉提取工艺研究[D].西安:西北大学,2010
[8]K Adinarayana,P Ellaiah.Response surface optimization of the critical medium components for the production of alkaline protease by a newly isolated Bacillus sp.[J].J Pharm Pharmaceut Sci,2002(5):272-278.
Optimization extracting process of amygdalin from Amygdalus pedunculatus pall by response surface analysis
XU Ning-Xia1,2,CHEN Bang2,SHEN Ye-hua2,*
(1.The Medicine College of Xi’an International University,Xi’an 710077,China;2.Key Laboratory of Synthetic and Natural Functional Molecule Chemistry of the Ministry Education,Institute of Drug Discovery,College of Chemistry and Materials Science,Northwest University,Xi’an 710069,China)
In order to optimize the extraction of amygdalin from Amygdalus pedunculatus pall to improve its value,the effects of operation parameters were discussed in this research.The response surface methodology was used to optimize influence of these three factors to the extraction.It indicated that the optimum conditions were as follows:the ethanol concentration of 90%,solid-liquid ratio 1∶6g/mL,extraction time 55min,the extraction percentage was 86.91%.
Amygdalus pedunculatus pall;amygdalin;response surface methodology
TS255.1
B
1002-0306(2014)04-0270-04
2013-07-18 *通讯联系人
许宁侠(1973-),女,硕士研究生,主要从事天然植物产品开发方面的研究。
