响应面法优化山稔叶总黄酮提取工艺的研究
2014-02-25吴萍萍赖曼萍尹艳艳黄儒强
吴萍萍,赖曼萍,尹艳艳,黄儒强
(华南师范大学,广东广州510631)
响应面法优化山稔叶总黄酮提取工艺的研究
吴萍萍,赖曼萍,尹艳艳,黄儒强
(华南师范大学,广东广州510631)
在提取温度、乙醇体积分数、液固比、提取时间4个单因素实验基础上,利用响应面分析法对回流法提取山稔叶总黄酮的最佳工艺进行了研究。结果表明,最优提取条件为提取温度73℃、乙醇体积分数50%、液固比19∶1(mL/g)、提取时间124min,总黄酮提取率为5.426%,与模型预测值基本相符。山稔叶总黄酮对DPPH自由基清除作用呈一定的量效关系,其半数抑制浓度为9.797μg/mL。
山稔叶,总黄酮,响应面,二苯基苦味酰基苯肼
山稔(Rhodomyrtus tomentosa(Ait.)Hassk),为桃金娘科植物,主要分布在中国、日本、泰国等东南亚地区[1]。传统医学认为,山稔叶味甘、涩,性平,可用于治疗痢疾、泄泻、极性肠胃炎、外伤出血等[2]。现代药理研究表明山稔叶提取物具有抗氧化、抑菌、消炎、保护胃肠消化系统、降血压、促进成骨细胞增长等功效[3-7]。已有研究表明山稔叶中含有黄酮类化合物[4,8],而黄酮类化合物具有广泛的生理和药理功能,是目前国内外重点研究和应用的天然植物功能性成分,被广泛应用于食品、保健品、医药、化妆品等领域。
黄酮类化合物的提取方法有很多,如水提法、有机溶剂提取法、超临界CO2萃取法、微波法、超声波法、高速逆流色谱法(HSCCC)等[9]。响应曲面法(Response Surface Methodology,RSM),是一种囊括了众多实验和统计技术的实验优化方法,它可以建立连续变量曲面模型,对实验的各个水平进行分析,确定最佳水平范围[10]。
目前,国内外对山稔叶药理活性方面的研究较多,但是有关山稔叶中总黄酮的提取鲜有报道,因此,本文对山稔叶总黄酮的提取工艺进行研究,采用乙醇回流法,用单因素实验对提取温度、乙醇体积分数、液固比、提取时间4个因素进行分析,并通过响应曲面法优化得到其最佳提取工艺,同时研究了山稔叶总黄酮对DPPH自由基的清除能力,以期为山稔叶黄酮资源的开发与综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
山稔叶 于2012年10月8日采自广东省河源市;芦丁标准品 中国药品生物制品检定所;二苯基苦味酰基苯肼(DPPH) Sigma公司;亚硝酸钠、硝酸铝、氢氧化钠、乙醇、石油醚等 均为分析纯。
DJ-10A型电动植物粉碎机 上海淀久中药机械制造有限公司;HH-4型数显恒温水浴锅 常州澳华仪器有限公司;GL-21M型高速冷冻离心机 上海市离心机械研究所有限公司;SFG-02B.600型电热恒温鼓风干燥箱 黄石市恒丰医疗器械有限公司;VIS-723N可见光光度计 北京瑞利分析仪器公司。
1.2 实验方法
1.2.1 芦丁标准曲线的绘制[11]精确称取0.0100g芦丁标准品,用乙醇溶解后定容至100mL,即得0.1000g/L芦丁标准液。分别精确吸取芦丁标准液0.0、2.0、4.0、6.0、8.0、10.0mL于6支25mL比色管中,用75%乙醇定容至10mL,加入5%亚硝酸钠溶液0.7mL,摇匀,静置5min后,加入10%硝酸铝0.7mL,摇匀,静置5min,再加入1mol/L氢氧化钠5mL,并用75%乙醇定容至25mL,摇匀,静置10min后,以芦丁空白为对照,在波长510nm处测定吸光度值。以吸光度值对芦丁质量浓度作图,绘制芦丁标准曲线,见图1。经线性回归得到方程:y=12.5x-0.001(y:吸光度,x:浓度,mg/mL),R2=0.9997。

图1 芦丁标准曲线Fig.1 Standard curve of rutin
1.2.2 材料预处理 将采摘的山稔叶晒干后,粉碎(40目)。取山稔叶粉末于索氏提取器中,用石油醚作溶剂,回流提取5h,去除叶绿素等脂类物质,将预处理后的山稔叶粉末50℃烘干,置于干燥器中保存。
1.2.3 山稔叶总黄酮的提取 准确称取预处理的山稔叶粉末1.00g,至于100mL圆底烧瓶中,加入提取剂进行回流提取,冷却,5000r/min离心10min,取上清液1mL,测定总黄酮含量。
1.2.4 山稔叶总黄酮含量的测定 准确量取已制备好的山稔叶总黄酮提取液1mL,总黄酮的提取率计算公式如下:
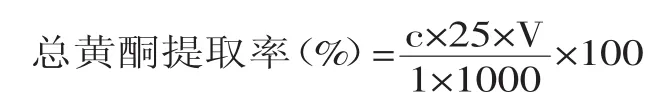
式中,c为1mL提取液定容后的芦丁含量,mg/mL;1为从提取液中吸取的体积,mL;25为1mL提取液定容后的体积,mL;V为提取总黄酮时用的乙醇体积,mL;1000为山稔叶粉质量,mg。
1.2.5 乙醇回流提取法单因素实验
1.2.5.1 提取温度 准确称取预处理的山稔叶粉末1.00g,按液固比30∶1(mL/g)加入75%乙醇水溶液,分别在40、50、60、70、80、90℃条件下,回流提取60min。
1.2.5.2 乙醇体积分数 准确称取预处理的山稔叶粉末1.00g,按液固比30∶1(mL/g)加入乙醇体积分数分别为30%、40%、50%、60%、70%、80%的乙醇水溶液,50℃回流提取60min。
1.2.5.3 液固比 准确称取预处理的山稔叶粉末1.00g,按液固比分别为5∶1、10∶1、15∶1、20∶1、25∶1、30∶1(mL/g)加入75%乙醇水溶液,50℃回流提取60min。
1.2.5.4 提取时间 准确称取预处理的山稔叶粉末1.00g,按液固比30∶1(mL/g)加入75%乙醇水溶液,50℃分别回流提取60、80、100、120、140、160min。
1.2.6 响应曲面实验 根据单因素实验结果,以提取温度、乙醇体积分数、液固比、提取时间4个因素作为响应变量,根据Box-Behnken中心组合设计建立四因素三水平数学模型,以山稔叶总黄酮的提取率为响应值,利用Design Expert 8.0.5b软件进行数据拟合,实验因素及水平见表1。

表1 响应面实验的因素和水平设计表Table.1 Factors and levels of RSM
1.2.7 山稔叶总黄酮清除DPPH自由基活性测定 量取2.0mL不同浓度(0、2、4、6、8、10、12、14、16、18、20、25、30μg/mL)的总黄酮提取液,加入2.0mL 200μmol/L DPPH(乙醇),室温放置30min后,测定反应液在517nm处的吸光度,并通过下式计算DPPH清除率[12]。
清除率(%)=[(A0-A1)/A0]×100
式中:A0为DPPH的吸光度,A1为最终反应液的吸光度。
2 结果与分析
2.1 乙醇回流提取法单因素实验结果
2.1.1 提取温度对山稔叶总黄酮提取率的影响 由图2可知,随着温度的增加,总黄酮提取率先升后降,温度在40~70℃,黄酮提取率急剧上升,70℃时达到最大值,温度继续增加时,黄酮提取率下降,并趋于平稳。这是因为在一定温度范围内,随着温度的升高,分子解附和扩散运动速度加快,从而有利于提高黄酮提取量。但是不能无限制的增大温度,太高的温度会对黄酮类化合物的稳定性有影响。所以本实验选择提取温度为70℃。
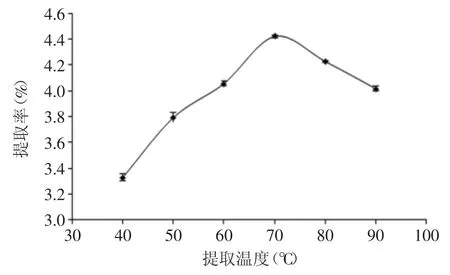
图2 提取温度对山稔叶总黄酮提取率的影响Fig.2 Effect of temperature on extraction efficiency of total flavonoids
2.1.2 乙醇体积分数对山稔叶总黄酮提取率的影响
由图3可知,当乙醇体积分数为50%时,总黄酮提取率最大。乙醇体积分数大于50%时,提取率随浓度的增加而下降。这是由于黄酮类化合物是一大类极性范围很广的物质[13],在50%乙醇溶液中,醇溶性和水溶性的总黄酮都能最大程度的溶出。而当乙醇体积分数超过50%时,溶剂极性降低,从而减少了大极性黄酮类化合物的溶出,导致总黄酮的提取率下降。所以本实验选择乙醇体积分数为50%。
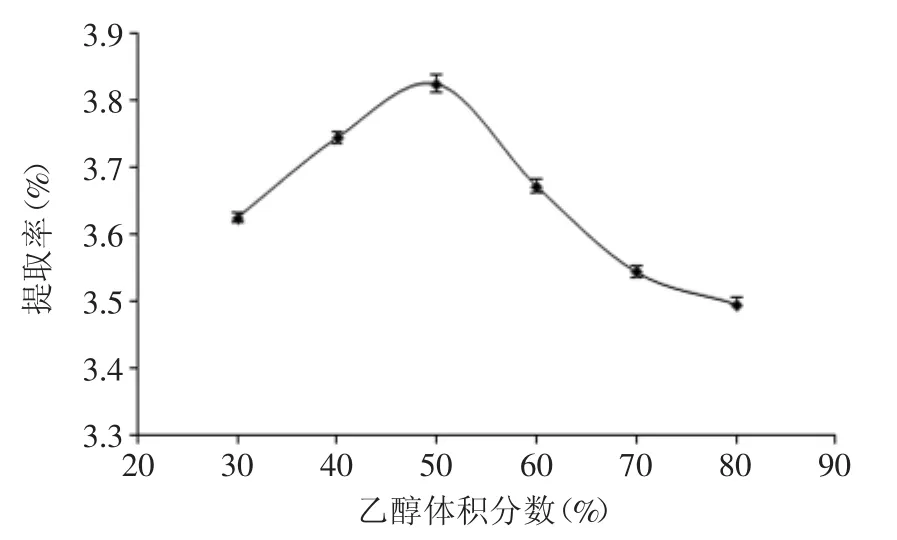
图3 乙醇体积分数对山稔叶总黄酮提取率的影响Fig.3 Effect of ethanol concentration on extraction efficiency of total flavonoids
2.1.3 液固比对山稔叶总黄酮提取率的影响 从图4可知,当液固比在5∶1~20∶1范围内时,黄酮提取率随液固比的增大而上升,液固比为20∶1时,提取率最高。之后,黄酮提取率变化不大,这可能是由于物料与溶剂边界层浓度差减小,扩散达到平衡。所以从节约溶剂的角度考虑,本实验选择液固比为20∶1。

图4 液固比对山稔叶总黄酮提取率的影响Fig.4 Effect of liquid-solid ratio on extraction efficiency of total flavonoids
2.1.4 提取时间对山稔叶总黄酮提取率的影响 由图5可知,随着提取时间的延长,山稔叶总黄酮提取率不断升高;但当提取时间超过120min后提取率开始下降。这是因为刚开始时提取时间过短,总黄酮还未充分溶出;随着提取时间的延长,总黄酮溶出量逐渐增大,提取率逐渐升高;继续延长提取时间,未溶出的总黄酮量很少,其他杂质可能增多,导致提取率下降。故本实验选择提取时间为120min。
2.2 山稔叶总黄酮提取工艺响应面优化分析
2.2.1 二次响应面回归模型的建立与分析 选用中心复合模型,做四因素三水平共29个实验点(5个中心点)的响应面分析实验,设计及结果见表2。

图5 提取时间对山稔叶总黄酮提取率的影响Fig.5 Effect of time on extraction efficiency of total flavonoids
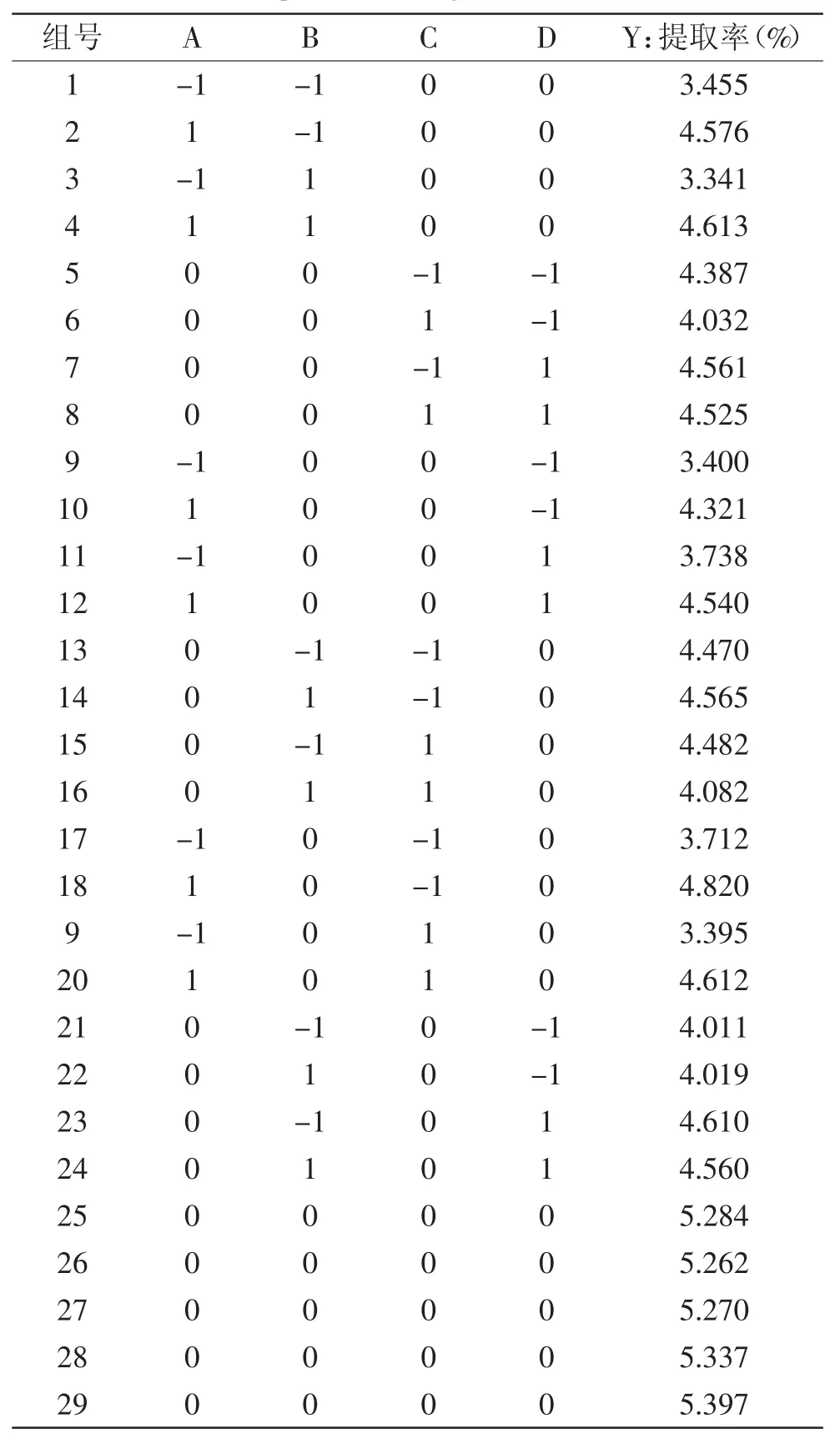
表2 响应面实验设计及结果Table.2 Experiment design and result of RSM
经回归拟合后,得到以山稔叶总黄酮提取率(Y)为响应值的回归方程:Y=5.31+0.54A-0.035B-0.12C+ 0.20D+0.038AB+0.027AC-0.030AD-0.12BC-0.015BD+ 0.080CD-0.79A2-0.51B2-0.40C2-0.52D2。
用Design Expert 8.0.5b软件对表2中的数据进行多元回归分析,其方差分析见表3。从表3可以看出,回归方程失拟检验p>0.05,差异不显著,说明未知因素对实验结果干扰很小;回归方程拟合检验p<0.0001,差异极显著,说明模型的预测值和实际值非常吻合,模型成立。同时回归方程相关系数R2=0.9856,说明响应值的变化有98.56%来源于所选变量,即乙醇体积分数、液固比、提取时间和提取温度。因此,该回归方程可以较好地描述各因素与响应值之间的真实关系,可以用其确定最佳提取工艺条件。此外,各因素中一次项A、D及二次项A2、B2、C2、D2对黄酮的提取影响极显著(p<0.001),C(液固比)对黄酮提取的影响高度显著(p<0.01);交互项BC对黄酮的提取影响显著(p<0.05);而B、AB、AC、AD、BD、CD的影响差异不显著。

表3 回归模型参数检验Table.3 Parameter estimate of regression model
2.2.2 各因子交互作用对总黄酮得率影响的分析RSM方法的图形是特定的响应面(Y)与对应的因素A、B、C、D构成的一个三维空间在二维平面上的等高图,每个响应面对其中两个因素进行分析,另外两个因素固定在零水平。从中可以直观地反映各因素对响应值的影响,从实验所得的响应面分析图上可以找到它们在提取过程中的相互作用。回归优化响应面图分别见图6~图11。

图6 提取温度和乙醇体积分数对总黄酮提取率的曲面图Fig.6 Curved surface plot and contour line for reciprocal effect of temperature and ethanol concentration on extraction efficiency of total flavonoids

图7 提取温度和液固比对总黄酮提取率的等高线图和曲面图Fig.7 Curved surface plot and contour line for reciprocal effect of temperature and liquid-solid ratio on extraction efficiency of total flavonoids
图6~图11直观地反映了各因素对响应值的影响,由等高线图可以看出存在极值的条件应该在圆心处。比较六组图可知:提取温度(A)对桃金娘叶片总黄酮提取的影响最为显著,表现为曲线较陡;而提取时间(D)、液固比(C)与乙醇体积分数(B)次之,表现为曲线较为平滑,且随其数值的增加或减少,响应值变化较小。
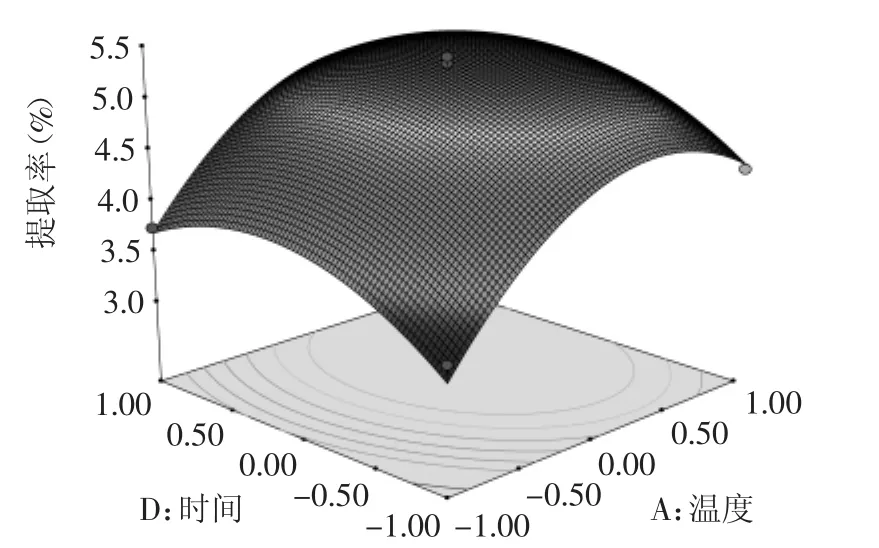
图8 提取温度和提取时间对总黄酮提取率的等高线图和曲面图Fig.8 Curved surface plot and contour line for reciprocal effect of temperature and time on extraction efficiency of total flavonoids
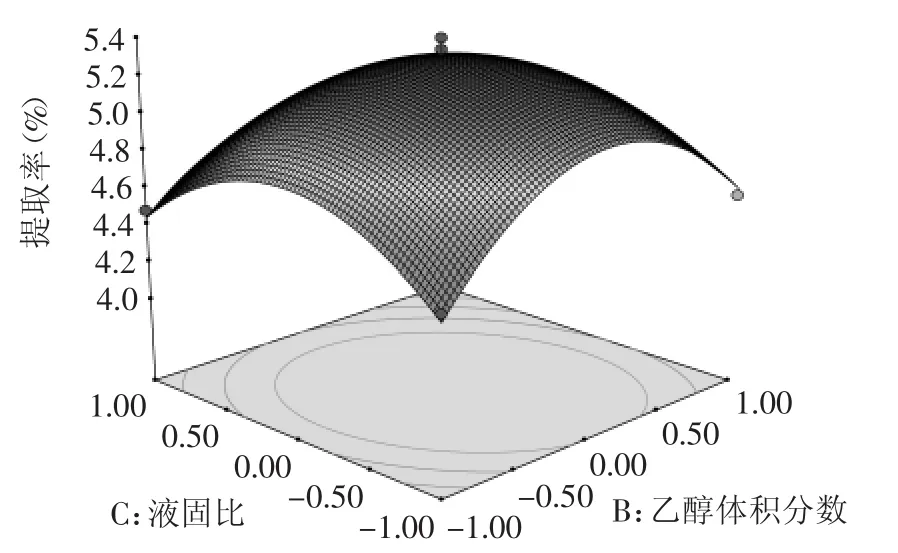
图9 乙醇体积分数和液固比对总黄酮提取率的等高线图和曲面图Fig.9 Curved surface plot and contour line for reciprocal effect of ethanol concentration and liquid-solid ratio on extraction efficiency of total flavonoids

图10 乙醇体积分数和提取时间对总黄酮提取率的等高线图和曲面图Fig.10 Curved surface plot and contour line for reciprocal effect of ethanol concentration and time on extraction efficiency of total flavonoids
2.2.3 最优提取工艺及验证 通过Design Expert 8.0.5b软件分析得到的山稔叶总黄酮最佳提取工艺为提取温度73℃、乙醇体积分数50%、液固比19∶1(mL/g)、提取时间124min,黄酮提取率理论值为5.443%。在此条件下,重复三次实验,山稔叶黄酮提取率为5.426%。与理论预测值相比,其相对误差约为0.31%。而且重复性也很好,说明优化结果可靠。
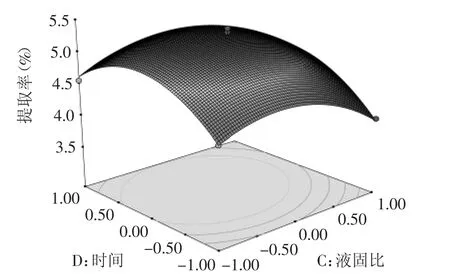
图11 液固比和提取时间对总黄酮提取率的等高线图和曲面图Fig.11 Curved surface plot and contour line for reciprocal effect of liquid-solid ratio and time on extraction efficiency of total flavonoids
2.3 山稔叶总黄酮对DPPH自由基清除作用
由图12可以看出山稔叶总黄酮对DPPH自由基具有明显的清除效果,且在一定范围内呈量效关系。当样品浓度为18μg/mL,清除率达到最大值73.48%。经GraphPad Prism V5.01软件计算得到山稔叶总黄酮对DPPH自由基的IC50(半数抑制浓度)为9.797μg/mL,而VC为7.886μg/mL,清除效果略优于山稔叶总黄酮。

图12 山稔叶总黄酮及VC对DPPH自由基清除作用Fig.12 Scavenging effect of total flavonoids and VCon DPPH
3 结论
3.1本文在单因素实验的基础上,利用Design Expert 8.0.5b软件设计响应面实验优化山稔叶总黄酮回流提取工艺。通过方差分析可知,各因素对山稔叶总黄酮提取率的影响作用为:提取温度>提取时间>液固比>乙醇体积分数。山稔叶总黄酮回流提取的最优工艺条件为:提取温度73℃、乙醇体积分数50%、液固比19∶1(mL/g)、提取时间124min。在此条件下总黄酮的提取率(5.426%)与预测值基本相符。
3.2山稔叶总黄酮具有较强的DPPH自由基清除能力,在一定浓度范围内呈量效关系,其IC50为9.797μg/mL,与天然抗氧化剂VC(IC50=7.886μg/mL)相近。本研究为合理开发利用山稔叶资源提供了理论依据。
[1]J Saising,Ongsakul M,Voravuthikunchai SP.Rhodomyrtus tomentosa(Aiton)Hassk ethanol extract and rhodomyrtone:A potential strategy for the treatment of biofilm-forming staphylococci [J].Journal of Medical Microbiology,2011,60:1793-1800.
[2]宋立人,洪恂,丁绪亮,等.现代中药大辞典(上册)[M].北京:人民卫生出版社,2001:189.
[3]Jongkon S,Supayang PV.Anti Propionibacterium acnes activity of rhodomyrtone,an effective compound from Rhodomyrtus tomentosa(Aiton)Hassk.leaves[J].Anaerobe,2012,18:400-404.
[4]Geetha KM,Sridhar C,Murugan V.Antioxidant and GastroprotectiveactivitiesofRhodomyrtustomentosa(Ait.)Hassk[J].International Journal of PharmTech Research,2010,2(1):283-291.
[5]Dachriyanus,Salni,Melvyn VS,et al.Rhodomyrtone,an antibiotic from Rhodomyrtus tomentosa[J].Australian Journal of Chemistry,2002,55:229-232.
[6]林忠文,李茂,曾宪彪,等.山菍不同提取物对正常动物颈总动脉血压影响的比较研究[J].时珍国医国药,2009,20(7):1613-1614.
[7]Tung NH,Ding Y,Choi EM,et al.New Anthracene Glycosides from Rhodomyrtus tomentosa Stimulate Osteoblastic Differentiation of MC3T3-E1 Cells[J].Archives of Pharmacal Research,2009,32(4):515-520.
[8]候爱君,刘延泽,吴养洁.桃金娘中的黄酮苷和一种逆没食子丹宁[J].中草药,1999,30(9):645-648.
[9]高志强,江相兰,宋仲容.竹叶中黄酮类化合物的研究进展评述[J].西南民族大学学报:自然科学版,2005,31(1):38-43.
[10]吴华勇,黄赣辉,顾振宇,等.响应曲面法优化竹叶总黄酮的提取工艺研究[J].食品科学,2008,29(11):196-200.
[11]王振宇,周芳,赵鑫.响应面分析法优化超声波提取大果沙棘总黄酮工艺[J].中国食品学报,2007,7(6):44-51.
[12]Hsu CF,Zhang LJ,Peng H,et al.Scavenging of DPPH free radicals by polypyrrole powders of varying levels of overoxidation and/or reduction[J].Synthetic Metals,2008,158:946-952.
[13]夏杏洲,张辉,魏传晚.榕树叶中黄酮类化合物的提取条件研究[J].食品研究与开发,2002,23(5):35-37.
Optimization of extracting total flavonoids from leaves of Rhodomyrtus tomentosa(Ait.)Hassk by response surface methodology
WU Ping-ping,LAI Man-ping,YIN Yan-yan,HUANG Ru-qiang
(College of Life Science,South China Normal University,Guangzhou 510631,China)
Based on single factor experiments,extraction conditions concluding extraction temperature,ethanol concentration,liquid-solid ratio and extraction time were optimized using response surface methodology.The results showed that the optimal extraction conditions were as follows:extraction temperature 73℃,ethanol concentration 50%,liquid-solid ratio 19∶1(mL/g)and extraction time 124min,resulting in an extraction efficiency of 5.426%for total flavonoids which was consistent with the predicted value.In addition,total flavonoids from leaves of R.tomentosa had scavenging effect on DPPH with a dose-effect relationship,and the IC50was 9.797μg/mL.
leaves of R.tomentosa;total flavonoids;response surface;DPPH
TS255.1
B
1002-0306(2014)04-0223-06
2013-08-02
吴萍萍(1988-),女,硕士研究生在读,研究方向:天然产物研究与开发。
广东省农业攻关计划(2006B20401017)。
