淀粉结构调控大肠微生物发酵生产丁酸的机制研究
2014-02-25周中凯陈晓姗郑排云
周中凯,陈晓姗,张 岩,郑排云,杨 艳
(天津科技大学食品工程与生物技术学院,天津300457)
淀粉结构调控大肠微生物发酵生产丁酸的机制研究
周中凯,陈晓姗,张 岩,郑排云,杨 艳
(天津科技大学食品工程与生物技术学院,天津300457)
通过对普通玉米淀粉和高直链玉米淀粉的不同处理,得到系列不同结构的淀粉底物,进而分别测定它们在发酵进程中产丁酸的能力。经淀粉的结构特征与肠道微生物合成丁酸的关系的进一步研究,结果显示高直链玉米淀粉及其热处理的样品属于缓速发酵型底物,发酵后其产丁酸的浓度高达19.77~27.72mmol/L;而玉米淀粉及其热处理的样品属于快速发酵型底物,发酵后更易产生高浓度的醋酸和乳酸,而丁酸的浓度仅为2.48~14.19mmol/L,热处理会大幅度降低该类底物合成丁酸的能力,表明淀粉底物结构与肠道合成丁酸的能力密切相关。
淀粉结构,微生物发酵,短链脂肪酸,丁酸
丁酸是由结肠共生菌发酵食物纤维和抗性淀粉产生的一种短链脂肪酸,现代医学研究表明,丁酸可预防大肠癌的发生[1]。据报道,在世界范围内,大肠癌的发病率位居肿瘤第二位,大肠癌占男性全部恶性肿瘤发病的9.4%,女性10.1%。全球每年大约102万新发病例,53万死亡病例,其中我国每年新发病人数约40万人,死亡为7.35~10万。大肠癌是最常见的恶性肿瘤之一,发病率在我国所有肿瘤发病率中排名第5位,而且其具有明显的上升趋势。有关的医学研究表明在大肠癌患者的大肠中,丁酸含量比正常人大肠中的丁酸含量低许多[2]。除此之外国内外还有报道称丁酸可抑制前列腺癌、膀胱癌、乳腺癌、食管癌、白血病等多种肿瘤细胞的生长,促进其分化,并诱导细胞凋亡,抑制肿瘤的侵袭和浸润[3-4]。尽管其作用的分子机制目前尚未完全阐明,但丁酸作为一种有效的防癌、抗癌因子则已被证实[5-6]。淀粉特别是抗性淀粉可经肠道微生物发酵产生丁酸,有关研究表明抗性淀粉产丁酸能力超过其他膳食纤维[1],但是不同来源的淀粉产丁酸能力差异很大,这取决于淀粉的精细结构[7-8]。淀粉是如何调节微生物的代谢途径进而影响肠道合成丁酸能力的机理目前仍然不是十分清楚。本文以不同结构的淀粉为原料,模拟人体肠道发酵模型,使淀粉经体外代谢来研究淀粉结构如何调节微生物代谢途径。本研究之所以以淀粉为原料基于下面几点考虑:一是以相同量的底物来进行微生物的发酵,可消除因底物的量的差异影响到丁酸的产量;二是因为抗性淀粉是由四种类型组成,第一种类型是因食品的质构因素阻碍了其与消化酶接触从而进入大肠,这部分抗性淀粉的结构与原淀粉没有非常大的差别;三是通过调整制备工艺可以获得系列结构不同的淀粉底物,从而可拉大淀粉底物结构对发酵过程的敏感性,即放大底物结构对微生物代谢途径的影响。这个模型可以使我们更清楚地了解底物结构是如何调控微生物的代谢状况。
1 材料与方法
1.1 材料与仪器
普通玉米淀粉 美国Sigma公司;高直链玉米淀粉 澳大利亚国民淀粉公司。
BAO-50A型干燥箱 美国STIK GROUP LLC公司;EC1X2型高压锅 美国CA,ASC Process Systems公司;SM-6610型扫描电子显微镜 日本Tokyo,JEOL公司;Excalibur 3100型红外光谱仪 Varian;PIKE technologies型数显高压钳 美国PIKE;Agilent 7890A型气相色谱仪 美国安捷伦科技有限公司;Allegra X-12型离心机 美国Beckman Coulter公司。
1.2 实验方法
本实验采用两种热处理方式改变淀粉的结构:一是无水条件下的热处理;二是在含水条件下进行高压蒸煮的处理。
1.2.1 无水条件下热处理 将淀粉先在50℃干燥箱中脱水(总约12h),然后将烘箱的温度升至135~140℃并维持3.0h,将样品取出,冷却,密封,备用。
1.2.2 含水条件下进行高压蒸煮处理 将淀粉用蒸馏水分别调至成含25%和60%的水分,然后进入高压锅中加热(121℃,20min),然后冷却至室温此为一个加热循环。根据加热循环次数不同可制备出一系列淀粉样品。蒸煮后样品冷却,冷冻干燥,粉碎,然后过0.5mm筛网,最后将样品密封待用。将经上述处理所得的样品进行编号,详见表1。
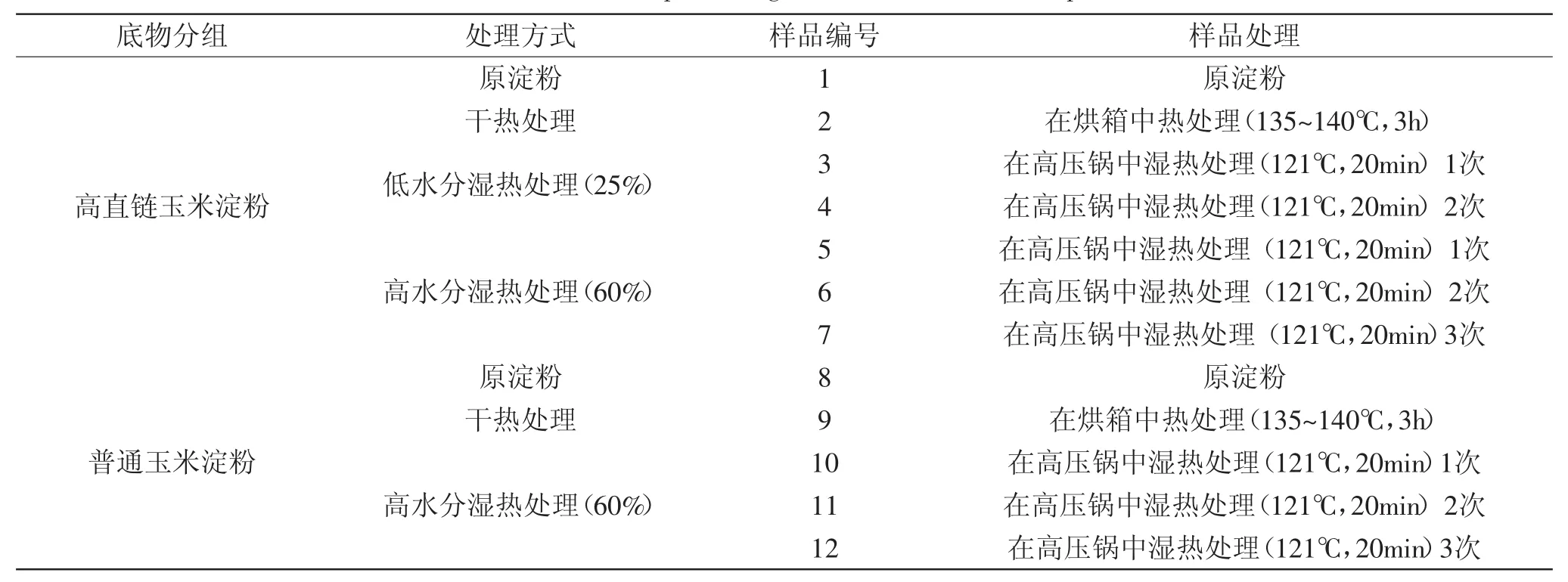
表1 实验用淀粉底物处理方式及样品编号Table.1 Method for processing starch substrate and sample No.
1.2.3 利用FTIR分析淀粉的组织结构 淀粉样品的结构采用傅里叶变换红外光谱仪进行分析,采用DTGS检测器,利用MIRacleTM全反射衰减晶片和数显高压钳完成测定。样品直接加载到晶片上并在3600~600cm-1范围内扫描,分辨率为4cm-1。记录之前光谱以空白为背景进行转变校正,利用Varian Resolutions Pro软件进行基线修定,并处理得到图谱[9-10]。
1.2.4 微生物发酵 利用微生物发酵法分别降解各淀粉样品,对其降解前后的分子结构进行分析。微生物发酵法的生物模型主要是模拟人体大肠发酵体系,即利用人体肠道微生物菌群的体外培养来研究淀粉的发酵过程[11]。
实验操作过程为:采用磷酸缓冲液将来源于健康人体粪便制备成10%(w/v)的肠道微生物混合菌液,用于体系发酵。取200mg淀粉样品底物加入到含9mL发酵介质的发酵瓶中并水合1h(温度控制在4℃)。发酵介质包含以下物质(每1L蒸馏水):2.5g胰蛋白酶、125μL矿物质溶液(每升蒸馏水中132g CaCl2·2H2O,100g MnCl2·4H2O,10g CoCl2·6H2O,80g FeCl3·6H2O)、250mL缓冲溶液(每升蒸馏水中4g(NH4)HCO3、35g NaHCO3)、250mL矿物质溶液(每升蒸馏水中5.7g Na2HPO4,0.6g MgSO4·7H2O)和1.25mL刃天青溶液0.1%(w/v)。取33.5mL灭菌后的还原性溶液(每升蒸馏水中6.25g半胱氨酸盐酸盐,6.25g Na2S·9H2O,40mL NaOH)添加到1L发酵介质中,发酵介质的pH调整到7.2。每个发酵瓶接种1mL的微生物混合菌液,混合菌液中含有1×1010cfu/mL活菌,最终保证达到每个发酵瓶中含有1×109cfu/mL活菌。每个实验瓶中用氮气喷雾,并用石蜡密封作为防止泄露的预防措施。实验瓶在37℃振荡中培养24h,发酵结束后立即冷冻贮藏。
1.2.5 发酵产物短链脂肪酸和乳酸的分析 取上述2mL发酵液离心,取1mL清液与50μL的0.1mmol/L的二乙基乙酸混合作为内标物,同时添加500μL的浓HCl和2mL乙醚溶液进行提取。振荡处理1min,离心,取乙醚层,再乙醚提取,合并乙醚层。将100μL的三氟乙酰胺添加到乙醚提取溶剂中。将混合体系加热到80℃并维持20min,经反应形成叔丁基二甲硅烷基衍生物。用气相色谱仪(CG)对衍生物进行分析,毛细管柱(30m×0.25μm)的薄膜厚度为0.1μm,进样系统和检测器的温度为275℃,色谱柱的温度调控在63℃保留3min,然后以每秒10℃升温到190℃。以氮气为载气,进样量为0.2μL。
1.2.6 扫描电子显微镜(SEM)观测淀粉的形态 按表1处理得到的淀粉样品冷冻干燥、轻微粉碎后,均匀地撒在贴有双面胶的样品面盘上,用Hitachi 1B-3离子涂布器喷金固定,然后利用扫描电子显微镜(SEM)观察并记录颗粒形态。未经处理的淀粉样品用SEM直接观察并与前者进行比较。对每种淀粉样品至少记录三次其颗粒形态[10]。
1.3 数据统计与分析
在农村经济管理工作中运用信息化手段,还需要进一步加强网络安全管理,保障网络系统始终处于正常的运行状态,为财务信息提供安全保障。与此同时,网络信息系统采用模块化的组合方式,既可以满足不同客户的需求,又能避免出现不当的投资行为[5]。
每个样品进行4次平行测定,实验数据以均数±标准差表示,用SPSS 11.5 for windows统计软件进行方差分析。
2 结果与讨论
2.1 淀粉结构的比较
2.1.1 热处理对淀粉颗粒外形的影响 干热处理对淀粉颗粒形态的影响取决于淀粉的来源。在干热处理条件下,两种来源的淀粉颗粒总体形态没有发生变化,但对于普通玉米淀粉而言,其表面产生微小细孔,可能是因为这种热处理破坏了淀粉内部结构或者是原来淀粉颗粒本身具有微小细孔,并在处理过程中其变得更为明显;对于高直链玉米淀粉而言,干热处理后,其整个形态及表面没有发生明显变化。
湿热处理导致淀粉颗粒原来的形貌完全丧失,这是因为在高压高温条件下两种淀粉颗粒均遭到破坏,相互粘结,形成不规则形态。虽然两者均为不规则型,但从局部特征来看,在断裂面的精细结构上湿热处理后的普通玉米淀粉和高直链玉米淀粉呈现出不同的特征(图1),普通玉米淀粉颗粒的断裂面呈现出了表面疏松易断裂的结构特征,且表面比较粗糙;而对于高直链玉米淀粉颗粒,其断裂面比较圆整且相对光滑。
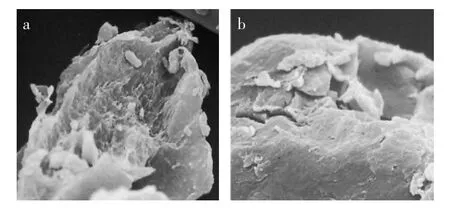
图1 湿热处理后破裂淀粉颗粒表面结构图(7500×)Fig.1 The surface structure of collapsed starch granules after moistured thermal treatment(7500×)
2.1.2 不同淀粉样品的FTIR图谱 热处理破坏了淀粉颗粒内部原有的分子有序结构,从而形成新的结构特征,这种处理前后的结构变化可用傅里叶变换红外光谱来描述。干热处理对两种淀粉的总体光谱图谱特征吸收峰的分布影响不显著,而湿热处理对不同淀粉而言,其光谱图谱的变化幅度则大不相同(图2)。
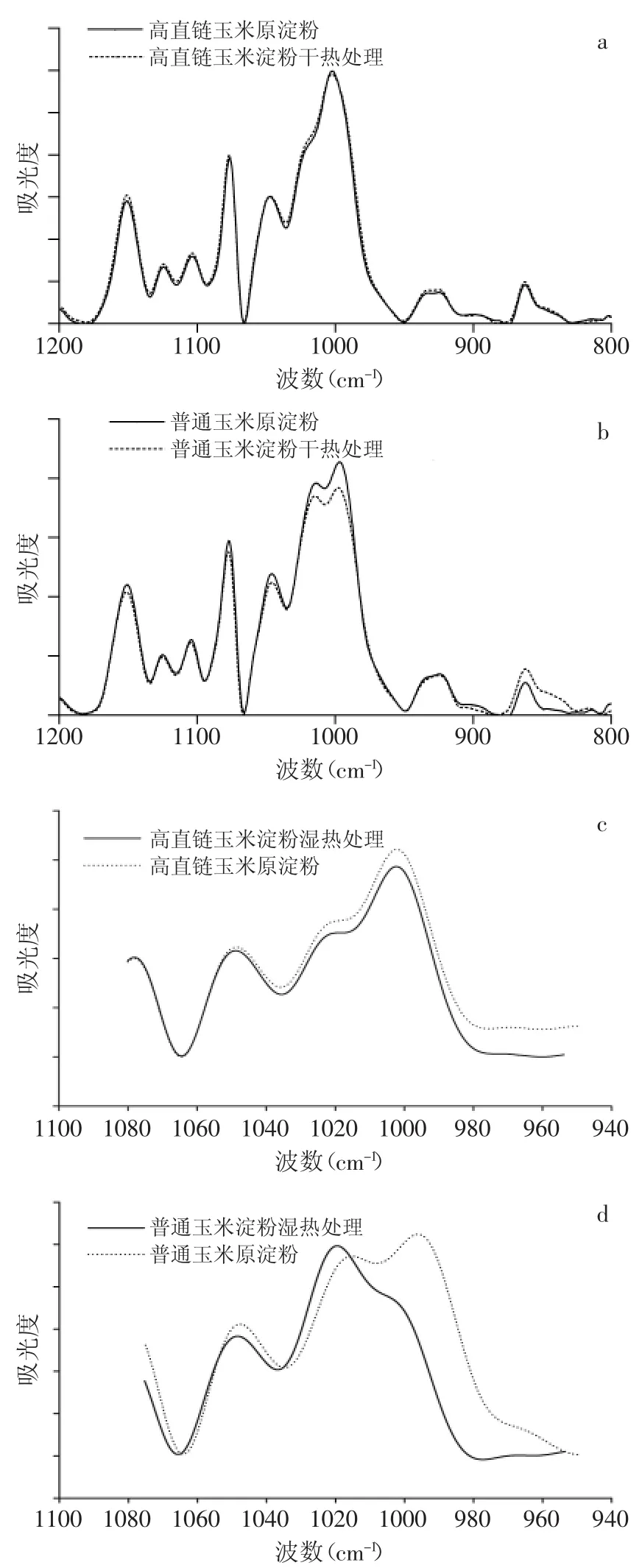
图2 不同热处理对淀粉傅里叶变换红外光谱图的影响Fig.2 The effect of different thermal treatment on starch FTIR spectrum
对于普通淀粉而言,湿热处理后其图谱发生了显著的变化,通过分析其谱图特征吸收峰发现,湿热处理之后其在1047cm-1处的吸收峰的强度较处理前有所降低,而在1022cm-1处的吸收峰较处理前有所增加。一般认为在1047cm-1的吸收峰是由两个重叠的峰组成,分别为1040cm-1和1053cm-1。在淀粉分子的重新排序过程中,在1040cm-1处波峰出现极快,而在1053cm-1处波峰的形成需要较长的时间。该吸收峰表示淀粉结构变得更为有序,而1022cm-1处波强表明淀粉分子为无序排列的状况。因此,在1047cm-1和1022cm-1处的吸收度分别与淀粉的有序和无序的结构有关。另外湿热处理显著性地改变普通玉米淀粉的谱图特征,特别是在两个高吸收峰处(1022cm-1和1000cm-1)峰形由左低右高变化为左高右低,增大了玉米淀粉对水分子的敏感度,这些综合的结构特征也将会大大影响到淀粉的自身代谢性质[12]。
而对高直链玉米淀粉而言,湿热处理虽然对1047cm-1处吸收峰的影响不大,但是在1022cm-1处的吸收峰有明显降低,其在1000cm-1左右的吸收峰没有发生明显迁移,说明高直链玉米淀粉的抗蒸煮性很强,这可能与其内部高度有序的结构有关。
2.2 淀粉结构对微生物发酵产物的影响
2.2.2 不同淀粉结构对发酵液中短链脂肪酸浓度的影响
2.2.2.1 两种原淀粉间的比较 普通玉米淀粉产生的总短链脂肪酸的浓度高于高直链玉米淀粉。但是如果分析每种短链脂肪酸的含量就会发现,普通玉米淀粉发酵过程更倾向于产生大量的乙酸,同时丙酸的产量也非常高,然而对于在肠道中生理活性最高的丁酸而言,普通玉米淀粉在发酵过程中对其合成的能力远低于高直链玉米淀粉。
2.2.2.2 干热处理对各自淀粉产酸能力的影响 干热处理后,对高直链玉米淀粉,其发酵生产短链脂肪酸能力有所提高,这主要是体现在对三种短链脂肪酸的产量均有提升,特别是对丁酸的合成能力的提升最为明显。而普通玉米淀粉经过干热处理后,虽然其发酵液中乳酸的浓度有所上升,但各个短链脂肪酸的浓度均有不同程度的下降,从而造成总短链脂肪酸浓度的降低。
2.2.2.3 湿热处理对各自淀粉产酸能力的影响 湿热处理后,普通玉米淀粉生产总短链脂肪酸的能力有所下降,特别是在生产丁酸的能力方面下降得最为明显。该结果表明湿热处理后的玉米淀粉被微生物利用之后,有利于生产较多的乙酸及一定量的丙酸,但乙酸在发酵液中的过度积累会影响到丁酸的合成,因为在微生物发酵过程中,存在转化关系:4乳酸+2醋酸=3丁酸[1,3]。丁酸的合成受到抑制的机理可能是丁酸合成酶活力不足或者在发酵过程中将乳酸和乙酸有效转化成丁酸的微生物的增殖受到抑制。然而,湿热处理后高直链玉米淀粉生产短链脂肪酸的能力得到大幅度提高,从表2中的数据分析可获得如下结论:
a.对高直链淀粉进行热处理特别是湿热处理可以大大提高其合成短链脂肪酸的能力(这与普通玉米淀粉的发酵情况恰好相反),这可能是由于经过湿热处理之后,其内部组织结构变得更为有序,特别是湿热处理后高直链玉米淀粉的发酵可以有效地提高丙酸和丁酸的浓度,而对乙酸浓度的提高影响不大,形成这样的原因可能是由于发酵过程中微生物能有效地将乙酸转化为丁酸,从而避免了丁酸在发酵过程中的过度积累。
b.热处理后可以提高高直链淀粉发酵液中丁酸在总短链脂肪酸中所占的比例,无论热处理方式如何(即干热处理或湿热处理),该比例均高达20%~23.8%;而对于普通玉米淀粉而言,淀粉热处理后其发酵液中丁酸所占总短链脂肪酸的比例仅为2.5%~8.9%。
从表2实验结果可以看出,肠道微生物对淀粉底物的结构特征非常敏感,这种调控机理可能是受淀粉颗粒的表面形态以及颗粒内部精细结构所影响。
对于内部结构疏松的玉米淀粉,其可被微生物快速降解成葡萄糖从而被快速地转化成有机酸,这种微生物的发酵模式利于发酵产生乙酸,同时乙酸在发酵液中的过度积累可遏制丁酸的合成。对高直链玉米淀粉而言,热处理后淀粉分子仍以高度有序结构排列,微生物对其降解的速度比较缓慢,葡萄糖的释放与微生物对其利用的速率之间有一个良好的动态平衡,这样的发酵模型不会造成乙酸在发酵液中的积累,发酵过程产生的乙酸可有效地在短时间内被微生物酶系转成丁酸,最后增加了发酵液中丁酸的浓度。
总体而言,增加湿热处理次数会降低普通玉米淀粉合成丁酸的能力,而对高直链玉米淀粉则恰相反,一次和两次的湿热处理似乎能够显著地增加其合成丁酸的能力,但是三次湿热处理后在其发酵液中丁酸浓度比热处理一次和两次的样品有小幅的降低,但其合成丁酸的生产能力仍高于未处理的高直链玉米淀粉。
热处理可以改善高直链玉米淀粉产丁酸的能力,这个研究结果具有一定的现实意义,因为在大多数食品当中的,淀粉都是经过加热处理后才被人体摄入。在湿热处理可以进一步提高丁酸产量这一点得到证实之后,采用何种加工方式及相关工艺参数进一步提高发酵液中丁酸的浓度仍需进一步的探讨。
2.2.3 不同淀粉结构对发酵合成乳酸的影响 发酵液的另外一种发酵特征是乳酸的合成,虽然其不属于短链脂肪酸,但测定其含量对探讨淀粉发酵机理很有帮助。总体而言,高直链玉米淀粉发酵过程中产乳酸的量远远低于普通玉米淀粉。两者之间的最大区别又体现在高直链玉米淀粉的发酵过程中,热处理(无论湿法还是干法)可大大降低乳酸的合成,这在以试图最大化地提高丁酸产量为目的的发酵情况下是有利的,从另一角度也可证明在该发酵体系中乳酸和醋酸转化合成丁酸的路线是通畅的;而对于普通玉米淀粉情况则恰恰相反,湿热处理可以提高乳酸在发酵液中的含量,高浓度的乙酸和乳酸在发酵液中的积累说明以普通玉米淀粉为底物的发酵过程中,丁酸的合成受到一定抑制,这种抑制机理可能与底物的快速发酵机制有关。
3 结论
通过制备不同结构的淀粉进行肠道微生物的发酵,揭示了淀粉底物的结构是如何调控肠道微生物的代谢产物。作为人体生理功能比较强大的丁酸,其在人体肠道中的合成受到淀粉底物结构的影响。普通玉米淀粉加热处理显著降低其产生丁酸的能力,这是因为热处理降低了其分子原有的有序性结构,这样的底物发酵遵循快速发酵模型,这种模型会产生大量的乳酸和乙酸,且丁酸的合成会受到抑制。而对于高直链玉米淀粉情况则相反,热处理对淀粉结构影响不明显,使其仍保留较高的分子结构的有序性,其发酵遵循缓速发酵模型,这样的模型有利于生产高浓度的丁酸,是从维持人体生理健康的角度所希望的一种发酵模型。
[1]Topping D L,Clifton P M.Short-chain fatty acids and human colonic function:roles ofresistantstarch and nonstarch polysaccharides[J].Physiological Reviews,2001,81:1031-1064.
[2]Karen W,Vicky D P,Kristin V.Relevance of protein fermentationtoguthealth[J].MolNutrFoodRes,2012,56:184-196.
[3]Heerdt B G,Houston M A,Augenlicht L H.Short-chain fatty acid-initiated cell cycle arrest and apoptosis of colonic epithelial cells is linked tomitochondrial function[J].Cell Growth Differ,1997(8):523-532.
[4]Bird A R,Brown I L,Topping D L.Starches,resistant starches,the gut microbiota and human health[J].Current Issues in Intestinal Microbiology,2000(1):25-37.
[5]Ferguson L R,Tasman-Jones C,Englyst H,et al.Comparative effects of three resistant starch preparations on transit time and short-chain fatty acid production in rats[J].Nutrition and Cancer,2000,36:230-237.
[6]林杨,赵新淮.颗粒型抗性淀粉的制备及性质[J].食品与发酵工业,2008,34(11):44-46.
[7]Jyothian A N,Sasikirank K,Sajeevms M S,et al.Gelatinisation properties of cassava starch in the presence of salts,acids and oxidising agents[J].Starch-Starke,2005,57(11):547-555.
[8]于卓腾,杭苏琴,姚文,等.肠道产丁酸细菌及其丁酸产生机制的研究进展[J].世界华人消化杂志,2006,25(14):2533.
[9]满建民,周兴华,董英,等.体内外消化高直链抗性水稻淀粉的波普特征[J].食品科学,2012,33(13):26-30.
[10]Zhou Z K,Topping D L,Morell M K.Changes in starch physical characteristics following digestion of foods in the human small intestine[J].British Journal of Nutrition,2010,104:1-9.
[11]Zhou Z K,Cao X H,Zhou J YH.Effect of resistant starch structure on short-chain fatty acids production by human gut microbiota fermentation in vitro[J].Starch,2013,65(5-6):509-516.
[12]Sevenous O,Hill SE,Farhat IA,et al.Organisation of the external region of the starch granules as determined by infrared spectroscopy[J].Int J Biol Macromol,2002,31(1-3):79-85.
Study on the mechanism of butyric acid production regulated by starch structure during gut bacterial fermentation
ZHOU Zhong-kai,CHEN Xiao-shan,ZHANG Yan,ZHENG Pai-yun,YANG Yan
(Tianjin University of Science and Technology,School of Food Engineering and Biotechnology,Tianjin 300457,China)
A number of starches with different structures were obtained by different processing methods from normal and high amylose maize starches,and their capacities for butyrate production were measured during the gut bacterial fermentation.The relation between starch structure and butyrate production was further studied.Results showed that high amylose starch and its thermally treated samples had slowly fermenting character,and could produce butyrate as high as 19.77~27.72mmol/L.However,normal maize starch and its thermally treated samples had quickly fermenting character,and produced higher concentrations of lactate and acetate but the butyrate only with 2.48~14.19mmol/L,and thermal treatment greatly reduced butyrate production for maize starch samples.The study suggested that starch structure and butyrate-producing capacity was highly related.
starch structure;microbial fermentation;short-chain fatly acids;butyric acid
TS235.1
A
1002-0306(2014)04-0199-05
2013-01-15
周中凯(1964-),男,博士,教授,研究方向:谷物科学与营养。
