烫漂工艺对西兰花多酚氧化酶的影响
2014-02-25汤文晶陈兴京张庆庆汤义明钱起光
张 帝,汤文晶,陈兴京,张庆庆,*,汤义明,钱起光
(1.安徽工程大学,生物与化学工程学院,安徽芜湖241000;2.芜湖新欣食品实业有限公司,安徽芜湖241000)
烫漂工艺对西兰花多酚氧化酶的影响
张 帝1,汤文晶1,陈兴京1,张庆庆1,*,汤义明2,钱起光2
(1.安徽工程大学,生物与化学工程学院,安徽芜湖241000;2.芜湖新欣食品实业有限公司,安徽芜湖241000)
以邻苯二酚为底物,通过分光光度计法,对西兰花中的多酚氧化酶(PPO)进行了研究,同时建立了西兰花PPO活性测定方法。结果表明,西兰花PPO活性的最适测定条件为:检测波长为415nm,反应温度为35℃,pH为7.2。同时对烫漂西兰花的工艺进行了研究,确定了最佳烫漂条件为:烫漂温度为95℃,烫漂时间为90s,烫漂后立刻用冰水冷却并冻藏,在此条件下,有效钝化西兰花PPO活性的同时还能有效的降低颜色的损失,具有良好的保色作用。
西兰花,多酚氧化酶,烫漂,钝化
西兰花为十字花科芸薹属,一年生宿根草本植物。它是一种营养成分齐全的高档蔬菜,并具有增强肝脏的解毒能力、提高免疫力和防癌的优点[1]。西兰花中含有丰富的黄酮类和多酚类化合物,在加工过程中,当组织完整性被破坏或膜受到伤害后,潜在的多酚氧化酶(PPO)大量被激活,催化原料中的多酚,使其氧化为醌,醌再发生聚合反应生成黑色物质,植物组织的褐变随之发生[2-3],这是导致西兰花发生褐变的主要原因。烫漂是果蔬速冻加工前预处理的关键工艺,是为了破坏果蔬的氧化酶系统,能够有效地钝化多酚氧化酶的活性,防止因酶的氧化而产生褐变[4],使制品保持美观的色泽。本研究对西兰花PPO的测定条件、烫漂过程中PPO的钝化及护色作用进行了相关实验,确定了西兰花PPO反应体系的最大吸收波长,得到测定的反应条件,并确定了最佳烫漂工艺,探讨了烫漂对PPO的钝化与西兰花保鲜保色之间的关系,为蔬菜加工提供有效依据。
1 材料与方法
1.1 材料与仪器
西兰花 芜湖新欣食品实业有限公司;其余试剂 均为分析纯。
DS-200型高速组织捣碎机 江阴市保利科研器械有限公司;YP1002型电子天平 上海佑科仪器仪表有限公司;HS-J2型高速台式冷冻离心机 贝克曼库尔特商贸(中国)有限公司;L5型紫外可见分光光度计 上海仪电分析仪器有限公司;HH-4型数显恒温水浴锅 金坛市杰瑞尔电器有限公司;pHS-3C型酸度计 上海雷磁仪器厂。
1.2 实验方法
1.2.1 PPO粗酶液的提取及最大吸收波长的测定 取洗净的西兰花花冠部分按料液比1∶5(w/v)加入预冷的磷酸缓冲液(0.2mol/L,pH=7.2)于组织捣碎匀浆机中,低温匀浆2min,转移至离心管中,于10000r/min、4℃离心15min,上清液即为粗酶液,4℃保存备用[5]。取PPO粗酶液1mL,用磷酸盐缓冲液(0.2mol/L,pH= 7.2)稀释4倍后,在波长350~800nm范围内进行波长扫描。
1.2.2 反应体系最大吸收波长和PPO相对酶活的测定 取磷酸缓冲液(0.2mol/L,pH=7.2)2mL,0.2mol/L邻苯二酚溶液1mL、PPO粗酶液1mL至比色皿中,迅速摇匀,35℃下静置反应5min。以磷酸盐缓冲液为参比,在波长350~800nm范围内进行波长扫描,确定反应体系的最大吸收波长。以在PPO最大吸收波长处测定的吸光值表示PPO的相对酶活(即设同组实验中吸光值最大的相对酶活为100%)。
1.2.3 温度对PPO酶促反应速率的影响 按照1.2.2的方法,其余条件不变,分别在温度为20、25、30、35、40、45、50℃条件下进行实验,在415nm下测定PPO粗酶液OD值,测得不同温度条件下的相对酶活,确定最佳酶促反应温度。
1.2.4 pH对PPO酶促反应速率的影响 按照1.2.2的方法,选定温度为35℃,其余条件不变,调整磷酸缓冲液的pH分别为6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6进行实验,在415nm下测定PPO粗酶液OD值,测得不同pH条件下的相对酶活,确定最佳酶促反应pH。
1.2.5 底物浓度对酶促反应速率的影响 按照1.2.2的方法,选定温度为35℃,pH7.2,其余条件不变。分别加入浓度为0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4mol/L的邻苯二酚溶液1mL作为底物进行实验,在415nm下测定PPO粗酶液OD值,测得不同底物浓度条件下的相对酶活,确定酶促反应的最佳底物浓度。
1.2.6 最佳烫漂温度的选择 烫漂温度对PPO活性的影响 分别称取适量的西兰花花冠于为80、85、90、95、100℃的热水中烫漂,时间分别为30、60、90、120、150s。处理至规定时间后,迅速放入-1℃冰水中冷却3min,沥干后按照1.2.1的方法处理获得PPO粗酶液并分为两部分,一部分用磷酸盐缓冲液稀释4倍,在678nm处测定其OD678值,以OD678值作为西兰花的保色指标。另一部分在PPO最佳反应条件下测定PPO残存酶活。
1.2.7 最佳烫漂时间的选择 分别称取适量西兰花花冠95℃中水烫漂30、60、90、120、150、180、210s,处理至规定时间后迅速放入-1℃冰水中冷却3min,沥干沥干后按照1.2.1的方法处理获得PPO粗酶液并分为两部分,一部分用磷酸盐缓冲液稀释4倍,在678nm处测定其OD678值,另一部分按照1.2.1的方法处理,在PPO最佳反应条件下测定PPO残存酶活。
1.2.8 烫漂后冷却方法的选择 称取适量西兰花花冠若干份,在温度为95℃的热水中分别烫漂30、60、90、120、150s。处理至规定时间后,每种试样分两部分处理:一部分处理完毕后用风扇进行吹风冷却至室温并沥干,按照1.2.1的方法处理,测定PPO残存酶活;另一部分用迅速放入-1℃冰水中冷却3min,沥干后再用聚乙烯薄膜包裹放入冰箱冷冻室中冻藏,取部分冻藏的试样按照1.2.1的方法处理,测定PPO残存酶活,比较两部分所测酶活的差异[6](烫漂过程的PPO相对酶活均以相同批次的未经处理的西兰花花冠所提取的PPO粗酶液的活性作为最大值)。
2 结果与分析
2.1 最大吸收波长的确定
PPO粗酶液和体系反应产物在可见光350~800nm之间的波长扫描图如图l所示。
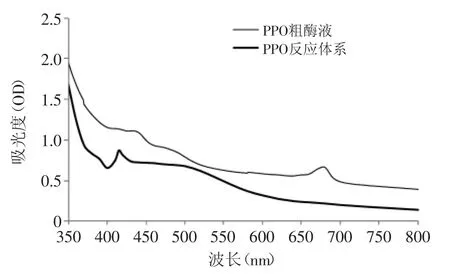
图1 波长扫描谱图Fig.1 Wavelength scanning spectra
由图1可看出,PPO粗酶液在678nm处有最大吸收峰,根据文献报道[7-8],叶绿素的吸收波长在600~700nm之间,以678nm作为叶绿素的测定波长,其OD值可作为西兰花烫漂后保色的指标,波长扫描前期没有波峰出现,排除了其他物质对PPO活性测定的影响。而PPO反应体系产物在415nm具有最大吸收峰,根据文献报道[9-12],PPO反应的最大吸收波长在405~420nm之间,以415nm作为PPO活性的最大测定波长。体系产物在415nm后扫描曲线较为平滑,且在600~700nm之间无吸收峰,说明底物邻苯二酚对叶绿素有破坏作用且在实验条件下破坏的较为彻底。
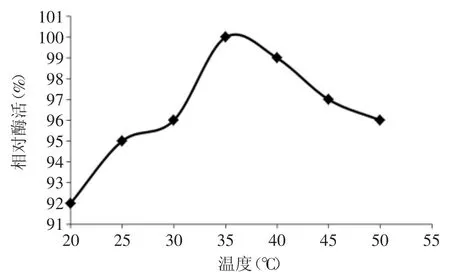
图2 温度对PPO活性的影响Fig.2 Effect of temperature on PPO activity
2.2 PPO活性最佳反应条件的确定
2.2.1 PPO反应最适温度的确定 温度对西兰花PPO活性的影响见图2,由图2可知,西兰花PPO反应最适温度为35℃。根据文献报道,不同植物的PPO最适温度不同,可能是因为不同植物的PPO的蛋白质空间结构上的差异所导致[13],也可能是由于不同植物体内和PPO发生协同作用的酶类的不同所导致。如图2所示,PPO活性先随温度升高而上升,在35℃时达到最大值。由于随着温度继续升高,分子的热运动加剧,PPO空间结构改变,活性中心三维结构破坏导致PPO活力降低[13],这与酶的特性相一致。在20~50℃时,西兰花PPO相对较稳定,所以在烫漂过程中可通过高温处理,钝化PPO的活性[14],在贮藏过程中,尽量选择低温以降低PPO的活性。
2.2.2 PPO反应最适pH的确定 由图3可知,采用邻苯二酚为底物时pH对西兰花PPO活力的影响,西兰花PPO反应最适pH为7.2。这也与文献报道多数水果中的PPO在接近中性pH时显示最大的活力相一致。在酸性和碱性时,酶活力急剧下降,当pH<6.2或pH>7.8时,PPO相对酶活显著下降。原因是PPO作为一种含铜的蛋白质,当pH较低时,辅基铜将以Cu2+的形式解离出来;当pH较高时,辅基铜则会解离生成Cu(OH)2[15],两种情况均可使PPO的活性显著降低。在果蔬加工贮藏中,通过调节pH可有效的抑制PPO活力。
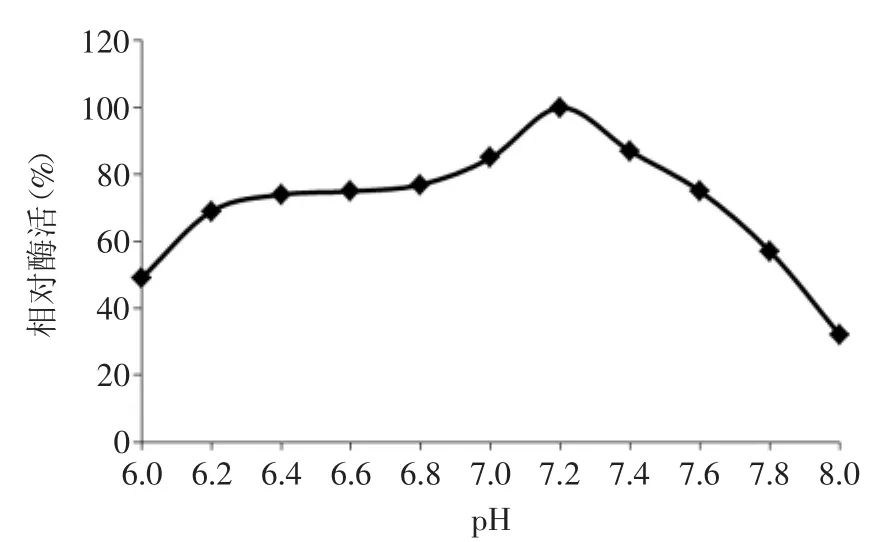
图3pH对PPO活性的影响Fig.3 Effect of pH on PPO activity
2.2.4 PPO反应最适底物浓度的确定 图4为底物浓度对PPO活性的影响,在供试反应体系中,当邻苯二酚浓度为0.05~0.25mol/L时,酶活性呈上升增长趋势,酶活与浓度成正比例的关系,表现为一级反应。当浓度为0.25~0.4mo1/L时,酶活性的变化趋于平缓,表现为零级反应。说明该酶促反应适宜的邻苯二酚用量为0.25mol/L,当底物浓度达到这一适宜值时,再增加底物浓度对酶的活性作用不大。这是因为当底物浓度较低时,有一些酶的活性部位未能与底物结合,随着底物浓度的增加,更多的酶活性部位与底物相结合,使酶促反应充分进行,在达到一定浓度后,所有的酶活性部位都与底物结合,此时,酶活性部位被底物饱和,进一步提高底物浓度也不能提高酶活性,酶活性达到最大值[16]。
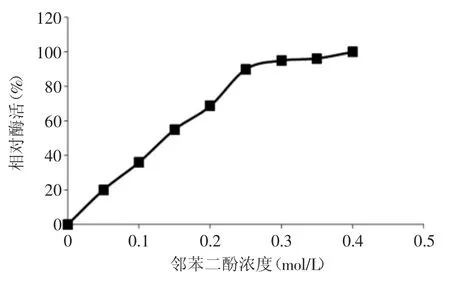
图4 底物浓度对PPO活性的影响Fig.4 Effect of the substrate concentration on PPO activity
2.3 烫漂工艺的确定
2.3.1 最佳烫漂温度的确定 图5为西兰花在不同温度烫漂不同时间对PPO活性的影响,由图5可知,85℃烫漂150s后,PPO相对酶活仍有39%,而100℃处理30s后,PPO相对酶活仅有33%;80~95℃烫漂150s后,PPO相对酶活在39%~27%之间,而100℃处理150s后,PPO相对酶活仅有10%,说明烫漂温度越高,烫漂时间越长,PPO相对酶活越低,这与酶在高温下变性这一特点相符合。其中100℃钝化酶活的能力最为显著。但是在蔬菜烫漂加工时除了要钝化PPO活性,还要考虑蔬菜的保色和保鲜,不同烫漂温度对西兰花颜色的影响见图6。
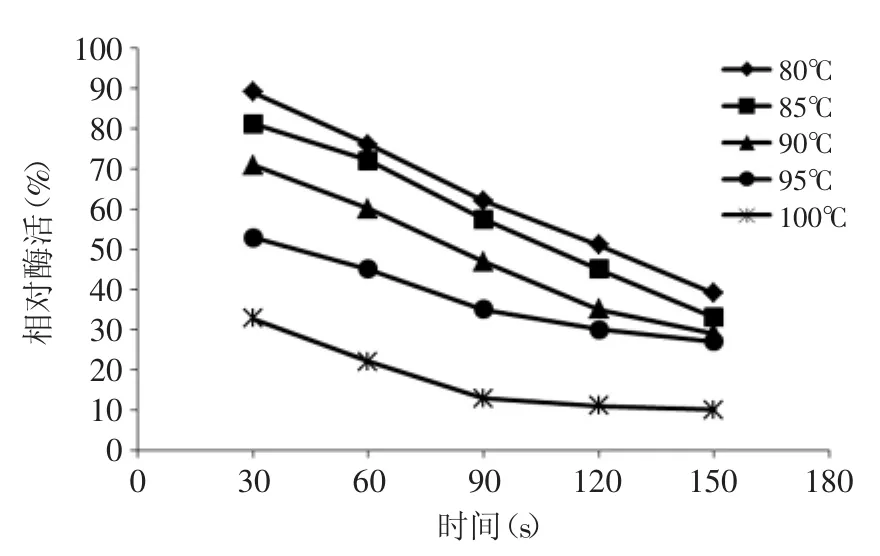
图5 不同温度烫漂不同时间对PPO活性的影响Fig.5 Effect of the blanching different temperature with different time on PPO activity
图6为西兰花烫漂90s后在678nm处测得的OD678值。由图6可看出,烫漂温度为80~95℃,OD678值略有下降但幅度很小,但烫漂温度为100℃烫漂90s后,OD678值骤降至0.081。说明西兰花中所含的叶绿素会在95~100℃条件下会被破坏。结合图5,选择95℃作为烫漂温度进行研究。
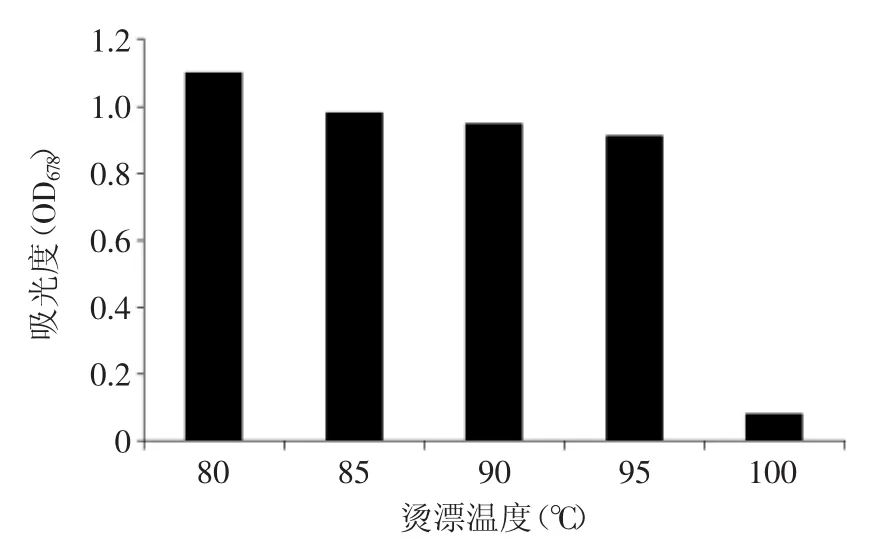
图6 不同温度烫漂90s后的OD678值Fig.6 OD678value of different blanching temperature after the 90s
2.3.2 最佳烫漂时间的确定 图7不仅表明西兰花在95℃烫漂不同时间对PPO活性的影响,还能表明对西兰花颜色的影响,由图7可看出,烫漂处理30s和90s后,PPO相对酶活由53%下降到35%,降幅较大,原因是由于烫漂时间过短,西兰花内部没有处理彻底,内部残存的PPO相对酶活比较高,烫漂90s和210s后,西兰花PPO相对酶活仅由35%下降到26%。下降幅度较小,原因是由于西兰花内部处理彻底,整个样品烫漂充分,酶活钝化较彻底。
由图7还可以看出,西兰花在烫漂处理30~120s之间,OD678值下降幅度较小,而在烫漂120s以后,OD678值下降幅度较大,导致这种现象的原因应该和PPO活性变化的原因一样。综合来看,选择90s和120s作为烫漂时间较为合理,此时西兰花PPO相对酶活分别为35%和30%,同时都可以有效的护色。从生产角度出发,选择90s作为处理时间可以有效的减少成本。因此选择烫漂90s作为西兰花烫漂时间。
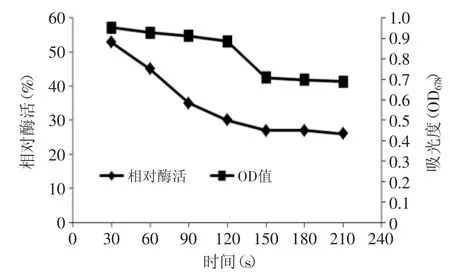
图7 95℃烫漂不同时间对PPO活性和OD678值的影响Fig.7 Effect of the different blanching time at 95℃on PPO activity and OD678value
2.3.3 冷却方法对PPO活性的影响 冷却方法对西兰花PPO活性的影响如图8所示。由图8可知,经过95℃烫漂处理90s,经过冰水冷却的西兰花PPO相对酶活(35%)低于常温(20~25℃)吹风冷却的西兰花的PPO相对酶活(45%),这是因为经冰水冷却后冻藏的西兰花植物细胞中会形成冰晶会使胞内可溶性PPO失活,并且在冻结过程中大量胞内液向胞外渗透,胞内未冻液高离子强度可能会造成可溶性PPO活性下降[17]。
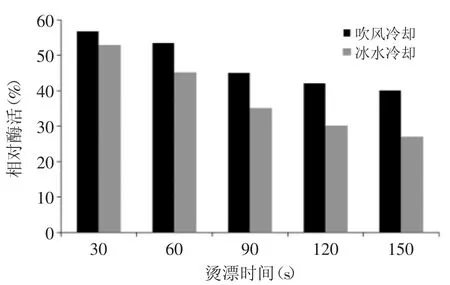
图8 冷却方法对PPO活性的影响Fig.8 Effect of the type of cooling on PPO activity
由图8还可以看出,随着烫漂时间的增加,常温吹风冷却和冰水冷却的相对酶活差值增加。这是因为烫漂过程中,随着烫漂时间的增加,PPO钝化的较为充分,冷却方式对PPO活性的影响更为明显。选择冰水冷却可以直接有效的降低PPO活性并且有利于后续加工工艺的操作。
3 结论
在实验条件下,西兰花PPO以邻苯二酚为底物,
其PPO活性的最佳测定波长为415nm,最佳反应温度为35℃,最佳pH为7.2,最佳底物浓度为0.25mol/L。在西兰花的加工和贮藏过程中要避开此温度和pH,以避免发生酶促褐变。
烫漂可以有效地钝化西兰花PPO活性,并以PPO活性和叶绿素OD678为指标,适当的调节温度和时间,结合工厂生产的情况,确定了西兰花在95℃烫漂90s时,烫漂后立刻用冰水冷却并冻藏的烫漂工艺条件,其PPO残存酶活在35%,对西兰花的颜色还有较好的保护作用,满足了厂家生产的要求,同时,能有效延长西兰花的贮藏期,为提高其食用价值和商品价值提供了理论基础和参考依据。
[1]勾雪娇,袁云香,吴翠平,等.西兰花的实用价值分析[J].农产品加工,2012(4):72-73.
[2]Kiattesak D,Richard K A.Comparatative study of polyphenoloxidases from taro and potato[J].Food Chemistry,1999,64(3):351-359.
[3]孔俊豪,孙庆磊,涂云飞,等.多酚氧化酶酶学特性研究及其应用进展[J].中国野生植物资源,2011,30(4):13-17.
[4]李余霞,王清章,李洁,等.速冻藕带烫漂工艺研究[J].北方园艺,2011(14):158-161.
[5]张福平,屈佳慧.豌豆多酚氧化酶的特性及抑制剂研究[J].广东农业科学,2011(5):135-146.
[6]程宏,侯金铎,刘浪.几种蔬菜烫漂后过氧化物酶活性的测定[J].冷饮与速冻食品工业,1997(2):15-27.
[7]曹建敏,姚恒.烤烟叶片叶绿素含量的测定及其与SPAD值的关系[J].分子植物育种,2009,7(1):56-62.
[8]袁方,李鑫,余君萍,等.分光光度法测定叶绿素含量及其比值问题的探讨[J].植物生理学通讯,2009,45(1):63-66.
[9]周向军,高义霞,袁毅君,等.“黑美人”马铃薯多酚氧化酶的特性研究[J].食品工业科技,2011,32(1):115-117.
[10]韩龙,王贵庆.国产大麦多酚氧化酶酶学特性的初步研究[J].啤酒科技,2008(12):49-51.
[11]钟振声,潘晓琴,方颖通.菊芋多酚氧化酶的酶学性质[J].华南理工大学学报:自然科学版,2010,38(12):135-139.
[12]许正虹,刘璇,高彦祥.紫甘薯多酚氧化酶性质研究[J].食品与发酵工业,2006,32(8):18-22.
[13]王磊,阮征,骆成尧,等.马铃薯多酚氧化酶酶学特性及热稳定性模型的研究[J].食品工业科技,2012,33(1):92-96.
[14]Wang M,Sun J,Feng WH,et al.Identification of a ripeningrelated lipoxygenase in tomato fruit as blanchingindicator enzyme [J].Process Biochemistry,2008(43):932-936.
[15]Wang JH,Jiang WB,Wang BG,et al.Partial properties of polyphenol oxidase in mango[J].Journal of Food Biochemistry,2007(31):45-55.
[16]孙月娥,张俊韬,王卫东.金针菇中多酚氧化酶活性测定及其护色研究[J].食品工业,2011(11):68-70.
[17]晏绍庆,刘宝林,华泽钊.冻结速率对苹果片多酚氧化酶和过氧化物酶活性影响的研究[J].食品工业科技,2000,21(2):8-10.
Effects of blanching conditions on polyphenol oxidase activity of broccoli
ZHANG Di1,TANG Wen-jing1,CHEN Xing-jing1,ZHANG Qing-qing1,*,TANG Yi-ming2,QIAN Qi-guang2
(1.College of Biology and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China;2.Wuhu Xinxin Food Industrial Co.,Ltd.,Wuhu 241000,China)
Polyphenol oxidase(PPO)of broccoli was investigated through spectrophotometric method by using catechol as substrate.And an examination method for the activity of broccoli PPO was established.Results showed that the optimum conditions for detection of PPO activity from broccoli were as followings:absorption wave length 415nm,35℃and pH7.2.The processing technology about blanching was investigated,results indicated that optimum condition of blanching was at 95℃for 90s,after blanching treated with cooling type of ice water immediately.Under the condition,the PPO activity of broccoli could be effectively passivation and the loss of color could reduce effectively,giving a good color retention.
broccoli;polyphenol oxidase;blanching;passivation
TS201.1
A
1002-0306(2014)04-0144-04
2013-07-08 *通讯联系人
张帝(1989-),男,硕士研究生,研究方向:天然产物的开发与利用。
芜湖市年度科技计划(2011农业-13)。
