脂肪氧合酶催化亚油酸氧化对花生蛋白结构的影响
2014-02-25赵谋明孙为正
廖 钰,叶 林,赵谋明,孙为正
(华南理工大学轻工与食品学院,广东广州510641)
脂肪氧合酶催化亚油酸氧化对花生蛋白结构的影响
廖 钰,叶 林,赵谋明,孙为正*
(华南理工大学轻工与食品学院,广东广州510641)
利用脂肪氧合酶催化亚油酸氧化的反应体系对花生分离蛋白进行不同程度的氧化修饰,通过研究不同亚油酸含量下花生分离蛋白的羰基值、游离巯基含量、粒径分布、表面疏水性、溶解度以及荧光光谱的变化规律,从而探讨氧化对花生分离蛋白结构的影响。结果表明:随着反应体系中底物亚油酸含量的增加,花生分离蛋白的羰基值先增加后略微下降,游离巯基含量下降,表面疏水性先增加后减小,说明氧化后花生分离蛋白的结构已经发生了改变。其粒径分布和溶解度的变化规律可以表征花生分离蛋白氧化聚集体的状态,同时其荧光峰位λmax的变化规律可反映花生分离蛋白三级结构的具体变化,表明脂肪氧合酶催化亚油酸氧化可以诱导花生分离蛋白分子发生聚集,使其结构发生显著变化。
花生分离蛋白,脂肪氧合酶,氧化,结构
脂肪氧合酶(LOX)是广泛存在于动植物体内的一种酶,尤其是在豆科植物中含量丰富[1]。它具有直接催化含顺,顺-戊二烯结构的多不饱和脂肪酸的能力,通过分子内加氧,形成具有共轭双键的氢过氧化衍生物[2]。这些氢过氧化物及其次生产物可与蛋白质和氨基酸等发生反应引起蛋白质氧化[3],是影响产品品质的重要因素之一。
花生蛋白因其丰富的营养价值广泛应用于食品工业。在加工和使用过程中,花生蛋白的功能性质受到许多因素的影响,蛋白质氧化是其中一个重要的因素。氧化修饰对蛋白质结构造成的影响主要包括蛋白质侧链氨基酸的改变、蛋白质的交联与肽链断裂、蛋白质分子结构的展开以及构象的变化[4]。这些结构变化最终导致蛋白质的营养价值下降、生物活性降低以及功能性质变化。近年来,越来越多的学者开始关注食品中脂质氧化与蛋白质氧化之间的联系。目前国内外的相关课题主要围绕动物蛋白展开研究,而针对花生蛋白氧化的研究还未见报道。本文利用脂肪氧合酶催化亚油酸氧化的反应体系对花生分离蛋白进行不同程度的氧化修饰,通过针对氧化后花生分离蛋白的羰基值、游离巯基含量、粒径分布、表面疏水性、溶解度以及内源荧光光谱的分析,以期对脂肪氧合酶催化脂质过氧化引起的花生蛋白氧化及其结构变化提供理论依据,为抑制蛋白质氧化奠定理论基础。
1 材料与方法
1.1 材料与仪器
低温脱脂花生粕 山东天申生物蛋白有限公司产品;大豆 市售;脂肪氧合酶(710U/mg) 自制;Tween 20 化学纯;亚油酸 色谱纯;其他试剂 均为分析纯。
pHS-25数显pH计 瑞士梅特勒-托利多公司;CS150NX超速离心机 日本HITACHI公司;SP-721可见分光光度计 上海精密仪器仪表有限公司;Nano-ZS纳米粒度分布仪 英国Malvern公司;F700荧光分光光度计 日本日立公司。
1.2 实验方法
1.2.1 花生分离蛋白的制备 参考刘岩等[5]的方法,脱脂花生粕与水1∶10混合,以2mol/L NaOH调节体系pH至8.0,浸提1h后常温3000×g离心15min,所得上清液以2mol/L HCl调节pH至4.5,离心后沉淀再用2mol/L NaOH调节pH至7.0,冷冻干燥,制得花生分离蛋白。
1.2.2 脂肪氧合酶的制备以及酶活的测定 制备方法[6]:大豆→粉碎→过40目筛→正己烷浸提→干燥→脱脂豆粕+水(料液比1∶11)搅拌→离心→上清液冷冻干燥→自制脂肪氧合酶。
酶活的测定参考黄友如等[7]的方法。取0.3mL 4mg/mL的酶液,加2mL底物乳状液(2.24×10-3mol/L亚油酸分散于含0.5μL/mL Tween20的0.1mol/L,pH9.0的硼酸缓冲液)混匀后30℃水浴3min,加5mL无水乙醇终止反应,再加5mL蒸馏水混匀,于234nm下测定反应的吸光度。以1min内2.3mL反应体系在234nm的吸光度增加0.001作为一个酶活单位(U)。
1.2.3 氧化花生分离蛋白的制备 底物亚油酸溶液的配制[7]:取1.5g亚油酸于50mL容量瓶中,依次加入1mL 5mmol/L NaOH溶液,10mL 0.2mol/L,pH9.0的硼酸缓冲液以及2滴Tween20,摇匀后用0.2mol/L,pH9.0的硼酸缓冲液定容至50mL。酶液的配制:取1.02g自制脂肪氧合酶溶于51mL pH9.0的磷酸盐缓冲液。
用去离子水配制5%的花生分离蛋白溶液,以2mol/L NaOH调节体系pH至9.0。分别称取100g溶液于5个锥形瓶中,用数字1~5表示。在每个瓶中均加入10mL酶液,并分别加入0、3、4.5、7.5、9mL底物亚油酸溶液,振荡摇匀,于4℃冰箱中培养6h后取出,以2mol/L HCl调节pH至4.5,离心(5000×g,30min),水洗沉淀并用2mol/L NaOH调节pH至7.0,冷冻干燥,制得氧化花生分离蛋白。
1.2.4 羰基值的测定 蛋白质羰基值的测定参考Levine等[8]的方法,并稍作调整。用去离子水配制5mg/mL的蛋白质溶液,充分搅拌后离心(10000×g,20min),用双缩脲法测定上清液中的蛋白质含量。取1mL上清液与3mL含有10mmol/L 2,4-二硝基苯肼的2mol/L HCl混合,常温下避光放置1h,以1mL上清液与3mL 2mol/L HCl混合作空白对照,再加入1mL 50%的三氯乙酸,振荡后静置20min再离心(10000×g,20min),用乙醇-乙酸乙酯混合溶液(1∶1,v/v)洗涤沉淀3次。最后将沉淀溶解于3mL 6mol/L盐酸胍溶液中,37℃水浴20min,待沉淀充分溶解后在367nm处比色,以22000M-1cm-1消光系数计算每mg蛋白质羰基衍生物的摩尔数。
1.2.5 游离巯基含量的测定 游离巯基含量的测定参考Beveridge[9]改进后的方法,并稍作调整。称取15mg样品分散于5mL Tris-Gly-8M Urea缓冲液中,漩涡振荡后加入50μL 4mg/mL DTNB溶液,迅速混合后于室温下保温1h,以缓冲液代替样品作空白对照,在412nm处比色,以13600M-1cm-1消光系数计算每mg蛋白质游离巯基的摩尔数。
1.2.6 粒径的测定 采用Nano-ZS马尔文纳米粒度分布仪测定样品的粒径分布。用0.01mol/L的磷酸缓冲液(pH7.0)配制0.02%的蛋白质溶液,过0.45μm的水膜进行测量。
1.2.7 表面疏水性的测定 采用ANS荧光探针法测定蛋白质表面疏水性[10]。用0.01mol/L的磷酸缓冲液(pH7.0)配制不同浓度的蛋白质溶液(0.02%、0.04%、0.06%、0.08%和0.1%)和8mmol/L的1-苯胺基-8-萘磺酸(ANS)溶液。取20μL ANS溶液加到5mL蛋白质溶液中,混合均匀,迅速测定混合液的荧光强度,激发波长和吸收波长分别是390nm和470nm。以蛋白质浓度对荧光强度作图,采用最小二乘法进行曲线拟合,直线的斜率即为蛋白质的H0。
1.2.8 内源荧光光谱的测定 采用荧光分光光度计测定样品的内源荧光光谱[11]。用0.01mol/L的磷酸缓冲液(pH7.0)配制0.2mg/mL蛋白质溶液,过0.45μm的水膜进行测量。荧光发散光谱分析以蛋白质内部荧光基团为探针,荧光光谱在290nm激发,扫描波长为300~400nm,激发和发射狭缝宽均为5nm,电压为500mV。
1.2.9 溶解度的测定 用去离子水配制5mg/mL的样品溶液,充分搅拌后离心(10000×g,20min),上清液中的蛋白质采用双缩脲法[12]测定,利用牛血清白蛋白(BSA)做标准曲线,测定540nm处的吸光值。根据样品中蛋白质含量和溶液中蛋白质含量比值计算溶解度。
1.2.10 数据统计与分析 数据均为3次测定的平均值,使用Excel 2007作图,并用SPSS 17.0进行数据分析。
2 结果与分析
2.1 氧化对花生分离蛋白羰基值的影响
蛋白质羰基值是广泛用于评价蛋白质氧化程度的指标之一。Zamora等[13]的研究发现脂质氧化产生的氢过氧化物及其次生产物可与蛋白质的氨基酸残基反应,导致蛋白质羰基含量的增加。由图1可见,随着反应体系中底物亚油酸含量的增加,花生分离蛋白的羰基值从3.83nmol/mg增加到5.8nmol/mg(p<0.05),随后略微下降到5.35nmol/mg(p<0.05)。羰基值的升高可能是因为脂肪氧合酶催化亚油酸氧化产生的脂质自由基可以诱导蛋白质自由基的生成,在蛋白质的α碳原子或其侧链氨基酸残基的其他碳原子上形成蛋白质类过氧化物,从而引起蛋白质羰基含量的增加[7];而羰基值的下降可能是因为5号样品的氧化程度较深,生成较多的不可溶性聚集体,使部分氧化反应所形成的羰基因沉淀分离而未被检测出来。该结果表明氧化使花生分离蛋白的氨基酸组成发生了变化,进而对花生分离蛋白的构象造成一定的影响。
2.2 氧化对花生分离蛋白游离巯基含量的影响
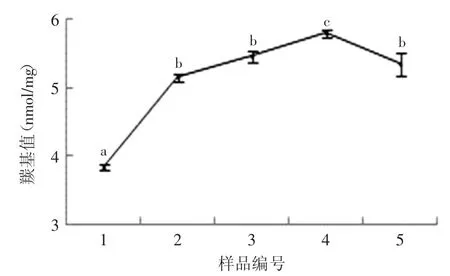
图1 不同亚油酸含量对花生分离蛋白羰基值的影响Fig.1 Effect of different contents of linoleic acid on thecarbonyl content of PPI
巯基和二硫键是稳定蛋白质分子构象的重要的化学键[14],对蛋白质的功能特性(如凝胶、起泡和乳化性能等)起着非常重要的决定作用。氧化可以改变半胱氨酸的氧化还原状态以及巯基/二硫键交互反应的平衡常数,进而改变蛋白质分子中巯基和二硫键的含量和分布[15]。如图2所示,随着反应体系中底物亚油酸含量的增加,花生分离蛋白的游离巯基含量不断减少,从5.16nmol/mg下降到4.25nmol/mg(p<0.05)。蛋白质的变性、二硫键的生成均可导致游离巯基含量的下降。崔旭海等[16]的研究表明,巯基的降低可能是由于在多肽分子之间或多肽内部形成二硫键,或者是进一步氧化成磺酸类或其他氧化产物,从而导致蛋白结构中巯基含量的下降。黄友如等[7]的研究表明,在添加亚油酸和脂肪氧合酶的大豆蛋白模拟体系中,巯基可能被氧化成非二硫键形式的基团,从而造成蛋白质中半胱氨酸的损失。
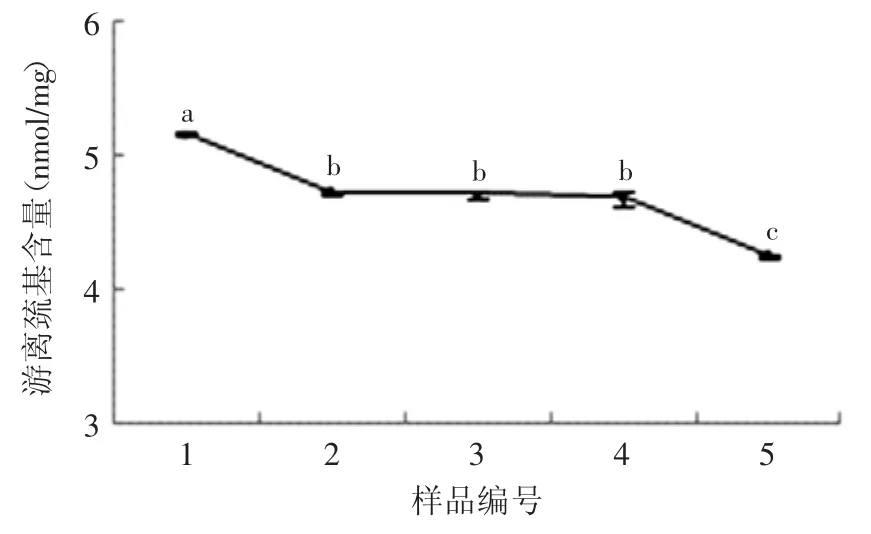
图2 不同亚油酸含量对花生分离蛋白游离巯基含量的影响Fig.2 Effect of different contents of linoleic acid on the free sulphydryl content of PPI
2.3 氧化对花生分离蛋白表面疏水性的影响
表面疏水性可以反映蛋白质表面疏水性基团的数量,它决定了蛋白质分子间相互作用的能力,从而影响蛋白质的功能特性[17]。如图3所示,花生分离蛋白的表面疏水性随着反应体系中底物亚油酸含量的增加先从123.28升高至185.93(p<0.05),再下降到99.35(p<0.05)。这可能是由于花生分离蛋白的结构随着氧化程度的增加逐渐展开,分子内部的疏水性基团逐渐暴露,从而导致其表面疏水性的增加;当氧化程度进一步加深时,展开的蛋白质分子又在疏水作用和二硫键的作用下重新聚集,使花生分离蛋白表面疏水性降低。该结果表明氧化改变了花生分离蛋白的分子构象。
2.4 氧化对花生分离蛋白荧光光谱的影响
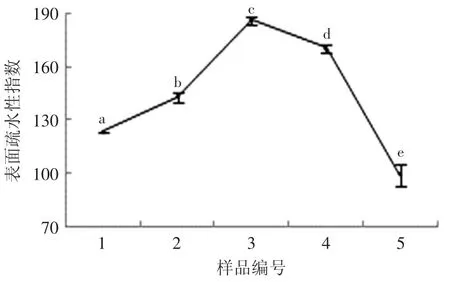
图3 不同亚油酸含量对花生分离蛋白表面疏水性指数的影响Fig.3 Effect of different contents of linoleic acid on the surface hydrophobicity of PPI
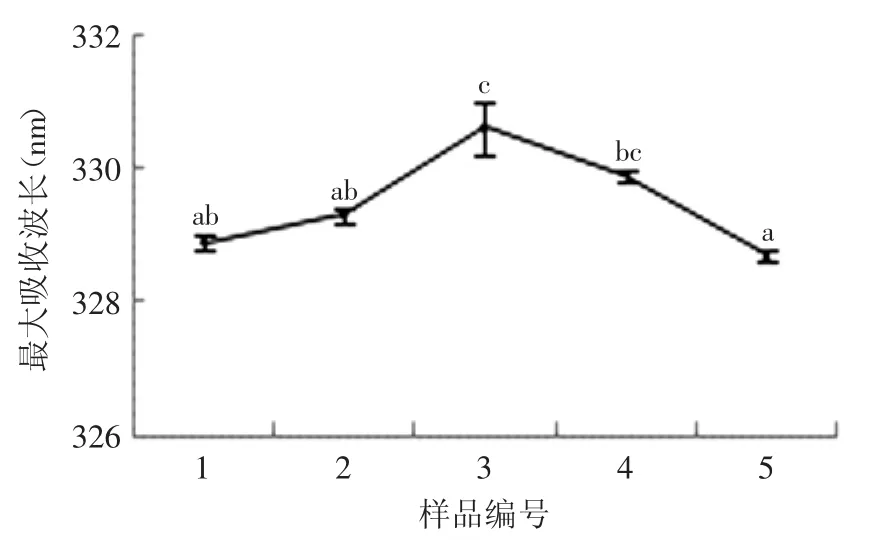
图4 不同亚油酸含量对花生分离蛋白内源荧光扫描时的荧光峰位的影响Fig.4 Effect of different contents of linoleic acid on the λmaxof PPI monitored by intrinsic fluorescence spectra
花生分离蛋白在290nm处激发所得到的主要是色氨酸为发射基团的荧光光谱,可反映色氨酸残基的变化程度及其微环境的变化情况[18]。如图4所示,随着反应体系中底物亚油酸含量的增加,花生分离蛋白的荧光峰位λmax先从328.9nm逐渐增加到330.6nm(p<0.05),再逐渐减小到328.7nm(p<0.05)。λmax的红移表明氧化使花生分离蛋白的结构展开,分子内部的色氨酸残基逐渐暴露,而λmax的蓝移则表明进一步的氧化使花生分离蛋白重新发生聚集,分子中的色氨酸残基暴露程度降低,被转移到内部非极性环境中。其荧光峰位λmax的分析结果与表面疏水性的分析结果相一致,进一步表明氧化会导致花生分离蛋白的聚集和结构的变化。
2.5 氧化对花生分离蛋白聚集程度的影响
激光纳米粒度测定仪只能对样品的可溶性部分进行测量,其测量结果一定程度上可以反映花生分离蛋白的聚集程度。不同氧化条件下花生分离蛋白的粒径分布如图5所示。与1号样品相比,2号样品的粒径分布明显向粒度小的方向偏移。随着反应体系中底物亚油酸含量的进一步增加,3号和4号样品的粒径分布相似,均向粒度大的方向偏移,并十分接近1号样品的粒径分布。而5号样品的粒径分布又略微向粒度小的方向偏移。上述现象可能是由于氧化引起了花生分离蛋白的分子结构展开,导致平均粒径变小;再通过暴露的疏水基团的相互作用生成可溶性聚集体,平均粒径变大;并随着进一步的氧化最终生成不可溶性聚集体而使相应的可溶性部分的平均粒径有所降低。
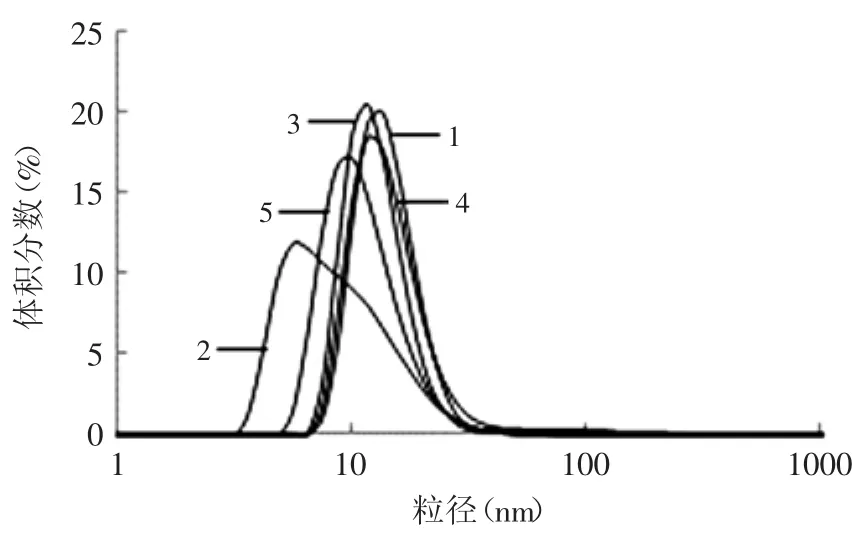
图5 不同亚油酸含量对花生分离蛋白粒径分布的影响Fig.5 Effect of different contents of linoleic acid on the particle size distribution of PPI
溶解性是蛋白质其他功能特性的基础,溶解度也可以用来表征花生分离蛋白的聚集程度。本文参照牛血清白蛋白标准曲线(图7)计算各样品的溶解度值。如图6所示,2号样品的溶解度略低于1号样品的溶解度,二者相差1.14%(p<0.05)。但随着反应体系中底物亚油酸含量的进一步增加,3号样品的溶解度达到最大值77.72%(p<0.05),随后溶解度逐渐下降到71.08%(p<0.05)。该测定结果与粒径分布的分析结果相结合,进一步说明氧化会诱导花生分离蛋白聚集,并随着氧化程度的加深,可溶性聚集体逐渐转变为不可溶性聚集体。
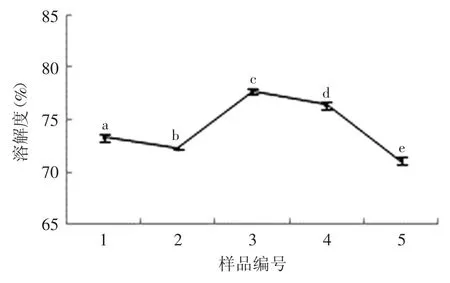
图6 不同亚油酸含量对花生分离蛋白溶解度的影响Fig.6 Effect of different contents of linoleic acid on the solubility of PPI
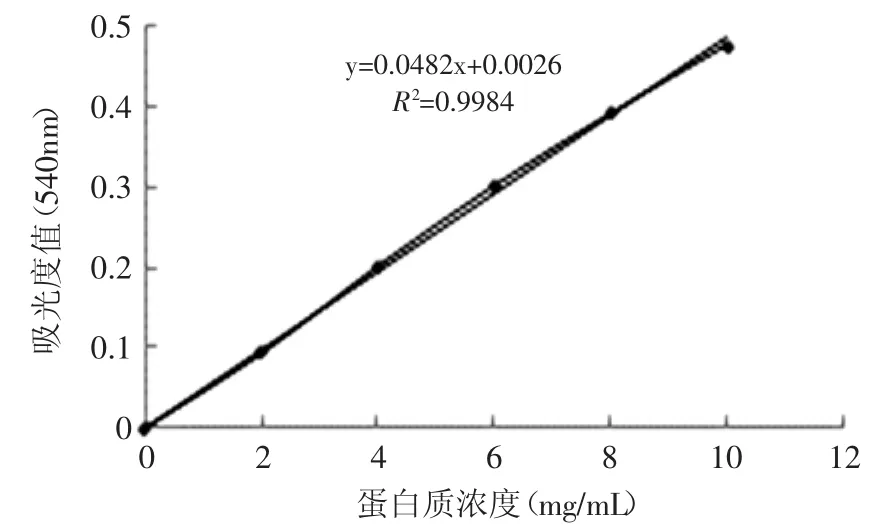
图7 牛血清白蛋白标准曲线Fig.7 The standard curve of bovine serum albumin
3 结论
脂肪氧合酶催化亚油酸氧化会对花生分离蛋白的结构产生明显的影响。由实验结果可知,花生分离蛋白的氧化伴随着羰基值的增加和游离巯基含量的下降。随着反应体系中底物亚油酸含量的增加,花生分离蛋白的表面疏水性和内源荧光光谱的荧光峰位λmax均呈现先增加后减小的趋势,表明花生分离蛋白三级结构的变化规律。此外,花生分离蛋白的粒径分布和溶解度的变化规律表明氧化可诱导花生分离蛋白聚集,并随着氧化程度的加深,可溶性聚集体逐渐转变为不可溶性聚集体。
[1]王璋.食品酶学[M].北京:中国轻工业出版社,1991:279.
[2]Pérez Gilabert M,Carmona F G.Chromatographic analysis of lipoxygenase products[J].Analytica Chimica Acta,2002,465(1):319-335.
[3]Gardner H W.Lipid hydroperoxide reactivity with proteins and amino acids:a review[J].Journal of Agricultural and Food Chemistry,1979,27(2):220-229.
[4]Wu W,Zhang C,Kong X,et al.Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry,2009,116(1):295-301.
[5]刘岩,赵冠里,赵谋明,等.花生湿热处理对其分离蛋白的结构和功能特性的影响[J].现代食品科技,2011,27(5):506-510.
[6]田其英,尹贵中,华欲飞.大豆脂肪氧合酶同工酶活性的影响因素研究[J].食品工业科技,2008,29(1):156-159.
[7]黄友如,华欲飞,裘爱泳.脂质氧化诱导的大豆蛋白聚集机理的研究[J].中国粮油学报,2006,21(1):80-87.
[8]Levine R L,Garland D,Oliver C N,et al.Methods of Enzymology[M].SanDiego:Academic Press,1990:464-478.
[9]Beveridge T,Toma S J,Nakai S.Determination of SH and SS groups in some food proteins using Ellman’s reagent[J]. Journal of Food Science,1974,39:49-51.
[10]Rao A,Shallo H E,Ericson A P.Characterization of soy protein concentrate produced by membrane ultrafiltration[J].
Journal of Food Science,2002,67(4):1412-1418.
[11]Voutsinas L P,Cheung E,Nakai S.Relationships of hydrophobicity to emulsifying propertiesofheatdenatured proteins[J].Journal of Food Science,1983,48(1):26-32.
[12]李宁.几种蛋白质测定方法的比较[J].山西农业大学学报:自然科学版,2006,26(2):132-134.
[13]Zamora R,Alaiz M,Hidalgo F J.Modificationof histidine residues by 4,5-epoxy-3-alkenals[J].Chemical Research in Toxicology,1999,12:654-660.
[14]Shewry P R,Tatham A S.Disulphide bonds in sequences[J]. Journal of Cereal Science,1997,25:207-227.
[15]Thomas J A,Mallis R J.Aging and oxidation of reactive protein sulphydryls[J].Experimental Gerontology,2001,36(9):1519-1526.
[16]崔旭海,孔保华,熊幼翎.自由基氧化引起乳清蛋白理化性质变化的研究[J].中国乳品工业,2008,36(9):31-34.
[17]Hou D H,Chang S K C.Structural characteristics of purified glycinin from soybeans stored under various conditions [J].Journal of Agricultural and Food Chemistry,2004,52(12):3792-3800.
[18]陶慰孙,李惟,姜涌明.蛋白质分子基础[M].北京:高等教育出版社,1995:260-263.
Effect of oxidation on the structure of peanut protein isolate induced by lipoxygenase-catalyzed linoleic acid
LIAO Yu,YE Lin,ZHAO Mou-ming,SUN Wei-zheng*
(College of Light Industry and Food Science,South China University of Technology,Guangzhou 510641,China)
Peanut protein isolate(PPI)was oxidized by free radicals and reactive oxidation products released by lipoxygenase-catalyzed linoleic acid.Carbonyl content,free sulphydryl content,particle size distribution,surface hydrophobicity,solubility and intrinsic fluorescence were determined to evaluate effect of oxidation on the structure of PPI.Results showed that,with increasing content of linoleic acid,the carbonyl content first increased then slightly decreased,the free sulfhydryl content decreased,and the surface hydrophobicity first increased then decreased,which reflected change in the structure of PPI after oxidation.Changes in the particle size distribution and solubility indicated the condition of PPI aggregates,and difference in the maximum emission wavelength indicated change of the tertiary conformation of PPI.All these showed that lipid oxidation could induce protein aggregation,leading to significant change in the structure of PPI.
peanut protein isolate;lipoxygenase;oxidation;structure
TS201.2
A
1002-0306(2014)04-0118-05
2013-07-17 *通讯联系人
廖钰(1990-),女,硕士研究生,研究方向:食品工程。
国家高技术研究发展计划(863计划)项目(2013AA102201);“十二五”国家科技支撑计划项目(2012BAD37B08);国家自然科学基金面上项目(31171783)。
