酶电极法快速测定黄原胶中乙醇含量
2014-02-25杨瑛
杨瑛
(廊坊梅花生物技术开发有限公司,河北廊坊065001)
酶电极法快速测定黄原胶中乙醇含量
杨瑛
(廊坊梅花生物技术开发有限公司,河北廊坊065001)
采用酶电极法对市售黄原胶中乙醇含量进行了测定,同时优化了仪器进样条件及样品前处理条件。实验结果表明,应用酶电极法测定乙醇,该方法的线性相关系数为0.9994;方法的检出限为0.02%;仪器检测速度为20s;测得不同浓度下方法的回收率为83.3%~93.3%;精密度实验的相对标准偏差(RSD)均在3%以下,稳定性好。该方法操作简单,能满足对黄原胶产品中的乙醇含量的快速检测。
酶电极法,黄原胶,乙醇,快速检测
黄原胶是野油菜黄单胞菌以玉米淀粉为主要原料经微生物发酵工程生产的一种多糖产品[1-3],根据美国药典中对有机挥发性杂质-溶剂残留限量的要求,产品中乙醇残留限量应不得高于0.05%[4]。目前国家标准[5]对黄原胶产品中的乙醇含量还没有出具相应的标准,这给企业对黄原胶产品的乙醇控制带来一定难度。结合黄原胶产品的粘性,需要开发出一种便捷的乙醇速测方法,以满足企业产品监测需要。
痕量乙醇的测定方法主要包括化学氧化法[6]、分光光度法[7]、重铬酸钾比色法[8-9]、顶空气相色谱法[10-11]、气相色谱法[12-17]、酶电极法[18-20]等。其中化学氧化法操作过程复杂,且因为仪器和人为因素干扰会使测定结果与实际值存在一定误差;分光光度法和重铬酸钾比色法受样品颜色干扰较为严重;顶空气相色谱法和气相色谱法价格昂贵、操作复杂、大大提高了企业的检测成本,故在指导生产的实际应用中受到较大限制。酶电极法对于乙醇的测定,目前有一些相关报道[18-20],但对于黄原胶产品中的乙醇检测还没有相应的方法的报道。
酶电极法利用了酶催化反应特异性原理,乙醇氧化酶在有氧条件下催化乙醇的氧化反应,生成乙酸和过氧化氢,过氧化氢和过氧化氢电极接触产生电流(该电流值和乙醇的浓度呈线性比例),在SBA生物传感器显示屏上显示一个数值,根据此读数值计算可得乙醇质量分数。实验拟通过优化仪器进样条件以及前处理条件,建立一种快捷、经济、简单的酶电极速测方法,实现对黄原胶产品中乙醇的快速检测。
1 材料与方法
1.1 材料与仪器
乙醇 色谱纯,纯度为99.9%,SIGMA-ALORICH公司;乙醇酶膜专用缓冲剂 山东省科学院生物研究所,一袋可配制500m L缓冲溶液,纯度为99.9%;缓冲溶液 将一袋乙醇酶膜专用缓冲剂充分溶解于水中,后转移定容至500m L容量瓶中,摇匀,过0.25μm水系滤膜,pH7.2±0.1;黄原胶 市售;分析用水 符合GB/T 6682规定的一级水规格。
SBA生物传感器 内置检测信号转换装置,山东省科学院生物研究所;乙醇氧化酶膜 山东省科学院生物研究所,应在0~4℃条件下保存,有效期1年;XS204电子天平(0.1mg) 瑞士梅特勒公司;电动搅拌器 上海梅颖浦仪器仪表制造有限公司。
1.2 乙醇标准溶液的配制
吸取30μL乙醇于10m L容量瓶中,用蒸馏水准确
定容至刻度,摇匀,之后吸取上述溶液1m L于25m L容量瓶中,用蒸馏水准确定容至刻度,摇匀,作为定标液。
1.3 样品预处理
移取100m L超纯水于250m L烧杯中,加入搅拌子后缓缓开启搅拌,称取0.5g(精确至0.001g)黄原胶样品,将其缓慢的加入,之后将整个烧杯口用保鲜膜进行密封,将速率档调至中部(约800r/min),在搅拌台上搅拌0.5h,待搅拌均匀后可直接取样进行测定。
1.4 测定条件
1.4.1 酶膜安装以及激活 在SBA生物传感器配备的过氧化氢电极上安装乙醇酶膜,之后用乙醇酶膜特定缓冲剂对整个体系进行缓冲清洗,开机激活酶膜,等待2h之后进行测定。每次开机仪器会自动清洗一次,进样灯(绿灯)亮并闪动,当屏幕处于自动零状态的0值时,把吸取好的25μL 0.1g/L的乙醇标准溶液注入进样口。反应结束后,仪器自动开始定标,屏幕显示设定的标值为200,并自动清洗反应池,反复测定乙醇标准溶液,当仪器稳定后,即前后两针的结果相对误差小于1%时,仪器便自动定好标,标志是进样灯(绿灯)一直亮但不闪动。
1.4.2 定量分析 定标完成后对不同浓度标准溶液进样做标准曲线,首先对乙醇标准溶液进行逐级稀释,将其配制成0.001、0.002、0.003、0.006、0.013、0.025、0.050、0.100g/L的乙醇系列标准稀释液,对上述标准稀释液进样,得到生物传感器面板上相对应的显示值,此时以显示值对乙醇浓度作图,拟合标准曲线,得到其线性方程,确保标准曲线系数R2≥0.99。
用预先处理好的试液清洗微量进样器,至少三次。准确吸取25μL试液,用滤纸擦干针尖外部,注入进样口,20s后读取显示值。同一样品进样测定三次,将测定值带入线性方程计算试液中的乙醇质量分数。为了确保实验数据的准确性,测定过程中需保证生物传感器只开启单侧的响应开关。
1.5 数据处理
黄原胶样品中乙醇质量分数由以下公式进行计算:

式中:Y为黄原胶样品中乙醇的检出量,%;C为由线性回归方程计算出的样品中乙醇的质量浓度,g/L;V为样品加水体积,100m L;m为样品的质量,g。
2 结果与分析
2.1 方法优化
2.1.1 样品前处理条件优化
2.1.1.1 样品称样量优化 由于黄原胶样品本身具有一定的粘性,前处理过程中首先要确定其称样量以及加水体积,对不同称样量黄原胶样品处理后进行检测比对,比对数据见表1。
样品称样量的选取原则,主要是保证样品称样量足够大,以确保痕量乙醇检测的准确性;加水体积的选取,一方面是考虑加入足够量的水能够使样品充分溶解并且搅拌均匀,另一方面是保证搅拌完成之后能够用生物传感仪自带的50μL进样针吸取后进样。表1中首先尝试了0.5g的称样量,加水50m L搅拌后测定,由于加水量少导致黄原胶粘度过大,无法用进样针吸取进样。后尝试加水100m L以及200m L搅拌进样,检测情况良好,但加入200m L水导致样品搅拌后过稀,会影响检测的稳定性及准确性。参考了0.5g称样量、100m L的加水规格,以相同的稀释倍数选择称取了1、2g的黄原胶样品搅拌测定,从表1数据可知测得乙醇质量分数稳定性良好。鉴于0.5g的称样量能够满足检测需求,考虑到检测的经济性,确定称取0.5g样品,加水100m L做为样品最终称样条件。

表1 样品称样量优化实验Table 1 The optimization experiment forweightmeasurement of sample
2.1.1.2 样品搅拌时间优化 样品测定中需要在一定速率下进行搅拌,称取黄原胶0.5g,加水100m L,对其搅拌时间的比对实验数据见表2。

表2 样品搅拌时间优化实验Table 2 The optimization experiment formixing time of sample
从表2可知,样品搅拌0.5h后测得黄原胶样品中乙醇质量分数趋于稳定,说明样品搅拌0.5h即可搅拌均匀,此优化条件极大的缩短了批量测定中的前处理时间,方便了测定。
2.1.2 仪器条件优化 本实验经过前期的文献查阅,对于生物传感器进样反应时间以及清洗时间进行了优化,生物传感器厂家推荐最短清洗时间为25s。
称取黄原胶0.5024g,加水100m L,对反应时间从5s开始进行了考察,优化实验比对结果见表3。

表3 仪器条件优化实验Table 3 The optimization experiment for instrument condition
由表3可知,仪器反应20s之后再延长仪器反应时间,在清洗时间40s之后,黄原胶样品中乙醇质量分数趋于稳定。在厂家推荐清洗时间为25s的条件下,测得乙醇质量分数较低,继续延长清洗时间为40s乃至更长,此时黄原胶样品中乙醇质量分数趋于稳定。分析原因为,厂家推荐清洗时间是针对非粘性的溶液,但黄原胶样品粘性大,25s的清洗时间并不能彻底清洗反应腔,可能会有一定黄原胶残留。但生物传感仪中反应腔的体积是固定的,黄原胶的残留会导致样品进样量降低,从而导致乙醇质量分数偏低。综合以上数据可知,仪器反应为20s,清洗时间为40s,即可将单个反应进行完全,整个测定时间控制在1m in。每个样品重复测定3次取平均值,进而可计算黄原胶样品中乙醇质量分数,进样10针后需要进行1次定标。
2.2 线性回归方程与方法定量限
在优化条件下,考察了乙醇标液的线性范围,以乙醇标准溶液浓度为横坐标,以生物传感器面板上相对应的显示值测定三次的平均值为纵坐标作图。结果显示,乙醇标准溶液在0.003~0.1g/L质量浓度范围内均呈良好的线性关系,相关系数为0.9994,同时计算了方法的最低检出限(S/N=3)为0.02%,方法的定量限(S/N=10)为0.07%。线性标准曲线见图1。

图1 乙醇线性标准曲线Fig.1 The linear standard curve of ethyl alcohol
2.3 方法的回收率
按照标品浓度为1、2、5倍定量限的原则,在黄原胶样品中添加三个不同浓度的乙醇标液,测得不同添加浓度下的回收率在83.3%~93.3%之间,结果见表4,说明前处理过程中损失或沾污较少,样品前处理方法可靠。

表4 加标回收实验Table 4 Recovery experimentof themeasured results
2.4 方法的精密度与相对标准偏差
采用本方法测定了两批黄原胶样品中乙醇质量分数,平行测定5次,同时计算其标准偏差以及相对标准偏差,结果见表5。表5数据显示两批样品的乙醇质量分数平行性较好,其标准偏差均为0.01%,相对标准偏差分别为2.74%和2.32%。
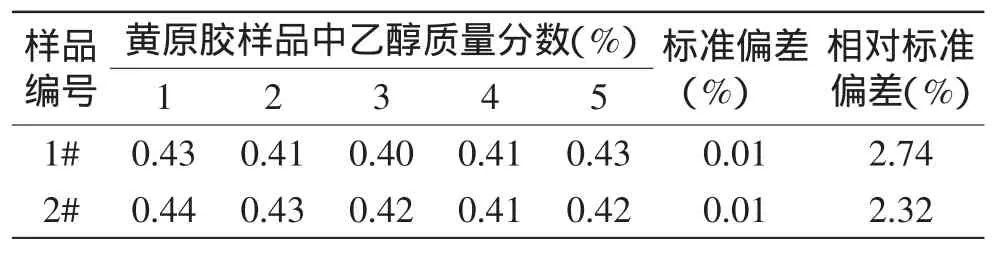
表5 精密度实验Table 5 Precision experimentof themeasured results
2.5 方法的稳定性
采用本方法对同一批样品在不同天数的酶电极法测定情况进行了考察,平行测定5次,取平均值,结果见表6。从结果可知,7d测定的乙醇质量分数均较稳定,说明此方法对样品测定的稳定性较好。
2.6 方法的重现性
将同一黄原胶样品放置30、60d之后采用本方法对乙醇测定情况进行了考察,每个样品测定5次,取平均值,结果见表7。从结果可知,测定的乙醇质量分数平均值为0.42%,说明此方法对同一样品在放置一段时间之后测定的条件下重现性较好。
2.7 与气相色谱法的比对
应用FCCV[21]中黄原胶产品挥发性气体检测方法蒸馏提取-气相色谱法对黄原胶中的乙醇质量分数进行检测,此方法以叔丁醇作为内标物,配制乙醇标
准曲线;前处理对样品进行蒸馏,蒸馏环节称取0.5g样品后加入300m L的水,边搅拌边加热蒸馏提取1h,之后往蒸馏瓶中加入4m L叔丁醇进行乙醇提取;进样环节设定进样口及检测器温度为200℃,柱温为165℃,取样0.5μL进行检测分析。同时用酶电极法检测,同一样品测定三次,两方法比对发现结果并没有显著性差异,结果见表8。

表6 稳定性实验Table 6 Stability of themeasured results

表7 重现性实验Table 7 Reproducibility experimentof themeasured results

表8 同气相色谱法比对结果Table 8 Result comparison with gas chromatography
蒸馏提取-气相色谱法操作复杂,检测所用的色谱柱昂贵,前处理以及上机检测时间长,检测成本高。相对而言,酶电极法前处理简单,上机检测时间短,所需的耗材为乙醇酶膜,价格比较便宜,此检测方法优势显著。
3 结论
本实验实现了酶电极法对黄原胶产品中的乙醇的快速检测。本实验同时优化了仪器的进样条件和样品的前处理条件,实现了样品检测的及时性,取得了较好的检测结果。结果显示:乙醇标准溶液线性相关性较好,相关系数为0.9994,方法检出限为0.02%;在黄原胶产品中添加一定量的乙醇标准溶液后,测得其不同浓度下的添加回收率在83.3%~93.3%之间,其精密度实验平行测定5次得到的相对标准偏差(RSD)均在3%以下,以上数据均说明方法的可行性较高。此方法可作为一种较低成本的检测方法在企业中进行推广应用,且前处理简单、快速、回收率高、精密度好,由于乙醇酶膜本身的特异性响应,杂质的存在不会影响乙醇的定量分析,极大的保证了检测的准确性。酶电极法作为测定黄原胶产品中乙醇的一种简单快速的生物传感仪速测方法,对于企业具有较高的实际应用价值。
[1]刁虎欣,赵大健,袁锡琳,等.国产食品添加剂黄原胶的质量检测和质量标准[J].食品与发酵工业,1990(2):55-57.
[2]Jansson PE,Keene L,Lindberg B.Structureof theextracekkuar polyasacchaursde from xanthomonas camptris[J].Carbo hyd Res,1985,45:275-282.
[3]Papagianni M,Psomas SK,Batsilas L.Xanthan production by Xanthomons campestris in batch cultures[J].Process Biochemistray,2001,37:73-80.
[4]USP.附录Chemical Tests(467) ORGANIC VOLATILE IMPURITES[S].2004.
[5]中国国家质量监督检验检疫总局.GB 13886-2007食品添加剂黄原胶[S].北京:中国标准出版社,2007.
[6]马美范,张印贞.化学氧化法测定白酒中乙醇含量的研究[J].酿酒科技,2007(2):93-94.
[7]刘春英,弓晓峰,张振辉.刚果红吸光光度法测定酒中乙醇含量[J].理化检验-化学分册,2006,42(10):855-856.
[8]何川,章登政,张俊,等.重铬酸钾-DNS比色法测定发酵液中乙醇含量[J].生命科学研究,2013,17(1):1-4.
[9]葛奉娟,王欲晓,周俊,等.重铬酸钾氧化比色法和气相色谱法定量分析发酵液中乙醇的比较研究[J].徐州工程学院学报,2011,26(2):64-68.
[10]裴茂清,郭凌燕.顶空气相色谱法在乙醇分析中的应用[J].广东公安科技,2003(1):8-9.
[11]李艳清,付大友,王蓉.食醋中乙醇含量的测定[J].四川理工学院学报,2009,22(1):72-74.
[12]XU Rong,GONG Qian.The application of optical fiber sensing technology inmultiphase flow parametermeasurement[J]. JournalofEng CollegeofArmed Police Force,2000,16(6):21-24.
[13]刘志鹏,杨海麟,夏小乐.果醋发酵液残留乙醇含量的快速检测[J].食品工业科技,2012,33(12):79-82.
[14]申放,黄婉峰,高卫东.藿香正气水中乙醇含量测定方法研究[J].中国现代医药,2009,11(6):32-33.
[15]陈霞.葡萄酒中乙醇含量的气相色谱法测定[J].中国酿造,2010(9):152-154.
[16]赵新涛.气相色谱法测定生物样品中乙醇含量的方法研究[J].河南预防医学杂志,2012,23(1):19-20.
[17]黄姣,马明,陈丹超.气相色谱法测定香水中乙醇含量的方法研究[J].分析科学学报,2012,28(6):874-876.
[18]MalmqvistM.Biospecific interaction analysis using biosensor technology[J].Nature,1993,361:186-187.
[19]毕春元,田永忠,李保国,等.酶电极法测定玫瑰酒中的乙醇含量[J].中外葡萄与葡萄酒,2008(6):64-65.
[20]冯东,王丙莲,梁晓辉,等.生物传感器在纤维素乙醇测定中得应用[J].农业工程学报:增刊,2011(27):313-316.
[21]CommitteeOn Food ChemicalsCodex.Food ChemicalsCodex V[E].Washington,D.C,2004.
Rapid determination for ethyl alcohol in xanthan gum byenzyme electrode
YANG Ying
(Meihua BioTech(Langfang)Co.,Ltd.,Langfang 065001,China)
The ethyl alcohol in xanthan gum was determined by enzyme electrode,the instrument conditions andthe pre-treatment conditions were further optimized. The results showed that this method had excellent linearrelationship with the correlation coefficient of 0.9994 and the detection limit of the method was 0.02% . Thedetection rate of instrument was 20s. The recovery rates were 83.3%~93.3% and the relative standard deviationwere all below 3%. This developed method was easy,sensitive and reliable,which could be used to analyzeethyl alcohol in xanthan gum.
enzyme electrode;xanthan gum;ethyl alcohol;rapid detection
TS207.3
:A
:1002-0306(2014)16-0082-04
10.13386/j.issn1002-0306.2014.16.009
2013-11-20
杨瑛(1987-),女,硕士研究生,研究方向:农产品安全。
