HPLC法检测海藻糖的研究
2014-02-24赵伟段莹莹张曰辉曹大鹏周生民冯文红
赵伟,段莹莹,张曰辉,曹大鹏,周生民,冯文红
(山东福洋生物科技有限公司,山东德州253100)
HPLC法检测海藻糖的研究
赵伟,段莹莹,张曰辉*,曹大鹏,周生民,冯文红
(山东福洋生物科技有限公司,山东德州253100)
建立了一种利用高效液相色谱法检测葡萄糖、麦芽糖和海藻糖混合溶液中海藻糖的方法。采用Xbridge-NH2色谱柱,流动相为乙腈/水=4∶1加0.1%的氨水,流速1.0 mL/min,柱温35℃,该条件下葡萄糖、麦芽糖、海藻糖能完全分开,葡萄糖、麦芽糖、海藻糖的质量浓度在0.1~4.0 g/100 mL范围与峰面积呈良好线性关系,相关系数R2为0.999 8~0.999 9,相对标准偏差为1.60%,回收率为98.2%~99.4%。
高效液相色谱法;检测;海藻糖;混合溶液
海藻糖是一种被称为生命之糖的非还原性二糖,有使细胞膜及蛋白质等生物大分子稳定的作用[1],能使干燥脱水后的生物体以极低乃至停止新陈代谢的形式被保护,一旦环境许可,生物体即能复活,而不损害生命物质[2]。海藻糖能保护酵母菌的胞吞作用不受其产生的酒精的抑制[3],海藻糖的强表达能提高在高渗透压下大肠杆菌的生长能力[4],海藻糖在食品、医药、保健、化妆品以及农作物育种方面也有广泛的应用[5]。海藻糖的生物合成方法有利用生物自然合成[6-8]和酶法合成[9-13]。海藻糖合成酶是由NISHIMOTO T等[13]从脂肪杆菌属(Pimelobacter sp.)R48和水生栖热菌(Thermus aquaticus)中最早发现并提纯的。国际上,日本等国以淀粉为原料,通过酶法反应成功进行了海藻糖的工业化生产,为其的进一步应用奠定了良好的基础[2]。海藻糖转化酶能够将麦芽糖转化为海藻糖[10]。有很多方法可以对海藻糖的含量进行测量,如高效液相色谱(high performance liquid chromatography,HPLC)法[6-12]、蒽酮-硫酸法[13]、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法[14]等,但是这些方法不能简便准确的测定溶液中海藻糖、麦芽糖和葡萄糖的含量。为了对海藻糖转化酶的反应条件进行优化,需要测定海藻糖转化率,本研究用示差折光检测器和氨基柱的高效液相色谱法对溶液中海藻糖所占比例进行测定,该方法能够准确测定混合溶液中海藻糖,麦芽糖和葡萄糖各自的含量,比其他方法更加简便准确,以期为海藻糖工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
海藻糖、麦芽糖、葡萄糖:美国Sigma公司;乙腈(色谱纯):西陇化工股份有限公司;氨水:莱阳市康德化工股份有限公司。
1.2 仪器与设备
LC-20 AT型HPLC色谱仪(配Waters515泵、Waters 2414型示差折光检测器、N2000双通道色谱工作站、柱温控制系统):美国Waters公司。
1.3 方法
1.3.1 色谱条件
色谱柱:XBridgeTMNH2(3.5 μm×4.6 μm×250 mm);柱温:35℃;流动相:V乙腈∶V水=4∶1,配好后加0.1%氨水;流速:1.0 mL/min;检测器温度:40℃。
1.3.2 混合标准溶液的配制
分别准确称取葡萄糖、麦芽糖、海藻糖各1.000 0 g,将这三种糖定容至100 mL容量瓶中,摇匀后超声混匀20 min,进样前用0.22 μm的滤膜过滤。
1.3.3 标准曲线的制作
用超纯水分别配制质量浓度分别为0.1 g/100 mL、0.2 g/100 mL、0.4 g/100 mL、0.8 g/100 mL、1.6 g/100 mL、3.2 g/ 100mL、4.0g/100mL葡萄糖、麦芽糖、海藻糖的标准溶液,HPLC分析后绘制标准曲线,得到线性回归方程和相关系数(R2)。
2 结果与分析
2.1 检测条件的确定
文献中测定海藻糖一般用氨基柱,流动相为V乙腈∶V水为4∶1,流速为1 mL/min,但是本试验用Xbridge-NH2色谱柱时测得的麦芽糖和海藻糖均为驼峰,在流动相中加入0.1%的氨水后,驼峰消失,峰型良好,由于氨水易挥发,不会对仪器设备产生影响,因此本试验选用其作为胺修饰剂,葡萄糖、麦芽糖和海藻糖的分离效果好,能够准确的测量各糖的含量,满足分析溶液中海藻糖的含量。
2.2 组分的定性定量分析
分别进1%的葡萄糖、麦芽糖和海藻糖的标准品,根据保留时间定性分析,根据外标法进行定量分析,然后进混合标准品,结果分离度良好,混合标准品色谱图见图1。

图1 混合标准品色谱图Fig.1 Chromatogram of mixed standards
2.3 标准曲线与回归方程
以糖质量浓度(x,g/100 mL)为横坐标,峰面积(y)为纵坐标,葡萄糖、麦芽糖及海藻糖HPLC标准曲线见图2,相关系数与回归方程见表1。
由表1可知,葡萄糖、麦芽糖、海藻糖的质量浓度为0.1~4.0 g/100 mL时与峰面积呈良好线性,相关系数R2为0.999 8~0.999 9。
2.4 精密度试验
对海藻糖标准品所配溶液连续进样6次,测定其峰面积,结果见表2。
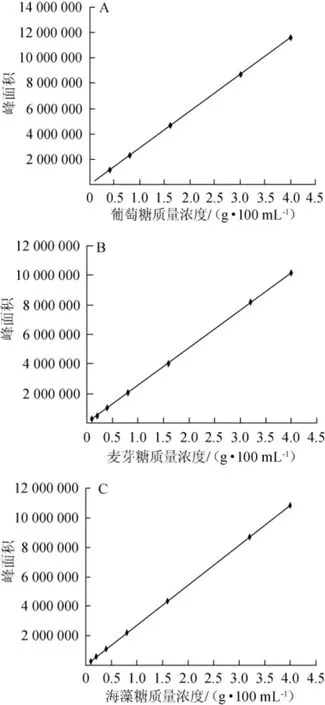
图2 葡萄糖(A)、麦芽糖(B)及海藻糖(C)的HPLC标准曲线Fig.2 Standard curve for HPLC analysis of glucose(A),maltose(B) and trehalose(C)

表1 相关系数与线性方程Table 1 Correlation coefficient and linear equation

表2 精密度试验结果Table 2 Results of precision test
由表2可知,相对标准偏差(relative standard deviation,RSD)为1.60%,在5.0%误差范围内,说明该方法精密度良好。
2.5 回收率试验
取三份样品分别加葡萄糖、麦芽糖、海藻糖标准品,回收率结果见表3。
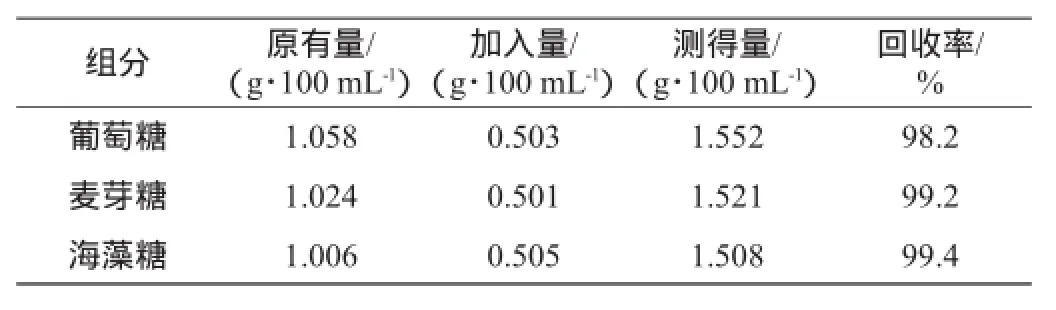
表3 回收率试验结果Table 3 Results of recovery test
由表3可知,这三种糖的回收率为98.2%~99.4%,符合回收率在95%~105%的标准,说明该方法具有较好的准确度。
3 结论
本试验建立了用Xbridge-NH2色谱柱测定海藻糖的HPLC方法,同时摸索出使葡萄糖、麦芽糖、海藻糖三种混合物完全分离的测定方法,相关系数R2为0.999 8~0.999 9,相对标准偏差(RSD)为1.60%,回收率为98.2%~99.4%。该法简单快捷、灵敏度高、重现性好,可用于研究或生产海藻糖的含量测定。
[1]PENNA M,FERMANDES R.Stabilization against thermal nactivation promoted by sugars on enzymes tructure and function:why is trehalose more effective than other sugars[J].Arch Biochem Biophys,1998,360 (1):10-14.
[2]陈海健.海藻糖的提取方法和性质研究[J].广东化工,2013,40(11):121-122.
[3]LUCERO P,PENALVER E,MORENO E,et al.Internal trehalose protects endocytosis from inhibition by ethanol in Saccharomyces cerevisiae [J].Appl Environ Microbiol,2000,66(10):4456-4461.
[4]PURVIS J E,YOMANO L P,ENHANCED L O.Trehalose production improves growth of Escherichia coli under osmotic stress[J].Appl Environ Microbiol,2005,71(7):3761-3769.
[5]徐娟,袁卫涛,杨海军.海藻糖的生产及市场应用[J].添加剂与营养,2012(1):52-53.
[6]杨平,李敏惠,潘克俭.等.海藻糖的生物合成与分解途经及其生物学功能[J].生命的化学,2006,26(3):233-236.
[7]马莺,刘巧红.海藻糖的生物合成及相关酶系[J].中国甜菜糖业,2005(1):24-28.
[8]刘建龙,王瑞明,杨连生.海藻糖的生产方法[J].现代化工,2005,25(1):23-29.
[9]蒙健宗,陈发忠,王青艳,等.重组海藻糖合成酶工程菌的pH-stat高密度发酵工艺研究[J].食品工业科技,2006,27(8):125-128.
[10]刘建龙,谭海刚,王瑞明,等.麦芽糖生物合成海藻糖的途径及合成条件的研究[J].食品添加剂,2006,27(5):161-163.
[11]戴秀玉,吴大鹏,周坚.大肠杆菌海藻糖合成酶基因的克隆和表达[J].遗传学报,2000,27(2):158-164.
[12]韦航,马少敏,张云光.等.海藻糖的酶转化法生产技术[J].安徽农业科学,2010,38(22):12016-12018.
[13]NISHIMOTO T,NAKAON M,NAKADA T,et al.Purification and properties of a novel enzyme,trehalose synthase,from Pimelobacter sp. R48[J].Biosci Biotech Biochem,1996,60(4):640-644.
[14]王成君,林建平,岑沛霖.高效液相色谱法快速检测海藻糖[J].江南大学学报,2005,4(5):522-525.
[15]廖静.海藻糖分析方法的研究[J].微生物学通报,2004,31(5):96-100.
[16]甘宾宾.高效液相色谱法测定海藻糖[J].化工技术与开发,2003,32(1):22-23.
[17]何秀全,彭明,张家明.HPLC-ELSD法测定木薯叶片中海藻糖的含量[J].热带作物学报,2013,34(4):751-754.
[18]韩少卿,彭奇均.HPLC法测定酵母中海藻糖[J].中国食品添加剂,1996,19(4):107-106.
[19]荣绍丰,张海平,段作营.HPLC在研究微杆菌D-97胞内酶合成海藻糖机制中的应用[J].食品与发酵工业,1996,28(7):24-28.
[20]HERBRETEAU B,LAFOSSE M,MORIN-ALLORY L,et al.High performance liquid chromatography of raw sugars and polyols using bonded silica gels[J].Anal Chim Acta,1992,33(7):325-330.
[21]李艳玲,张显忠,苗苗,等.蒽酮-硫酸法测定海藻糖含量显色条件的改进[J].食品工业科技,2009,30(2):296-298.
[22]王蕾,郑璞.DNS法定量测定海藻糖的研究[J].食品科技,2004(2):82-84.
[23]王俊峰,尹尧,王萍萍.高温海藻糖合酶释放处理条件及其酶学性质的研究[J].安徽农业科学,2010,38(2):11673-11675,11678.
Determination of trehalose by HPLC
ZHAO Wei,DUAN Yingying,ZHANG Yuehui*,CAO Dapeng,ZHOU Shengmin,FENG Wenhong
(Shangdong Fuyang Biotechnology Co.,Ltd.,Dezhou 253100,China)
A HPLC method for the detection of trehalose in the mix solution of glucose,maltose and trehalose was established.The sample was separated by Xbridge-NH2chromatographic column,using acetonitrile:water=4∶1 supplemented with 0.1%NH4OH as the mobile phase,the flow rate 1.0 ml/min,the column temperature 35℃.Under this condition,glucose,maltose,and trehalose were completely separated.When the concentration of glucose,maltose,trehalose was in the range of 0.1-4.0 g/100 ml,the concentration and the peak area had a good linear relationship,R2was 0.999 8-0.999 9,relative standard deviation was 1.60%,and the recovery rate was 98.2%-99.4%.
HPLC;detection;trehalose;mixed solution
O657.7
A
0254-5071(2014)10-0148-03
10.11882/j.issn.0254-5071.2014.10.036
2014-09-01
赵伟(1979-),女,工程师,硕士,研究方向为微生物发酵。
*通讯作者:张曰辉(1987-),女,工程师,硕士,研究方向为微生物与酶技术。
