HPLC测定六神曲中青蒿素、芦丁和槲皮素含量
2014-02-24谢彦博徐云孙盛相宏宇刘洪章谢秋宏
谢彦博,徐云,孙盛,相宏宇,刘洪章*,谢秋宏*
(1.吉林农业大学生命科学学院,吉林长春130033;2.吉林大学生命科学学院,吉林长春130012)
HPLC测定六神曲中青蒿素、芦丁和槲皮素含量
谢彦博1,徐云2,孙盛2,相宏宇2,刘洪章1*,谢秋宏2*
(1.吉林农业大学生命科学学院,吉林长春130033;2.吉林大学生命科学学院,吉林长春130012)
本研究建立了高效液相色谱法测定六神曲中青蒿素、芦丁和槲皮素成分含量的方法。采用Acchrom XAqua C18色谱柱(4.6 mm× 250 mm,5 μm)。测定青蒿素含量时,用柱前衍生方法,以乙腈-水(60∶40)为流动相;流速0.8 mL/min,紫外检测波长为260 nm,柱温35℃。测定芦丁和槲皮素含量时,以甲醇-0.4%磷酸(50∶50)为流动相;紫外检测波长分别为360 nm(芦丁)和280 nm(槲皮素);流速0.8 mL/min;柱温30℃。结果青蒿素、芦丁和槲皮素可以达到较好的分离。在选定质量浓度范围内线性关系良好(青蒿素R2=0.9991,芦丁R2=0.999 4,槲皮素R2=0.999 5),平均回收率分别为98.6%,101.4%和97.2%,相对标准偏差(RSD)分别为1.65%,0.91%和1.46%(n=5)。该方法简便准确,重复性和稳定性较好,为六神曲的质量评价和控制提供了科学依据。
六神曲;青蒿素;芦丁;槲皮素;高效液相色谱
六神曲(Massa Medicata Fermentata,MMF)又名神曲,是一味应用历史悠久的传统中药曲剂,由辣蓼、青蒿、苍耳、赤小豆、苦杏仁、麦麸和面粉按照一定比例混合后经自然发酵制成[1],具有健脾和胃、消食调中等功效[2]。六神曲各组分比例在《卫生部药品标准》中药成方制剂第19册有记载,其中面粉27.17%、麦麸54.34%、赤小豆1.1%、苦杏仁1.1%、辣蓼5.43%、青蒿5.43%、苍耳草5.43%。《中国药典》2005年版中注明了六神曲的炮制方法[3],从组分比例可以看出,青蒿、辣蓼、苍耳是主要的药用原料。
屠呦呦等[4]从青蒿中发现了青蒿素。青蒿素为具有过氧基团的新倍半萜内酯,具有抗疟、调节免疫功能、抗血吸虫病和祛痰、镇咳、平喘,抑制病毒、细菌等作用[5]。辣蓼中含有芦丁和槲皮素[6]。芦丁又名芸香苷,是天然的黄酮类化合物,维生素P的主要组分之一,具有抗炎止血和抑菌的功效[7]。槲皮素属于黄酮类化合物,是自然界存在的最主要的食物黄酮醇类之一,可用于治疗腹泻、肠炎等症状[8]。青蒿素、芦丁和槲皮素的功效体现了六神曲的功效。
目前六神曲的生产大部分为小作坊式,且市场混乱。各厂家生产配方不统一,对六神曲的质量评价主要通过感官和经验,没有可量化的统一质量标准,因此难以控制和评价六神曲的质量[10]。在六神曲的研究方面,主要集中在对六神曲中的消化酶、发酵机制和微生物的研究[11-14]。
由于青蒿和辣蓼是六神曲的主要中药组分,青蒿素、芦丁和槲皮素的药效体现了六神曲的主要药效。为了探讨青蒿素、芦丁和槲皮素在六神曲中的含量是否可以作为六神曲质量的评价指标,通过高效液相色谱(high performance liquid chromatography,HPLC)法对多个产地的六神曲中的青蒿素、芦丁和槲皮素的含量进行了详细分析。结果表明,它们是六神曲中的重要指标,并建立了HPLC测定六神曲中此三种成分的方法。这些成果为制定六神曲的质量标准和规范提供了科学依据。
1 材料与方法
1.1 材料与试剂
乙腈(色谱纯)、甲醇(色谱纯):Fisher色谱试剂公司;水为高纯水,其余试剂均为国产分析纯。青蒿素对照品:中国药品生物制品检定所,批号为100202-201004;槲皮素、芦丁对照品:上海源叶生物科技有限公司,批号分别为YA0806YB13和20140416;7种六神曲生品分别购自7个具有代表性的产地(山东临沂、陕西汉中、安徽亳州、河北保定、河北安国、四川成都和安徽合肥),并经吉林大学药学院武毅教授鉴定。
1.2 仪器与设备
Waters2695高效液相色谱仪(2489双波长紫外检测器):北京京科瑞达科技有限公司;Acchrom XAqua C18色谱柱(4.6 mm×250 mm,5 μm):北京华谱新创科技有限公司。
1.3 方法
1.3.1 色谱条件
青蒿素测定:流动相水-乙腈(40∶60);检测波长260 nm;流速0.8 mL/min;柱温35℃。芦丁和槲皮素测定:流动相甲醇-0.4%磷酸(50∶50);检测波长分别为360 nm(芦丁)和280 nm(槲皮素);流速0.8 mL/min;柱温30℃。
1.3.2 标准品的制备
精确称取青蒿素10.0 mg,用体积分数为95%的乙醇完全溶解,并于100.0 mL容量瓶中定容,即得0.1 mg/mL的青蒿素标准品溶液。青蒿素生成衍生物Q260的反应原理如图1所示。精确移取青蒿素标准品溶液5 mL于50.0 mL容量瓶中,加入14 mL 0.2%NaOH溶液,置于45℃水浴中反应30 min,流水冷却至室温,加入8 mL 0.08 mol/L的醋酸溶液,充分反应后,用体积分数为95%的乙醇定容,摇匀,即为Q260标准溶液。
精确称取芦丁13.0 mg及槲皮素10.0 mg,分别于100.0 mL容量瓶中用甲醇充分溶解并定容,摇匀,即得芦丁和槲皮素标准品溶液。
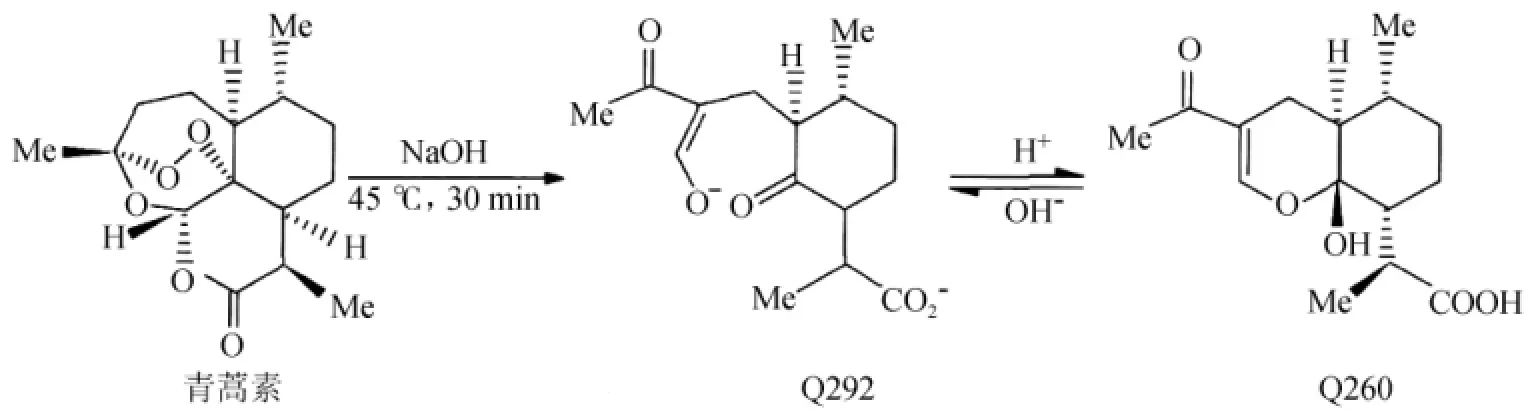
图1 青蒿素柱前衍生过程[15]Fig.1 Pre-column derivatization process of artemisinin[15]
1.3.3 供试品的制备
样品中青蒿素的提取,精确称取20.0 g六神曲于锥形瓶中,加入60 mL石油醚,置于磁力搅拌加热器上恒温50℃加热搅拌提取2 h,离心取上清,置于旋转蒸发仪中50℃蒸干,用适量体积分数为95%的乙醇将浓缩物全部溶解并定容至10 mL,得青蒿素供试品溶液。Q260供试品溶液制备方法参见“1.3.2标准品的制备”。
样品中芦丁和槲皮素的提取,精确称取20.0 g六神曲于锥形瓶中,加入60 mL无水乙醇,40℃超声30 min,离心取上清,置于旋转蒸发仪中40℃蒸干,用适量甲醇将浓缩物全部溶解并定容至10 mL,即为芦丁和槲皮素的供试品溶液。
1.3.4 标准曲线的绘制
青蒿素衍生物标准品溶液质量浓度分别为2 μg/mL、4 μg/mL、6 μg/mL、8 μg/mL、10 μg/mL,芦丁标准品溶液质量浓度分别为13μg/mL、65μg/mL、130μg/mL、195μg/mL、260 μg/mL,槲皮素标准品溶液质量浓度分别为50 μg/mL、100μg/mL、150μg/mL、200μg/mL、250μg/mL,进样10μL,以标准品质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。
2 结果与分析
2.1 对照品及供试品的高效液相色谱图
各对照品、供试品经0.45 μm的微孔滤膜过滤后进样,其青蒿素、芦丁及槲皮素的HPLC图如图2所示。

图2 对照品(A)和样品(B)HPLC图Fig.2 HPLC chromatograms of reference substances(A)and samples(B)
2.2 标准曲线回归方程建立
按照1.3.4节方法,分别制备5个不同质量浓度的青蒿素、芦丁及槲皮素标准品溶液,进样10 μL,以质量浓度为横坐标(X),峰面积(Y)为纵坐标,绘制标准曲线见图3。
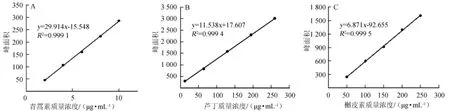
图3 青蒿素(A)、芦丁(B)及槲皮素(C)标准曲线Fig.3 Standard curves of artemisinin(A),rutin(B)and quercetin(C)
将标准曲线进行线性回归,得青蒿素回归方程:Y= 29.914X-15.548,相关系数R2=0.999 1;芦丁回归方程:Y= 11.538X+17.607,相关系数R2=0.999 4;槲皮素回归方程:Y=6.871X-92.655,相关系数R2=0.999 5。
2.3 精密度试验
分别取青蒿素、芦丁和槲皮素供试品溶液各一份,每份样品连续进样5针,测得青蒿素、芦丁和槲皮素的峰面积值并计算相对标准偏差(relative standard deviation,RSD),结果见表1。
由表1可知,青蒿素RSD为0.97%,芦丁RSD为0.83%,槲皮素RSD为0.87%,均<5%,表明该方法精密度良好。

表1 精密度试验结果Table 1 Results of precision tests
2.4 稳定性试验
分别取青蒿素、芦丁和槲皮素供试品溶液各一份,分别于0、2 h、6 h、12 h、24 h进样,分别测定青蒿素、芦丁和槲皮素的峰面积值并计算RSD,结果见表2。

表2 稳定性试验结果Table 2 Results of stability tests
由表2可知,青蒿素RSD为0.93%,芦丁RSD为0.85%,槲皮素RSD为0.90%,均<5%,表明供试品在24 h内稳定。
2.5 重复性试验
精密称取同批六神曲药材10份,按照供试品溶液的制备方法,5份制得青蒿素衍生物供试品,5份制得芦丁和槲皮素供试品,并进样,分别测定青蒿素、芦丁和槲皮素的峰面积值并计算RSD,结果见表3。

表3 重复性试验结果Table 3 Results of repeatability tests
由表3可知,青蒿素RSD为1.02%,芦丁RSD为0.90%,槲皮素RSD为0.96%,均<5%,表明重现性较好。
2.6 加样回收率试验
取已知青蒿素、芦丁和槲皮素含量的六神曲药材15份,每份0.5 g,精密称量,然后将其分为3组,每组中精确加入对照品的量相当于各成分含量的80%、90%、100%、110%、120%,并分别测定青蒿素、芦丁和槲皮素的峰面积值,计算青蒿素、芦丁和槲皮素的平均回收率,结果见表4。
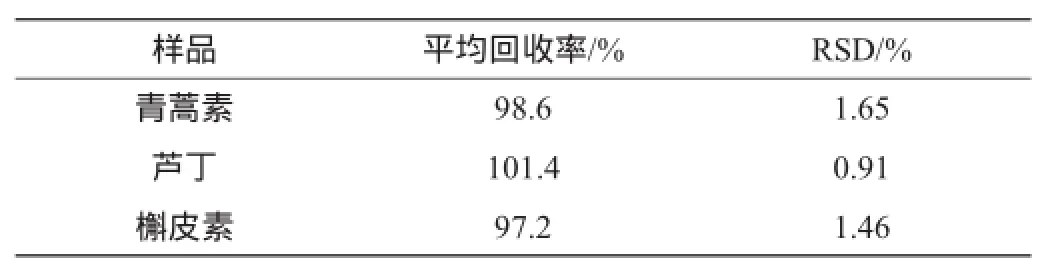
表4 加样回收率试验结果(n=5)Table 4 Results of added sample recovery tests(n=5)
由表4可知,青蒿素平均回收率为98.6%(RSD为1.65%),芦丁平均回收率为101.4%(RSD为0.91%),槲皮素平均回收率为97.2%(RSD为1.46%),说明该方法准确度高。
2.7 六神曲中青蒿素、芦丁和槲皮素含量的测定
对7个产地的六神曲药材,按供试品制备方法制备,并精密进样10 μL,测得青蒿素、芦丁和槲皮素的含量,测定结果见表5。
由表5可知,产地四川成都六神曲中含有青蒿素18.45μg/g,芦丁66.46 μg/g和槲皮素3.80 μg/g。产地安徽亳州六神曲中含有青蒿素7.73μg/g,芦丁61.30μg/g和槲皮素7.23 μg/g。两个产地六神曲中三种有效成分含量均较高,而其他产地的含量波动较大,特别是芦丁和槲皮素含量差异巨大,说明各产地成品的差异外,也说明配方及工艺控制的不同。经过市场调查发现,四川成都是全国12家获批生产六神曲的企业之一,安徽亳州则是目前市场上最大货源地,这两家六神曲的生产控制和成品质量有保障;而其他产地以作坊居多,其品质控制方面存在薄弱环节。

表5 7个产地六神曲中青蒿素、芦丁和槲皮素的含量测定Table 5 Artemisinin,rutin and quercetin analysis in Massa Medicata Fermentata collected from 7 regions
3 结论
通过HPLC检测并定量发酵中药六神曲中青蒿素、芦丁和槲皮素的含量。通过对精密度、稳定性、重复性和加样回收率的检测,在选定质量浓度范围内线性关系良好(青蒿素R2=0.999 1,芦丁R2=0.999 4,槲皮素R2=0.999 5),平均回收率分别为98.6%,101.4%和97.2%,相对标准偏差(RSD)分别为1.65%,0.91%和1.46%(n=5)。证明该方法简单易行,灵敏度高。作为六神曲原材料中的主要中草药,青蒿素是青蒿的主要成分,芦丁和槲皮素是辣蓼的主要成分。它们不仅是六神曲成品的主要药效成分,同时其含量也间接反映原材料中青蒿和辣蓼占的比重。
结果表明,青蒿和辣蓼在六神曲中的比重对其成品品质具有一定的主导作用,青蒿素、芦丁和槲皮素在六神曲中的含量可以作为六神曲质量评价的依据。HPLC法也是目前中药成分分析的主要方法,本研究结果可为六神曲的质量控制和评价提供依据。
[1]高慧,贾天柱.神曲的研究进展[J].时珍国医国药,2002,13(8):491-493.
[2]陈缤.神曲的炮制工艺研究[D].大连:辽宁中医学院硕士论文,2005.
[3]国家药典委员会.中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2012.
[4]屠呦呦.抗疟新药—青蒿素和双氢青蒿素[C]//世界中西医结合大会.北京:世界中西医结合大会论文摘要,1997.
[5]TU Y Y.The discovery of artemisinin(qinghaosu)and gifts from Chinesemedicine[J].Nat Med,2011,17(10):1217-1220.
[6]张国英,曾韬.辣蓼主要化学成分的研究[J].林产化学与工业,2005,25(3):21-24.
[7]耿旦,马雯芳,甄汉深,等.RP-HPLC测定桑葚中芦丁的含量[J].中国实验方剂学杂志,2011,17(14):63-65.
[8]孙涓,余世春.槲皮素的研究进展[J].现代中药研究与实践,2011,25(3):85-88.
[9]任巧玲,宋潇潇.六神曲质量情况分析[J].中国现代药物应用,2010,10(4):113-114.
[10]练晶军.六神曲质量特征及发酵变化研究[D].北京:北京中医药大学硕士论文,2011.
[11]XU Y,XIE Y B,ZHANG X R,et al.Monitoring of the bacterial and fungal biodiversity and dynamics during Massa Medicata Fermentata fermentation[J].Appl Microbiol Biotechnol,2013,97(22):9647-9655.
[12]王海洋,高文远,张丽霞.六神曲不同的制备工艺对其淀粉酶活力的影响[J].中国中药杂志,2012,37(14):2084-2087.
[13]邬吉野,李莹,王德馨,等.六神曲的发酵菌种分离及纯种发酵考察[J].中国实验方剂学杂志,2013,19(16):12-14.
[14]徐云,郑璐,相宏宇,等.六神曲发酵过程中5种消化酶的动态分析[J].中国酿造,2012,31(10):43-45.
[15]张荣沭,王炎,赵敏.黄花蒿中青蒿素的柱前衍生HPLC-UV分析[J].林产化学与工业,2009,29(3):115-119.
Determination of artemisinin,rutin and quercetin in Massa Medicata Fermentata by HPLC
XIE Yanbo1,XU Yun2,SUN Sheng2,XIANG Hongyu2,LIU Hongzhang1*,XIE Qiuhong2*
(
1.School of Life Sciences,Jilin Agricultural University,Changchun 130033,China; 2.School of Life Sciences,Jilin University,Changchun 130012,China)
HPLC method was described for determining the contents of artemisinin,rutin and quercetin in Massa Medicata Fermentata(MMF).Chromatography separation was performed on HPLC system with Acchrom XAqua C18(4.6 mm×250 mm,5 μm)column.Artemisinin was determined with the method of pre-column reaction and isocratic elution with mobile phase acetonitrile/water(60∶40),the flow rate was 0.8 ml/min,and UV detection wavelength and temperature was 260 nm and 35℃,respectively.Rutin and quercetin were determined under the condition of mobile phase methanol/0.4%phosphoric acid(50∶50),flow rate 0.8 ml/min,temperature 30℃,detection wavelength 360 nm for rutin and 280 nm for quercetin, respectively.The results indicated that the separation of artemisinin,rutin and quercetin was good.A good linearity was observed in the selected concentration range(artemisinin R2=0.999 1,rutin R2=0.999 4 and quercetin R2=0.999 5).The average recoveries of the three compounds were 98.6% (RSD 1.65%),101.4%(RSD 0.91%)and 97.2%(RSD 1.46%)(n=5),respectively.The method was simple with good accuracy and reproductivity and it can be applied for quality evaluation and control for Massa Medicata Fermentata.
Massa Medicata Fermentata;artemisinin;rutin:quercetin;HPLC
R282.71
A
0254-5071(2014)10-0140-05
10.11882/j.issn.0254-5071.2014.10.034
2014-09-12
吉林省科技厅医药产业化推进项目(20130727036YY);吉林省科技厅重大科技攻关项目(20140203001YY,20140203024NY);重点攻关项目(20130206009SF)
谢彦博(1988-),男,硕士研究生,研究方向为生物大分子结构与功能的研究。
*通讯作者:谢秋宏(1967-),女,教授,博士,研究方向为微生物与生化药学。
刘洪章(1957-),男,教授,博士,研究方向为生物药资源。
