鲤春病毒血症病毒糖蛋白在杆状病毒表达系统中的表达与鉴定
2014-02-24,,,,,,,,,,
,,,,,,,,,,
(1.华中农业大学水产学院,湖北武汉 430070;2.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518001)
鲤春病毒血症病毒糖蛋白在杆状病毒表达系统中的表达与鉴定
刘红1,郑晓聪2,于力2,王津津2,贾鹏2,何俊强2,史秀杰2,兰文升2,叶奕优2,刘荭2,吴志新1
(1.华中农业大学水产学院,湖北武汉 430070;2.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 518001)
本实验利用杆状病毒表达系统表达鲤春病毒血症病毒(SVCV)糖蛋白。将SVCV糖蛋白基因(G)插入到供体质粒pFastBacHTA中,再用构建的质粒pFastBac-G转化E. coli DH10αBac感受态细胞,经蓝白斑筛选,获得含G基因的重组穿梭载体Bacmid-G。通过脂质体介导将Bacmid-G转染对数生长期的Sf9细胞,获得重组杆状病毒AcNPV-G。AcNPV-G感染Sf9细胞,超声破碎后离心取上清进行SDS-PAGE及Western Blot试验,结果可见大小约为57 kDa的蛋白条带,并与羊抗SVCV血清发生特异性反应。间接免疫荧光试验在感染AcNPV-G的Sf9细胞中观察到荧光信号。试验结果表明,AcNPV-G在Sf9细胞中成功的表达了SVCV糖蛋白,且具有良好的免疫学活性。
鲤春病毒血症病毒;糖蛋白;杆状病毒表达
鲤春病毒血症病毒(spring viremia of carp virus,SVCV)属于弹状病毒科水泡病毒属[1-2],是鲤科鱼类急性、高致死率的传染病,即鲤春病毒血症(SVC)的病原。该病通常在春季水温10~20℃时流行并引发幼鱼和成鱼大量死亡,暴发时1龄仔鱼死亡率可达70%[3],有资料记载,该病曾给欧洲鲤鱼养殖业造成巨大的经济损失[4]。因此自1993年至今,该病一直被世界动物卫生组织(OIE)列在水生动物疫病名录[1,5-6],是世界各国相关水生动物养殖业积极防控的重点。2003年中国内地首次报道分离出SVCV[7]。2008年起,农业部将此病列入一类动物疫病,SVCV目前是我国水生动物疫病的重点监测对象。
SVCV基因组是单链负RNA,编码5种结构蛋白:核蛋白(N)、磷蛋白(P)、膜蛋白(M)、糖蛋白(G)和病毒RNA依赖RNA聚合酶(L)[1,4,8]。其中糖蛋白在病毒表面形成三聚体,它与细胞膜受体结合并介导病毒内吞作用[9-10]。表面糖蛋白是病毒最主要的抗原,它决定了病毒的血清学特征,可引起免疫应答[11]。SVCV糖蛋白能与抗SVCV单克隆抗体发生反应,含有SVCV-G基因的DNA疫苗能保护鱼不受SVCV感染[5,11-12]。因此糖蛋白成为研制基因工程抗体的候选基因。
早在上世纪80年代杆状病毒表达系统已广泛应用于重组蛋白的产生[13]。由于杆状病毒表达系统具有对表达蛋白进行翻译后加工、表达产物与天然蛋白的生物活性一致,安全性高等优点[14],因此本研究拟选用昆虫细胞杆状病毒表达系统进行SVCV G基因的表达,为深入研究SVCV糖蛋白的生物学活性及其在病毒侵染过程中的功能和亚单位疫苗的研制奠定基础。
1 材料和方法
1.1 材料
1.1.1 毒株及试剂
SVCV A-1由本实验室分离保存[8];草鱼卵巢细胞(CO)、Sf9细胞、E. coli DH5α、E. coli DH10αBac等由本实验室保存;M199培养基及SF-900 Ⅲ SFM培养基为Gibco产品; AMV-反转录酶、Taq DNA 聚合酶、各种限制性内切酶、T4 DNA 连 接 酶、Marker DL2000、wide range DNA Marker(100-6000 bp)、One Step RNA PCR试剂盒和Agarose Gel DNA Extraction试剂盒为Takara产品;pFastbacHTA载体质粒和Cellfectin Reagent脂质体转染试剂盒为Invitrogen公司产品;QIAGEN RNeasy Mini kit和DNeasy Blood & Tissue kit为QIGEN公司产品;兔抗羊IgG-HRP为Sigma产品;豚鼠抗羊IgG-FITC为CALTAG产品。
1.1.2 引物
根据GenBank中已发表的SVCV G基因序列(AJ318079)设计引物。上游引物GF:GCGGAATTCATGTCTATCATCAGCTACAT(划线处为EcoR I位点),下游引物GR:GCGCTCGAGTTAAACTAAAGACCGCATTT (划线处为Xho I位点)。通用引物M13(上游引物:5’GTTTTCCCAGTCACGAC 3’;下游引物:5’CAGGAAACAGCTATGAC 3’)参考Bac-to-Bac杆状病毒表达系统使用手册设计,引物均由上海生工生物工程公司合成。
1.2 方法
1.2.1 SVCV病毒增殖及RNA提取
将冻存的SVCV病毒悬液接种于24h内长满单层CO细胞的培养皿中,于18℃~20℃ 下在M199培养基中培养直至细胞病变效应(CPE)出现,收集细胞悬液,反复冻融3次后3000g离心10 min,收集上清后利用QIAGEN RNeasy Mini kit提取总RNA (按试剂盒说明书进行操作)。
1.2.2 糖蛋白基因的扩增
采用One Step RNA PCR Kit,以SVCV基因组为模板,以GF、GR为引物扩增糖蛋白基因(G gene),扩增反应体系参照试剂盒说明书,RTPCR反应程序扩增:50℃反转录30 min;94℃预变性2 min;94℃ 30s,55℃ 30s,72℃ 1 min,共30个循环;72℃延伸10 min,4℃保温。用1%琼脂糖电泳检测。
1.2.3 质粒pFastBac-G的构建
用Agarose Gel DNA Extraction Kit回收纯化SVCV-G基因,用EcoR I和Xho I分别对回收产物和pFastbacHTA双酶切,然后用T4连接酶16℃连接过夜,连接产物转化到E.coli DH5α感受态细胞中,重组质粒pFastBac-G经酶切鉴定后将新鲜菌液送华大基因进行测序。
1.2.4 重组穿梭载体Bacmid-G的构建
将重组供体质粒pFastBac-G转化到含有Bacmid和辅助质粒的DH10αBac感受态细胞中进行转座,在含IPTG、X-gal 、卡那霉素、庆大霉素及四环素的LB 平板上进行蓝白斑筛选,挑取白色菌落三次划线纯化,经M13通用引物进行PCR 鉴定后,获得重组穿梭载体Bacmid-G。
1.2.5 重组杆状病毒(AcNPV-G)的获得及鉴定
碱裂解法提取Bacmid-G,利用CellfectinReagent脂质体介导转染适应无血清培养基(SF-900Ⅲ)的Sf9细胞,当发生细胞病变后,收集细胞悬液,离心取上清即获得重组杆状病毒(AcNPV-G),具体操作参照Bac-To-Bac杆状病毒表达系统操作手册及转染试剂盒说明书进行。待80%细胞病变后收集细胞上清,作为P1代重组病毒。将P1代重组病毒继续感染Sf9细胞,经3代扩大培养后,收集细胞培养物上清作为重组病毒母液,4℃避光保存备用。提取重组杆状病毒总DNA基因组,用M13引物进行PCR扩增鉴定。
1.2.6 重组蛋白表达及Western-blot检测
重组杆状病毒感染Sf9细胞72 h后,收集细胞,PBS洗涤2次后超声破碎,-20℃保存备用。用相同的方法处理正常细胞。将超声破碎产物10000g离心10 min后取上清进行SDS-PAGE电泳,电转印到PVDF膜上,用3%BSA室温封闭1 h,PBS洗膜3次后以羊抗SVCV血清为一抗,室温孵育1.5 h,然后PBS洗膜3次,加入1∶3000稀释的HRP标记的兔抗羊IgG,室温孵育1 h,用PBST、PBS各洗膜3次后,加DAB显色液显色,观察特异性条带。
1.2.7 目的蛋白的表达效果的鉴定
将Sf9细胞铺于六孔板,待细胞生长至对数生长期时,将获得的第二代重组杆状病毒AcNPV-G接种于细胞,27℃培养72 h,用预冷的PBS洗涤3次;然后用4℃预冷的丙酮-甲醇(1∶1)固定液于4℃固定10 min,PBS洗涤3次,自然风干;以1% BSA 37℃封闭30 min;加入1∶200稀释的羊抗SVCV血清,37℃作用l h;用PBS洗涤3次后,加入1∶200稀释的FITC标记的豚鼠抗羊二抗,37℃作用l h;用PBS洗涤5次,自然风干;荧光显微镜下观察结果,未感染的Sf9昆虫细胞同时作对照。
2 结果
2.1 SVCV-G基因片段的扩增
SVCV糖蛋白基因经PCR扩增,片段大小约为1530bp(图1)。
2.2 重组转移载体的双酶切鉴定
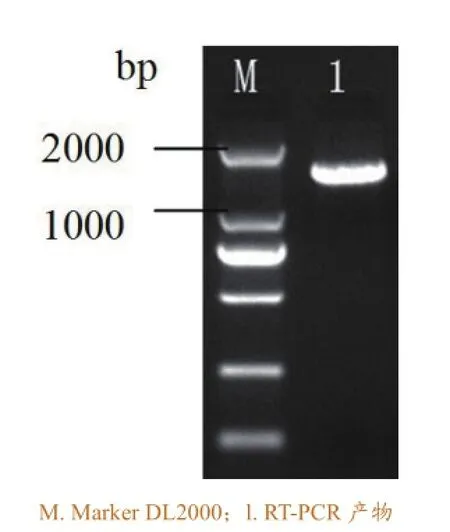
图1 RT-PCR产物电泳图
用EcoR I和Xho I对重组质粒pFastBac-G进行双酶切鉴定,双酶切后产生大小约为1530 bp和 4800 bp的目的条带(图2),与预期结果相符。测序结果表明,该转化菌的质粒中含有目的基因片段,且读码框正确,重组质粒pFastBac-G构建成功。
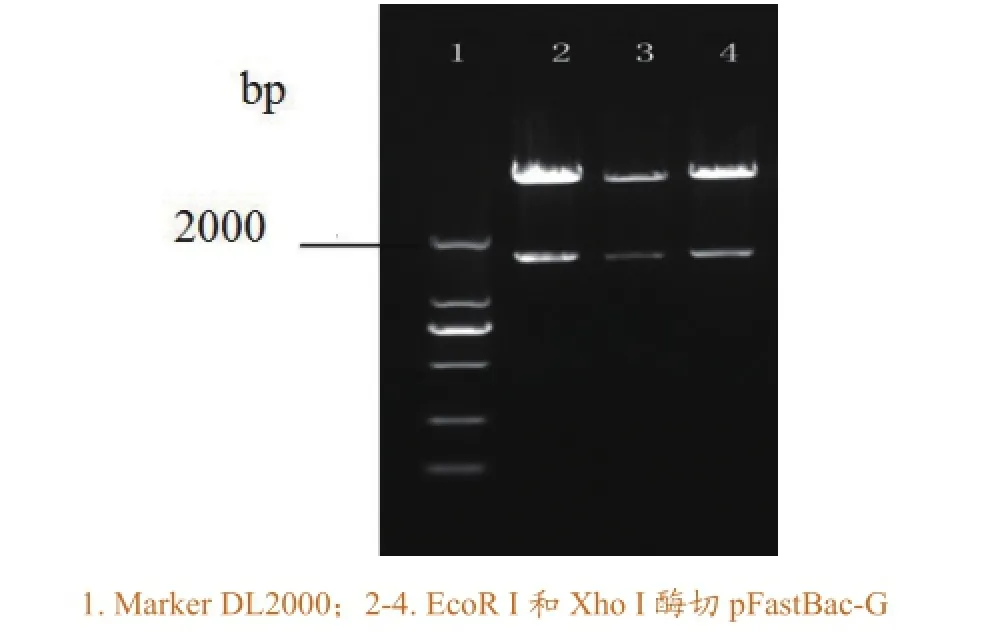
图2 pFastBac-G质粒的双酶切鉴定
2.3 重组杆状病毒的获得
在无血清条件下,用Cellfectin脂质体介导Bacmid-G DNA 转染对数生长期的Sf9细胞单层,逐日观察发现,转染约72 h 后细胞明显出现肿胀变大现象,部分细胞脱落(图3),而对照细胞生长良好,表明已经获得重组杆状病毒AcNPV-G。收集病变细胞培养上清液,低速离心去除细胞及碎片即为目的病毒液。
2.4 重组杆状病毒基因组PCR鉴定
以提取的重组杆状病毒基因组DNA为模板,用通用引物M13进行PCR扩增,经1%琼脂糖凝胶电泳检测,在4000bp左右有一条特异性条带(图4),与预期结果一致。结果表明成功获得含有SVCV糖蛋白基因的重组病毒。
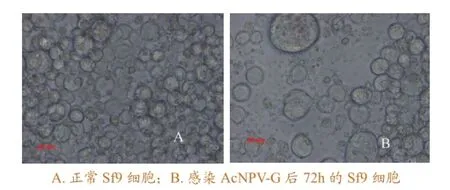
图3 AcNPV-G感染72h后Sf9细胞病变情况
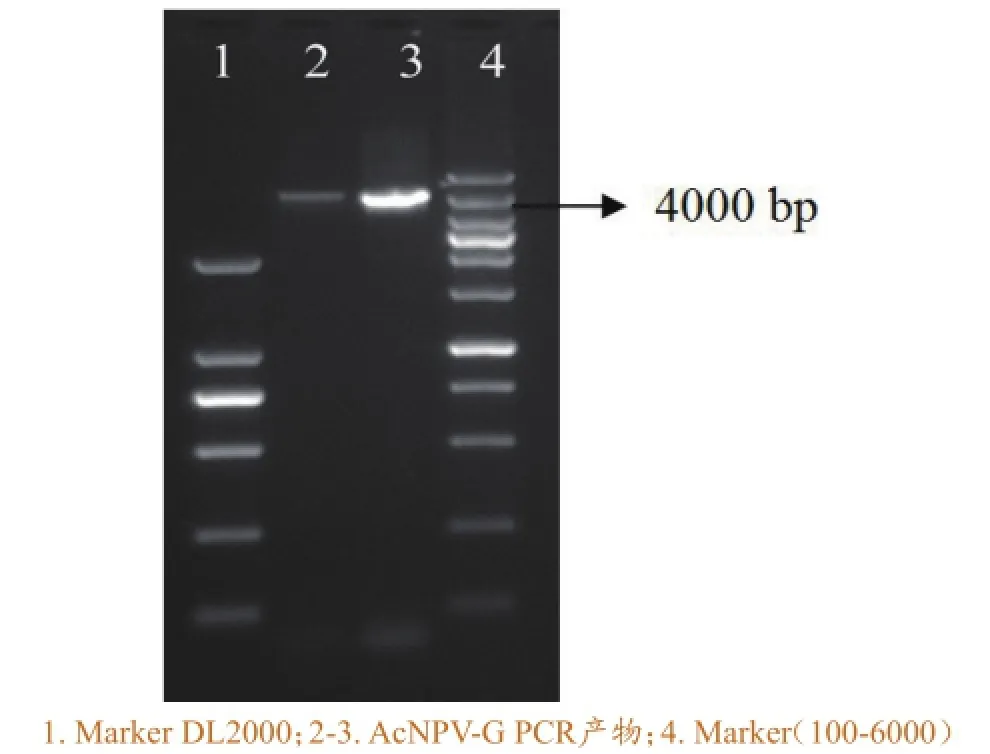
图4重组杆状病毒AcNPV-G的PCR鉴定
2.5 表达产物的SDS-PAGE及Western-blot检测
对感染AcNPV-G 72 h的Sf9细胞超声破碎后进行SDS-PAGE及Western-blot鉴定,以正常细胞为对照。SDS-PAGE结果显示在57 kDa处有明显的条带,而对照组则无此条带(图5A)。Westernblot结果显示57 kDa处有一条特异性条带,而对照组则无(图5B),表明重组蛋白获得表达,且表达产物可与羊抗SVCV血清发生特异性反应,具有良好的免疫学活性。
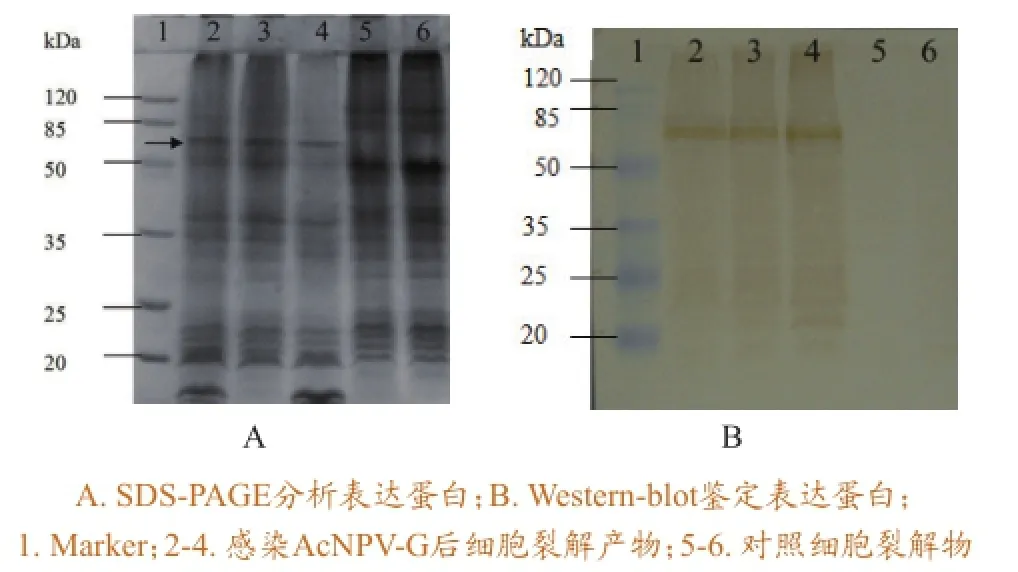
图5表达产物的SDS-PAGE及Western-blot检测
2.6 间接免疫荧光鉴定目的蛋白的表达
间接免疫荧光检测发现AcNPV-G感染的Sf9细胞出现特异性荧光(图6),且荧光在细胞表面,而对照细胞则无特异性荧光,这说明SVCV糖蛋白在昆虫细胞中成功表达,且分布在细胞表面。
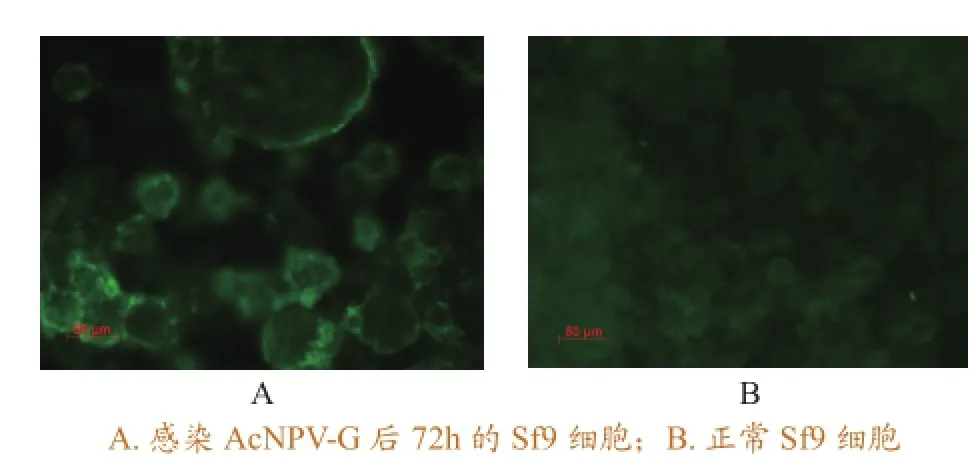
图6间接免疫荧光试验检测目的蛋白表达(400×)
3 讨论
SVCV基因组编码5种结构蛋白(分别N、P、M、G和L)。其中糖蛋白由509个氨基酸组成,位于病毒表面,形成三聚体的囊膜粒子,介导病毒的内吞作用[3,10],是病毒感染时病毒与细胞相互作用的重要因子,其具有丰富的抗原表位,有较强的免疫原性,决定病毒血清学特性[15]。利用基因工程技术表达具有免疫原性的蛋白对免疫检测技术的发展具有重要意义,为深入研究SVCV 糖蛋白的功能及研制有效疫苗,本研究尝试利用杆状病毒表达系统表达SVCV糖蛋白。
目前很多研究采用原核表达系统表达蛋白,虽然原核表达具有操作简单、成本低廉和表达效率高等优点,但原核表达系统翻译后加工修饰体系不完善,包涵体的形成使表达产物的生物活性较低。而杆状病毒表达系统具有对表达蛋白进行翻译后加工、其表达产物与天然蛋白的生物活性一致,且安全性高等优点[14]。目前,已有报道利用杆状病毒载体表达的传染性造血器官坏死症病毒(IHNV)糖蛋白能够诱发极小鱼苗的保护性免疫反应[16],罗卫等[17](2008)在昆虫细胞中成功的表达了病毒性神经坏死病毒(VNNV)的衣壳蛋白,具有良好的免疫学活性。这些研究表明,利用杆状病毒表达系统研制鱼类疫苗将可能为鱼类疫苗研究开辟一条新的途径。
本研究利用杆状病毒Bac-to-Bac表达系统成功地表达了SVCV糖蛋白。对感染细胞培养上清进行重组杆状病毒PCR鉴定,结果表明重组杆状病毒构建成功且重组病毒存在于感染上清中,这与罗卫等(2008)研究结果一致。间接免疫荧光试验结果表明糖蛋白在昆虫细胞中成功表达,根据荧光信号位于细胞表面可以确定表达的糖蛋白分布于细胞表面。目前有研究将抗原蛋白与杆状病毒的囊膜糖蛋白GP64的信号肽序列,跨膜结构域以及胞内结构域进行融合表达,使抗原蛋白定位在昆虫细胞膜表面,当杆状病毒出芽时,抗原蛋白便整合到病毒的囊膜上,因而可以直接收集重组杆状病毒作为疫苗。前人的研究发现弹状病毒的糖蛋白也可以展示在昆虫细胞膜上,并且水疱性口炎病毒(VSV)和狂犬病毒(RV)的糖蛋白已被证明整合在重组杆状病毒囊膜上[18]。本研究同样发现SVCV的糖蛋白可以展示在昆虫细胞膜上,结合前人的研究以及杆状病毒自身的特性,分析SVCV G极有可能也整合到重组杆状病毒囊膜上,并且有可能作为一种抗SVCV的疫苗。
对感染重组病毒的细胞超声破碎后离心取上清进行SDS-PAGE,从电泳图中可以看到分子量约57kDa的蛋白带,说明表达的蛋白是可溶性的,但目的蛋白带较弱,说明存在表达量较低的不足之处。2010年黄锋涛[19]等利用杆状病毒表达系统表达斑点叉尾鮰病毒囊膜蛋白ORF6时,也发现过目的蛋白的表达量不高。这可能与Sf9细胞密码子偏爱性有关。Western-blot结果表明,表达的糖蛋白可以与抗SVCV血清发生特异性杂交反应,具有良好的生物学活性。因此,本研究为今后进一步开展对SVCV糖蛋白的生物活性研究以及亚单位疫苗的研制奠定了基础, 也为发展新型SVCV的快速检测和诊断试剂提供了前提。
[1] Ahne W, Bjorklund H V, Essbauer S, et al. Spring viremia of carp (SVC) [J]. Dis Aqut Org, 2002, 52(3): 261-272.
[2] Liu Z, Teng Y, Xie X, et al. Development and evaluation of a one-step loop-mediated isothermal amplification for detection of spring viremia of carp virus [J]. J Appl Microbiol,2008, 105(4): 1220-1226.
[3] 付 峰,刘 荭,黄 捷,等.鲤春病毒血症病毒(SVCV)的研究进展[J].中国水产科学, 2006,13(2): 328-334.
[4] Hoffmann B, Schutze H, Mettenleiter T C. Determination of the complete genomic sequence and analysis of the gene products of the virus of spring viremia of carp, a fish rhabdovirus [J]. Virus Res, 2002, 84(1/2): 89-100.
[5] Chen Z Y, Liu H, Li Z Q, et al. Development and characterization of monoclonal antibodies to spring viremia of carp virus [J]. Vet Immunol Immunopathol, 2008, 123(3/4): 266-276.
[6] Padhi A, Verghese B. Molecular evolutionary and epidemiological dynamics of a highly pathogenic fish rhabdovirus, the spring viremia of carp virus (SVCV) [J]. Vet Microbiol, 2012, 156(1/2):54-63.
[7] Liu H, Gao L, Shi X, et al. Isolation of spring viraemia of carp virus (SVCV) from cultured koi (Cyprinus carpio koi)and common carp (C. carpio carpio) in P. R. China [J]. Bull Eur Ass Fish Pathol, 2004, 24(4): 204-212.
[8] Teng Y, Liu H, Lv J Q, et al. Characterization of complete genome sequence of the spring viremia of carp virus isolated from common carp (Cyprinus carpio) in China [J]. Arch Virol,2007, 152(8): 1457-1465.
[9] Padhi A, Verghese B. Detecting positively selected codons in the glycoprotein of spring viremia of carp virus (SVCV) isolates from the USA and China [J]. J Fish Dis, 2008, 31(10): 785-791.
[10] Zhang N Z, Zhang L F, Jiang Y N, et al. Molecular analysis of spring viremia of carp virus in China: a fatal aquatic viral disease that might spread in East Asian [J]. PLoS One,2009, 4(7): e6337.
[11] Emmenegger E J, Kurath G. DNA vaccine protects ornamental koi (Cyprinus carpio koi) against North American spring viremia of carp virus [J]. Vaccine, 2008, 26(50): 6415-6421.
[12] Reschova S, Pokorova D, Nevorankova Z, et al. Detection of spring viremia of carp virus (SVCV) with monoclonal antibodies [J]. Vet Med, 2007, 52(7): 308-316.
[13] Hu Y C, Yao K, Wu T Y. Baculovirus as an expression and/or delivery vehicle for vaccine antigens [J]. Expert Rev Vaccines, 2008, 7(3): 363-371.
[14] Philipps B, Forstner M, Mayr L M. A baculovirus expression vector system for simultaneous protein expression in insect and mammalian cells [J]. Biotechnol Prog, 2005, 21(3):708-711.
[15] Hill B J, Underwood B O, Smale C J, et al. Physicochemical and serological characterization of fve rhabdoviruses infecting fsh [J]. J Gen Virol, 1975, 27(3):369-378.
[16] 袁 野,王秀利,郭设平.鱼用基因工程疫苗载体的研究进展[J].生物技术通报,2008,1(5):31-34.
[17] 罗 卫,田飞炎,刘 荭,等.鱼类病毒性神经坏死病毒衣壳蛋白在昆虫细胞中的表达及其特性[J].水产学报,2008,32(4):651-656.
[18] Tani H,Limn C K, Yap C C,et al. In Vitro and In Vivo Gene Delivery by Recombinant Baculoviruses [J],J Virol,2003, 77(18): 9799-9808.
[19] 黄锋涛,熊海林,曹胜波,等.斑点叉尾病毒囊膜蛋白ORF6在昆虫细胞中的表达[J].水产学报,2010,34(7):1034-1039.
Expression and Identifcation of Spring Viremia of Carp Virus Glycoprotein in Baculovirus Expression System
Liu Hong1,Zheng Xiaocong2,Yu Li2,Wang Jinjin2,Jia Peng2,He Junqiang2,Shi Xiujie2,Lan Wensheng2,Liu Hong2,Wu Zhixin1
(1.College of Fisheries,Huazhong Agricultural University,Wuhan,Hubei 430070; 2.The Key Laboratory of Aquatic Animal Diseases,Shenzhen Exit & Entry Inspection and Quarantine Bureau,Shenzhen,Guangdong 518001)
In this study,baculovirus expression system was used to express glycoprotein of spring viremia of carp virus(SVCV). The glycoprotein gene of SVCV was cloned into the pFastBacHTA vector,followed by transformation into competent cells DH10αBac for blue-white selection. The positive recombinant bacmid-G was transfected to Sf9 cell in logarithmic growth phase with Cellfectin Reagent induction to obtain recombinant Baculovirus AcNPV-G. A specifc 57 kDa protein band and hybridizing reaction between expressed protein and positive serum of SVCV were observed by SDS-PAGE and Western blot. For indirect immunofuorescence,specifc fuorescence signals were observed in Sf9 cells infected by AcNPV-G. The results indicated that SVCV glycoprotein had been expressed in Sf9 cells with immunological activity.
spring viremia of carp virus;lycoprotein;baculovirus expression system
S941.416;Q786
:A
:1005-944X(2014)06-0074-05
质检总局公益性行业科研专项(201210055和201210214)资助
刘荭,liuhong@szciq.gov.cn;吴志新,wuzhixin @mail.hzau.edu.cn
