IMS-FMO捕获及富集派琴虫方法的建立
2014-02-24,,,,
,,,,
(中国检验检疫科学研究院,北京 100029)
IMS-FMO捕获及富集派琴虫方法的建立
邓俊花,林祥梅,冯春燕,王彩霞,吴绍强
(中国检验检疫科学研究院,北京 100029)
目的派琴虫病是世界范围内的海洋贝类寄生虫病,现有的检测方法或敏感性低,或检测费用高、或操作困难,难以普及推广。本研究将建立一种新的贝类派琴虫免疫磁珠分离纯化检测方法。方法本研究方法包括四部分:(i)捕获;(ii)荧光显微镜观察;(iii)富集;(iv)方法敏感性评价。结果本研究建立的派琴虫免疫磁珠分离纯化方法,检测派琴虫限度可达103个/mL,整个检测过程仅需1个小时,特异性良好。结论派琴虫免疫磁珠分离纯化方法将为水产品中派琴虫的检测提供一种快速简便的技术支持。
奥尔森派琴虫;免疫磁珠分离;荧光显微观察;分析;检测
派琴虫病是世界动物卫生组织(OIE)规定的法定报告水生动物疾病之一。目前在世界范围内广泛流行,对世界蛤仔等海洋软体动物生长繁殖带来了极大的危害,并对水产品养殖及贸易造成了严重的经济损失[1]。2008年农业部首次将派琴虫病列入蛤仔主要感染的寄生虫病。吴绍强等[2]于2008年5月至2009年5月期间对我国东部沿海一带(其中包括青岛、山东、宁波和福州等监测点)的监测点海域采集菲律宾蛤仔,并对派琴虫感染情况进行调查,结果显示蛤仔派琴虫的感染率在43.75%~95.83%之间不等,几乎每只蛤仔体内都有派琴虫的感染。
鉴于派琴虫对水产品危害的严重程度,国内外开展了很多的研究工作。梁玉波等于2001年应用巯基醋酸盐培养基(FTM)培养法成功培养派琴虫[3]。目前,OIE规定为“黄金标准”的检测方法是巯基醋酸盐培养基(FTM)培养法,该方法被广泛用于派琴虫的鉴定,但是此类方法操作过程耗时过长,敏感性较低,只有当每克组织虫体数大于103个时才能检出虫体[4]。另外,派琴虫还有其它一些检测方法,如普通PCR、荧光PCR、原位杂交、组织切片以及环介导等温扩增(LAMP)等方法,感染率低的贝类样品极易出现假阴性。因此,研究一种快速分离纯化、富集及鉴定派琴虫的方法对我国贝类养殖则显得十分重要和迫切。
免疫磁珠分离技术(Immunomagnetic Separation,IMS)是以抗体包被的磁珠为载体,通过抗体与反应介质中特异性抗原结合形成抗原-抗体复合物,此复合物在磁场的作用下定向移动,从而分离抗原。免疫磁珠分离技术具有分离样品速度快、特异性强、操作简单、不需要昂贵的仪器设备等特点,而且不影响被分离细胞或其它生物材料的生物学性状和功能,目前已在医学和生物学的许多方面发挥了重要作用,尤其是在分离及鉴定病原体方面应用广泛[5-14]。
吖啶橙作为荧光染料,可通过与DNA和RNA的连接碱基对和磷酸盐基团结合,使细胞中的DNA和RNA同时染色而显示不同颜色的荧光。菌体借助激光共聚焦扫描型显微镜(LSCM)进行形态观察,以直观确认免疫磁珠捕获菌体的效果。
本研究借助免疫磁珠分离技术和荧光显微镜技术建立一种快速分离纯化、富集及鉴定派琴虫的方法,以期对新鲜贝类及加工食品快速诊断和检测提供技术支持。
1 材料与方法
1.1 材料
派琴虫培养悬液,本实验室保存;Dynabeads Antibody Coupling Kit购 自Invitrogen(USA) 公司;派琴虫细胞壁特异性单克隆抗体(即,抗派琴虫膜蛋白的单克隆抗体,Perkinsus CB5D4 McAb)由中国检科院动物检疫研究所实验室制备[15],浓度1.5mg/mL,-20℃保存;吖啶橙(AO)染料购自Sigma公司;体外培养的派琴虫由本实验室提供。
1.2 方法
1.2.1 派琴虫免疫磁珠的制备
参照Dynabeads Antibody Coupling Kit进行操作,具体方法如下:5mg Dynabeads M-270 beads加入1mL C1洗涤,分别加入240μL、230μL、220μL、210μL、200μL、190μL C1悬浮磁珠,对应加入单克隆抗体(McAb)10μL ,20μL,30μL,40μL,50μL,60μL,加入250μL C2,混匀。37℃,1000r/min下孵育25h。磁力收集,上清溶液命名为W1,其含有McAb的浓度由NanoDrop (ND-1000)(USA)分光光度计进行测定。按照以下公式计算磁珠与McAb的结合率。结合率=(C0×V0-CW1×VW1)/(C0×V0)×100%(其中,V0代表加入派琴虫单克隆抗体的体积;C0表示派琴虫单克隆抗体的浓度;CW1表示上清溶液中McAb的浓度;VW1表示上清溶液的体积。)
磁珠分别经HB、LB、SB洗涤后,加入800μL SB,室温,1000r/min,吸附15min。去上清,并用500μL SB重悬,此时溶液为派琴虫免疫磁珠溶液,4℃保存。
1.2.2 分离纯化及富集派琴虫方法的建立
1.2.2.1 分离纯化派琴虫
派琴虫培养悬液200μL,4000r/min离心5min,PBS(pH=7.4)溶液洗涤1次,最终加入200μL PBS(pH=7.4)溶解;与20μL洗涤后的免疫磁珠溶液混匀,37℃,1000r/min,分别吸附10min,15min,20min,25min,30min,40min,50min,60min。吸附后PBS(pH=7.4)洗涤2次,加入20μL PBS(pH=7.4)重悬磁珠,进行荧光显微鉴定。
1.2.2.2 荧光显微鉴定
取10μL派琴虫抗原抗体复合物与磁珠的结合物溶液,加入10倍稀释的吖啶橙染色液2μL,混匀,涂片,借助激光扫描共聚焦显微镜(Olympus IX81)进行镜检(100X),参照文献[16]评价免疫磁珠捕获派琴虫的效果。
1.2.2.3 富集派琴虫
派琴虫抗原抗体复合物与磁珠的结合物溶液收集磁珠后加入100μL 0.1M柠檬酸盐溶液(pH=3.1)促进磁珠与派琴虫分离。含有派琴虫溶液低速离心收集,加入培养基或者PBS(pH=7.4)进行后续检测试验。
1.2.3 免疫磁珠分离派琴虫的敏感性评价
1.2.3.1 免疫磁珠从派琴虫培养悬液中分离派琴虫的检测限测定
处理好的9μg/mg beads浓度的免疫磁珠,与浓度分别为107个/mL、106个/mL、105个/mL、104个/mL、103个/mL、102个/mL的派琴虫培养悬液进行反应,吖啶橙染色镜检考察反应效果,并计分,确定产生阳性反应的最低派琴虫培养物的浓度,即此为最低检测限。
1.2.3.2 免疫磁珠从派琴虫模拟阳性病料中分离派琴虫的检测限测定
(1)派琴虫模拟阳性病料制备
取新鲜的无感染的贝类样品,将贝壳弃掉,取腮、套膜及闭合肌25mg置于灭菌的离心管,研磨器研碎,加入PBS(pH7.4)溶液1mL,130r/ min,离心1min,上清留用。取1mL派琴虫培养悬液,4000r/m离心5min,虫体加入上清,混匀。调节此派琴虫阳性模拟溶液至107个/mL、106个/ mL、105个/mL、104个/mL、103个/mL、102个/ mL的不同浓度。
(2)处理好的9μg/mg beads浓度的免疫磁珠,与浓度分别为107个/mL、106个/mL、105个/mL、104个/mL、103个/mL、102个/mL的派琴虫阳性模拟溶液进行反应,吖啶橙染色镜检考察反应效果,并计分,确定产生阳性反应的最低派琴虫模拟溶液的浓度,即此为最低检测限。
1.2.4 免疫磁珠从贝类样品中分离、富集及鉴定派琴虫
1.2.4.1 贝类样品的处理
选取垂死的新鲜贝类样品5份(样品编号:P1~P5),分别取腮、套膜及闭合肌等组织25mg研磨,加PBS溶解后瞬时离心,上清溶液4000r/ min, 离心5min,用PBS(pH7.4)溶液洗涤1次。最终用200μL PBS(pH7.4)重悬虫体。
1.2.4.2 免疫磁珠分离派琴虫
处理好的免疫磁珠加入虫体,37℃吸附。吸附完毕,用磁力收集器收集磁珠,洗涤后加入PBS(pH7.4)溶液重悬,取适量染色镜检。
1.2.4.3 洗脱及富集派琴虫
吸附派琴虫的免疫磁珠,加入100μL 0.1M柠檬酸盐溶液(pH3.1)洗脱,磁珠用磁力收集器(MPC)去除,含有虫体的上清4000r/min离心后,加入200μL PBS(pH=7.4)重悬。
1.2.4.4 荧光PCR方法鉴定
上述5份贝类样品用上述所述方法富集后,将富集得到的派琴虫进行荧光PCR方法鉴定,同时设立阳性和空白对照:阳性对照为派琴虫阳性模拟溶液;空白对照为新鲜无感染的贝类样品组织处理上清。按照QIAGEN公司的商品化试剂盒(DNeasy Blood and Tissue Kit)提取富集得到的派琴虫的DNA。然后采用荧光PCR方法[17]进行鉴定。
2 结果
2.1 派琴虫单克隆抗体与磁珠结合比率的优化
当抗体加入量为30uL时,磁珠与抗体的结合条件最佳。表1为不同McAb量的磁珠与抗体的结合率。

表1 RFTM培养法和原位杂交法的样品检测结果
由表1可以看出,不同包被浓度的派琴虫单克隆抗体包被量与磁珠结合率的数据显示,一开始磁珠充足,所以抗体几乎全部结合到磁珠上,结合率均在90%左右。随着抗体加入量的增加,抗体出现富足,导致二者结合率逐渐降低。但抗体的加入量为30μL,即磁珠包被抗体浓度为9μg McAb/ mg beads时,二者处于最佳结合比例。
2.2 免疫磁珠捕获派琴虫的形态学鉴定
免疫磁珠捕获派琴虫的显微图如图1所示。显微镜下,没有结合派琴虫的免疫磁珠处于散落状态,捕获派琴虫的免疫磁珠成堆聚集,大量显示发荧光的派琴虫与磁珠交错结合在一起(图1)。
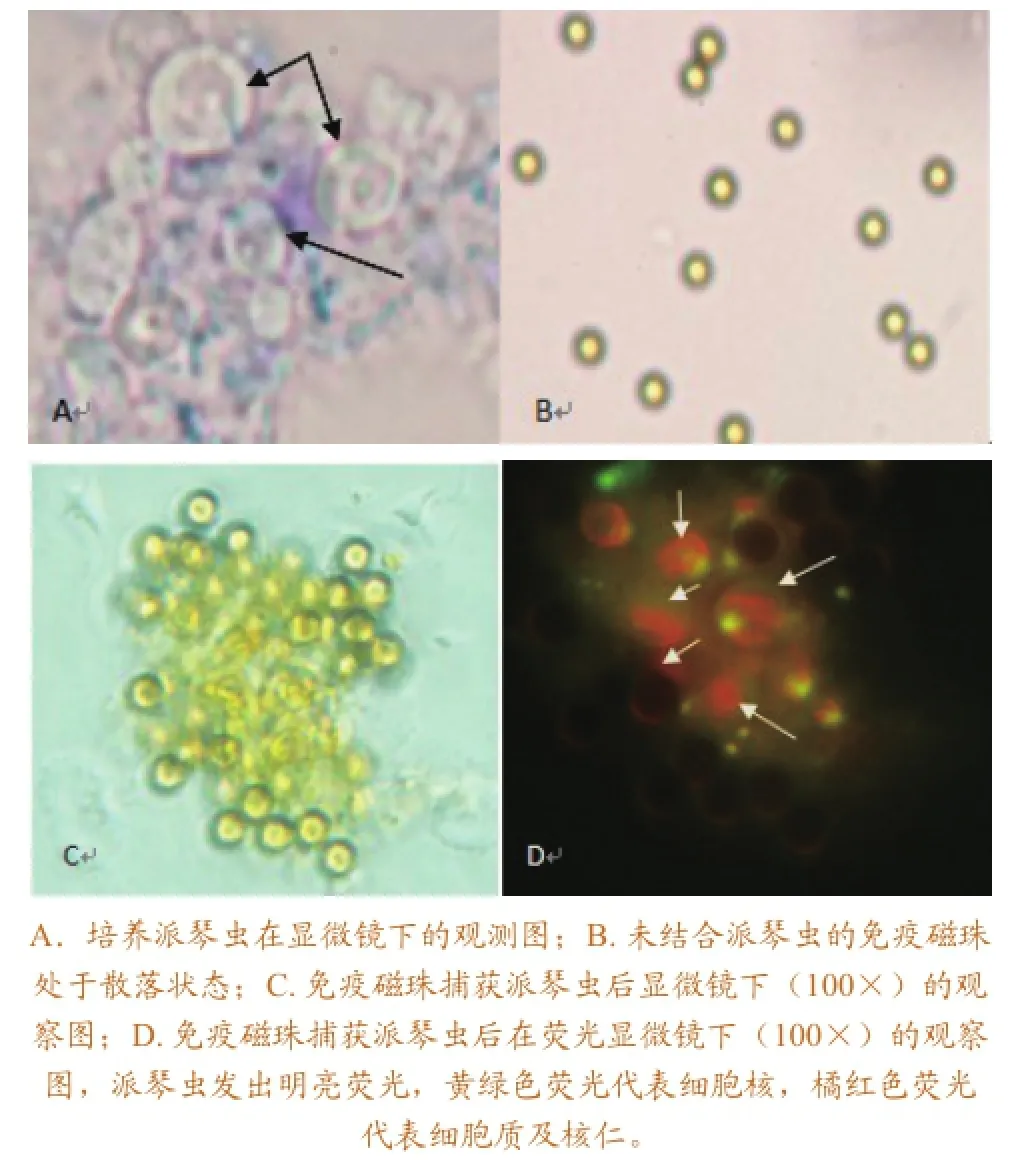
图1免疫磁珠捕获派琴虫不同阶段显微镜图
2.3 免疫磁珠捕获派琴虫时间的选择
不同时间免疫磁珠捕获派琴虫的效果数据显示,吸附时间为30min时,免疫磁珠捕获派琴虫的效果评价计分值最高,因此,免疫磁珠与派琴虫在一定量的情况下,吸附30min,可以达到理想的捕获效果(图2)。

图2不同捕获时间的免疫磁珠分离派琴虫结果的计分
2.4 免疫磁珠从派琴虫培养液中分离派琴虫的检测限测定
显微镜检可见,随着反应溶液中派琴虫浓度逐级降低,反应后磁珠分散程度增大,与之相对应,磁珠捕获派琴虫的效果降低。同时,多个磁珠与多个派琴虫交错结合在一起的现象减少,到102个/ mL浓度时,镜下只能看到少量单个磁珠结合单个派琴虫。零分反应的磁珠在镜下完全分散,全部视野中未发现有派琴虫结合磁珠。由数据结果显示,在该试验条件下,当派琴虫培养液浓度为102个/ mL时,免疫磁珠无法分离到派琴虫。因此,用纯化抗体9μg/mg beads浓度包被磁珠从派琴虫培养液中分离派琴虫的检测限约为102个/mL。

表2免疫磁珠捕获不同浓度派琴虫培养液的效果计分
2.5 免疫磁珠从派琴虫模拟阳性病料中分离派琴虫的检测限测定
随着派琴虫模拟阳性病料浓度的降低,免疫磁珠捕获派琴虫的镜检现象同“免疫磁珠从派琴虫培养液中捕获派琴虫”。结合镜检结果得出,在该试验条件下,当派琴虫阳性模拟病料浓度为103个/ mL时,镜下只能看到少量单个磁珠结合单个派琴虫。因此,用纯化抗体9μg/mg beads浓度包被磁珠从派琴虫阳性模拟病料中分离派琴虫的检测限约为103个/mL。

表3免疫磁珠捕获不同浓度派琴虫阳性模拟病料的效果计分
2.6 免疫磁珠从贝类样品中分离派琴虫的鉴定
5份贝类样品用免疫磁珠捕获法富集后,镜检结果参照文献[16]进行计分评价(表4)。将富集样品分别提取DNA进行荧光PCR鉴定,均出现扩增现象,与镜检结果相符。

表4免疫磁珠从贝类样品中捕获派琴虫的效果计分

图3富集得到的派琴虫荧光PCR鉴定图
3 讨论
3.1 血清学诊断的特异性主要取决于诊断试剂的特异性,并与血清学检查方法的选择有关。ELISA方法具有敏感性高、操作简便、不需要昂贵的仪器设备等优点,但更适用于纯化的可溶性抗原。特异性强的诊断抗原将极大地增加检测结果的可靠性。同时,更加纯的抗原可以检测到更加微量的抗体。为提高ELISA反应的特异性,解决非特异性交叉反应和假阳性结果产生的问题,必须得到纯化的派琴虫病原体。IMS技术在从复杂样品中富集和纯化低含量的寄生虫方面具有独特的优势。优质的磁珠具有高度的均一性和良好的顺磁性,在与复杂的生物样品反应时受到颗粒性杂质等的影响较小,可有效排除其它干扰成分,获得纯化菌体。日本科学家对比了IMS和培养法检测胃肠道幽门螺杆菌的效果,结果显示IMS能够从胃黏膜富集到幽门螺杆菌并获得纯培养,而单纯培养法则极易因其它细菌的过度生长而掩盖了幽门螺杆菌的存在[18]。ARVE LUND等利用特异性的抗体包被磁珠可以从混有不同血清型(K88-)的大肠杆菌混合液中特异性的分离K88+大肠杆菌,分离物纯度可达到97%以上[16]。此外,IMS被证明是一种有效的微生物诊断方法。包被好的磁珠具有高度的反应特异性,可根据表面抗原的差异从若干中混杂菌中分离低含量的目标菌株,并有效地排除各种反应抑制剂的干扰,有利于其它检测技术的应用[19-20]。
3.2 IMS被证明是一种有效的微生物诊断方法,对某些细菌已有成熟的检测试剂盒出售,比如沙门氏菌和大肠杆菌O157。免疫磁珠分离反应后的检查方法可以有多种:培养法、染色镜检法等可用于活体细菌或细胞的检测,PCR法还可检测到死亡的微生物。派琴虫虫体较大,易于辨认,因此我们选用吖啶黄染色镜检的方法检查磁珠分离效果。实验结果显示低倍、高倍镜和油镜下均可清楚地看到派琴虫虫体结合到磁珠上。
3.3 IMS作为直接的检测方法,其敏感性和分离纯度(特异性评价)是两个最重要的方法评价指标。本研究的结果显示,对于派琴虫培养液,IMS的最低检测限可达102/mL,这与许多文献报道的结果接近[21];对于派琴虫模拟阳性病料,IMS的检测限只能达到103/mL,这可能是由于贝类组织研磨离心后上清样品中颗粒样杂质过多影响磁珠反应造成的。IMS法受到溶液中颗粒性杂质的干扰程度与免疫微球的大小有关。使用更大的微球可能有助于减少这种干扰[19,22]。在IMS分离派琴虫特异性评价中,包被好的免疫磁珠可以特异性地从含有大量细胞成分的组织匀浆液中分离派琴虫病原体,而与其它杂菌没有交叉反应,且不受细胞成分影响,显示了良好的分离特异性。
[1] Ulrich PN, Ewart JW, Marsh AG. Prevalence of Perkinsus marinus (dermo), Haplosporidium nelsoni (MSX), and QPX in bivalves of Delaware’s inland bays and quantitative, highthroughput diagnosis of dermo by QPCR [J].The Journal of Eukaryotic Microbiology, 2007,54(6): 520-526.
[2] Wu SQ, Wang CX, Lin XM, et al. Infection Prevalence and Phylogenetic Analysis of Perkinsus olseni in Ruditapes philippinarum from East China[J]. Diseases of Aquatic Organisms, 2011,96(1):55-60.
[3] 梁玉波.菲律宾蛤仔体内寄生帕金虫的研究[D]. 大连:中国科学院海洋研究所. 2005,1-131.
[4] Uchida E, Kogi M. Optimization of the virus concentration method using polyethyleneimine-conjugated magnetic beads and its application to the detection of human hepatitis A, B and C viruses[J]. J Virol Methods, 2007, 143(1):95-103.
[5] 何静云,刘 星,张丽芳,等. 免疫磁珠分离技术纯化和检测泰泽氏病原体的研究[J].中国实验动物学报,2006, 14(2): 126-131
[6] 李树清,吴红结,胡永强,等.免疫磁珠分离胸膜肺炎放线杆菌的研究[J]. 上海交通大学学报,2007 ,25 (2 ): 87-91.
[7] 徐礼源,谢秀红,吴武鑫,等.免疫磁珠检测水中f2噬菌体方法的研究[J]. 中国卫生检验杂志,2008 ,18 (4):604-607.
[8] Favrin SJ, Jassim SA, Griffiths MW. Application of a novel immunomagnetic separation-bacteriophage assay for the detection of Salmonella enteritidis and Escherichia coli O157:H7 in food[J]. International Journal of Food Microbiology,2003,85(1):63-71.
[9] Gessler F, Hampe K, Schmidt M. Immunomagnetic beads assay for the detection of botulinum neurotoxin types C and D[J]. Diagnostic Microbiology and Infectious Disease, 2006,56: 225-232.
[10] Mansfeld LP, Forsythe SJ. The detection of Salmonella using a combined immunomagnetic separation and ELISA enddetection procedure[J].Letters in Microbiol,2001,18:361-366.
[11] Parham NJ, Picard FJ, Peytavi R, et al. Specifc magnetic bead based capture of genomic DNA from clinical samples:application to the detection of group B streptococci in vaginal/ anal swabs[J]. Clinical Chemistry, 2007, 53(9): 1570-1576.
[12] Robinson G, Watkins J, Chalmers RM. Evaluation of a modified semi-automated immunomagnetic separation technique for the detection of Cryptosporidium oocysts in human faeces[J].Journal of Microbiological Methods. 2008,75(1):139-141.
[13] Wang L, Li Y, Mustaphai A. Rapid and simultaneous quantitation of Escherichia coli 0157∶H7, Salmonella, and Shigella in ground beef by multiplex real-time PCR and immunomagnetic separation[J].Journal of Food Protection,2007,70(6):1366-1372.
[14] Tokairin T, Nishikawa Y, Doi Y, et al. A highly specific isolation of rat sinusoidal endothelial cells by the immunomagnetic bead method using SE-1 monoclonal antibody[J]. Journal of Hepatology, 2002, 36(6):725-733.
[15] 王彩霞,吴绍强,林祥梅等. 抗派琴虫膜蛋白的单克隆抗体、其制备方法及应用[P]. 北京: 专利号-201210231140.0.
[16] Lund A,Hellemann AL,Vartdal F.Rapid isolation of K88+Escherichia coli by using immunomagnetic particles[J]. Journal of Clinical Microbiology,1988,26(12):2572-2575.
[17] 吴绍强、林祥梅、刘建等.用于派琴虫检测的实时荧光PCR引物和探针[P]. 北京,专利号-200810224654.7.
[18] Osaki T, Taguchi H, Yamaguchi H, et al. Detection of Helicobacter pylori in fecal samples of gnotobiotic mice infected with H. pylori by an immunomagnetic-bead separation technique [J]. Journal of Clinical Microbiology,1998,36(1):321-323.
[19] Stevens KA, Jaykus LA. Bacterial separation and concentration from complex sample matrices: a review[J]. Critical Reviews in Microbiology,2004,30(1):7-24.
[20] Weisbroth SH, Peters R, Riley LK, et al. Microbiological Assessment of Laboratory Rats and Mice [J].ILAR Journal,1998,39(4): 272-290.
[21] Luk JM, Lindberg AA.Rapid and sensitive detection of Salmonella (O∶6,7) by immunomagnetic monoclonal antibodybased assays [J].Journal of Immunological Methods,1991,137(1):1-8.
[22] Weimer BC, Walsh MK, Beer C. Solid-phase capture of proteins, spores, and bacteria [J].Applied and Environmental Microbiology, 2001, 67(3):1300-1307.
Development of IMS-FMO Method for Capture and Concentration of Perinsus olseni
Deng Junhua,Lin Xiangmei,Feng Chunyan,Wang Caixia ,Wu Shaoqiang
(Chinese Academy of Inspection and Quarantine,Beijing 100029)
ObjectivePerkinsosis is a worldwide parasitic disease of marine mollusks. Many rapid methods are available for detection of Perkinsus,but they are often insensitive or expensive or require a high degree of technical ability to perform. Here,a novel assay was developed for the detection of Perkinsus.MethodThe assay contained four stages:(i)capture;(ii)fluorescence microscope observation (FMO);(iii)concentration;(iv)assay sensitivity evaluation.ResultThe detection limit of the assay was about 103/mL,and the test procedure could be fnished in 1 hour.ConclusionAn immunomagnetic separation(IMS)-FMO assay for detection of Perkinsus was developed providing a rapid, simple, and sensitive technique for detection of Perkinsosis.
Perinsus olseni;IMS;FMO;Assay;Detection
S944.344
:A
:1005-944X(2014)06-0084-05
质检公益性行业科研专项(201010016);国家科技支撑计划课题(2012BAK11B04)
吴绍强(E-mail sqwu@sina.com)
