某屠宰场猪粪便中单增李斯特菌携带调查
2014-02-24,,,,,,,,,,,
,,,,,,,,,,,
(1.传染病预防控制国家重点实验室,中国疾病预防控制中心传染病预防控制所,北京 102206;2.贵州省黔南州人民医院检验科,贵州 558000;3. 湖南省怀化市妇幼保健院, 湖南怀化 418000;4.贵阳医学院微生物学教研室,贵州贵阳 550004)
某屠宰场猪粪便中单增李斯特菌携带调查
刘凯1,王艳1,王天姝2,贺春月3,代航1,于波1,袁雪娇1,叶正兴1,王毅1,许华青4,孟双1,叶长芸1
(1.传染病预防控制国家重点实验室,中国疾病预防控制中心传染病预防控制所,北京 102206;2.贵州省黔南州人民医院检验科,贵州 558000;3. 湖南省怀化市妇幼保健院, 湖南怀化 418000;4.贵阳医学院微生物学教研室,贵州贵阳 550004)
为了初步探索猪的李斯特菌携带情况以及屠宰加工环境中污染的可能性,并进一步对分离到的单增李斯特菌进行分型分析,以了解其分子流行病学特征,为预防控制食源性李斯特菌病提供参考。2011年3月至2012年2月每月月初定点采集某一屠宰场的猪粪便标本和加工场所环境水样标本,进行李斯特菌的病原学分离,对分离到的单增李斯特菌进行血清分型、多位点序列分型(MLST)和脉冲场电泳分型(PFGE)分析。1322份猪粪便标本和104份环境标本中,共分离到7株单增李斯特菌、56株无害李斯特菌。5株单增李斯特菌属于1/2c血清型(ST9型),1株1/2a血清型(ST199型),1株1/2b血清型(ST5型)。4株1/2c型菌株具有完全相同的PFEG带型,与另外1株1/2c型菌株具有相似带型,而与其他2株菌株(分别为1/2a型和1/2b型)的带型具有较大差异。猪的单增李斯特菌携带率较低,但存在污染加工环境的可能性,进而导致生猪肉食品受到污染。对屠宰及加工场所采取有效的消毒灭菌措施能够避免单增李斯特菌的污染和传播。
单增李斯特菌;猪粪便标本;分子分型
单增李斯特菌(Listeria monocytogenes)是一种重要的食源性病原菌,能引起李斯特菌病。该菌广泛分布于各种环境中,如一些野生或家养的牲畜、鸟类、昆虫、土壤、污水以及蔬菜中[1]。感染该菌后,能够使免疫力低下人群出现败血症、脑膜炎等较为严重的感染症状,导致孕妇流产、胎儿早产或死产、新生儿脑膜炎和败血症。免疫力正常人群,在食入一定量单增李斯特菌污染的食品后,也可能会出现发热性胃肠炎症状[2]。
单增李斯特菌是我国食源性病原菌监测的必检项目之一,各地食品检测结果显示肉类食品中单增李斯特菌的污染率较高[3-4]。导致肉类食品污染有两种可能:食用动物本身携带了单增李斯特菌;在动物屠宰及肉类加工过程中被外源单增李斯特菌污染。为了解进入市场前猪的单增李斯特菌携带情况以及对加工环境污染的可能性,本研究选择一个生猪屠宰场进行了连续一年的采样及病原检测。每月采集猪的粪便及环境标本,针对李斯特菌进行分离鉴定,并对分离到的单增李斯特菌进行了血清型与分子分型分析。
1 材料与方法
1.1 标本采集 2011年3月至2012年2月,每月(1-6日)于某屠宰场进行猪粪便标本及环境标本采集。该屠宰场规模较大,每日屠宰量约为3000头,采集的地点集中在内脏分离车间。共采集到1322份猪粪便标本,104份环境标本(取自台面水和地面污水)。
1.2 菌株分离培养 无菌棉签多点蘸取粪便标本,环境水样标本吸取500μL,接种至5 mL Halffraser增菌液,30℃,220 r/min恒温摇床培养24 h。将Half-fraser增菌液中的培养物接种至Fraser增菌液,30℃,220 r/min恒温摇床培养24 h。将Fraser增菌液中的培养物接种至李斯特菌显色固体培养基37℃培养24 h,挑取可疑菌落(周围有透明圈的蓝色菌落和没有透明圈的蓝色菌落)至脑心浸液固体培养基中纯化。
1.3 菌株鉴定 对经过纯化的可疑菌落,采用水煮法提取DNA,即刮取少量菌落,加入100μLTE(pH8.0)中混匀,置沸水中煮10 min,再以13000 r/min离心5 min,取上清液为DNA模板。用李斯特菌属特异性引物进行扩增(表1)[5]。25µL的反应体系包括:10×buffer 2.5μL,dNTP(dATP, dTTP, dCTP及 dGTP各 2.5mM)1.5 µL,上游引物(10μM)各0.5 µL,下游引物(10μM)1.5 µL,Taq DNA Polymerase 1U,模板100 ng,无菌去离子水补充至25 µL。扩增反应参数:94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸2 min,共进行30个循环; 最后72℃延伸10 min。扩增阳性的菌株用API Listeria生化试剂条按照产品说明书进行李斯特菌的种间鉴定。
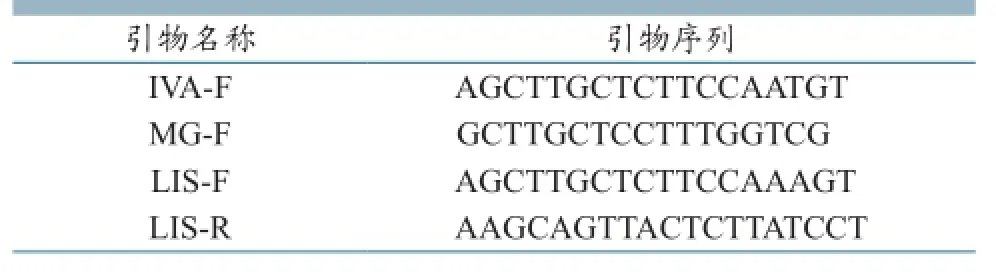
表1李斯特菌属特异性引物及单增李斯特种特异引物序列
1.4 单增李斯特菌血清型、多位点序列分型(multi-locus sequence typing,MLST)和脉冲场电 泳(pulsed-feld gel electrophoresis,PFGE) 分析 对所有分离得到的单增李斯特菌,采用日本Denka Seiken公司的血清抗体,按照产品说明书进行血清型鉴定。参照巴斯德研究所的单增李斯特菌多位点序列分型数据库操作流程(http:// www.pasteur.fr/recherche/genopole/PF8/mlst/Lmono. html),针对单增李斯特菌7对管家基因(abcZ,blgA,cat,dapE,dat,ldh,lhkA)部分片段进行PCR 扩增并测序,得到菌株的序列型。根据美国CDC PulseNet的标准操作规程对单增李斯特菌进行脉冲场电泳分型分析,分别用两种内切酶(AscⅠ和ApaⅠ)对菌株进行酶切,PFGE图像用BioNumerics(Version5.0)软件进行聚类分析。
2 结果
2.1 菌株分离情况 1322份猪粪便标本中分离到6株单增李斯特菌、17株无害李斯特菌。104份环境标本中分离到1株单增李斯特菌、39株无害李斯特菌。猪粪便和环境中李斯特菌总检出率分别为1.74%和38.5%,其中单增李斯特菌的检出率分别为0.45%和0.96%。单增李斯特菌株分离时间为3、4、8月各1株,7月4株。除8月分离的菌株来自环境水样标本我外,其余菌株均分离自猪粪便标本(图1)。
2.2 单增李斯特菌的血清分型、MLST和PFGE分型 7株单增李斯特菌中有5株属于1/2c血清型,另2株分别为1/2a和1/2b血清型。MLST分型结果与血清型较为一致,5株1/2c型菌株均为ST9型,1/2a型菌株为ST199型,1/2b型菌株为ST5型(图1)。本研究采用两种酶进行PFGE分型,共分为4种PFGE型别,其中7月份分离的4株菌属于同一型别,并与8月份分离菌株非常相近。3、4月分离菌株与7、8月菌株带型差异较大(图1)。
本次调查分离到的7株单增李斯特菌中6株属于家系Ⅱ(主要包括1/2a,1/2c,3a,3c血清型),1株属于家系Ⅰ(主要包括1/2b和4b血清型),这与家系Ⅱ菌株相对于家系Ⅰ菌株更为广泛存在于自然界的规律相一致[7]。张兰荣等[8]曾对同一城市的部分地区2007~2011年食品中单增李斯特菌进行检测,其中从猪肉中分离的菌株主要为家系Ⅱ中的1/2a和1/2c血清型,提示无论猪内源性携带还

图1单增李斯特菌分离株的分型结果
3 讨论
本研究表明,该屠宰场加工的猪携带单增李斯特菌的比率较低,仅为0.45%,其携带率略低于日本研究人员的结果(0.8%)[6],同时远低于目前报道的肉类食品中单增李斯特菌的污染率[3-4],提示肉类食品的单增李斯特菌污染很大可能发生于食品的加工、储存直至食用的各个环节。尽管猪携带单增李斯特菌的情况不多见,但由于生猪加工流水作业的特殊性,一旦有携带单增李斯特菌的猪出现在加工过程中,则可能导致生产流水线下游某些区域被污染,进而造成更多猪肉被污染。应重视对动物源性单增李斯特菌污染和生肉类食品中单增李斯特菌污染的监测。
本研究在一年的每个月初进行样品采集和病原菌分离,并且每月标本量较为一致(100~150份),仅于3月、4月、7月和8月采集标本中分离到单增李斯特菌,由此可见相对于冬季,春夏季节较为容易分离到该菌。因为没有对饲养过程中生猪带菌情况进行调查,因此尚不能推断猪感染单增李斯特菌的易感季节。是猪肉在加工、储存、销售过程中被外源环境污染都以家系Ⅱ单增李斯特菌为主。
本研究发现,7月分离到的4株单增李斯特菌来自连续采集的4份样品,并具有完全一致的分子分型结果,推测可能为采集样本的器械发生交叉污染,或者可能是一头猪所携带的单增李斯特菌污染了加工处理生产线局部环境,进而导致连续生产加工的几头猪所采样品被该菌株污染而检出阳性。尤其是我们在随后一个月(8月份)的环境水样中分离到的1株单增李斯特菌与这4株菌具有相同的血清型和ST型,PFGE带型图谱略有差异,提示7月和8月份的菌株具有相近的亲缘关系。单增李斯特菌具有极强的环境适应能力,能在3℃~45℃温度范围内和pH 4.4~9.6条件下生长,对碱和盐具有较强的抵抗力[9]。研究显示,单增李斯特菌在土壤、污水等环境中可以长期存活,Oris等人利用基因组测序证实两株来自1988年和另外两株自来2000年分离自同一加工地点的菌株具有极为相似的基因组骨架序列,提示该菌株可能在此至少存活了12年[10]。本研究在9月份及以后的采样检测中没有从环境样品中再分离出单增李斯特菌,可能与该屠宰场的消毒措施得当有关,该屠宰场具有针对加工肉产品的接触面以及生产加工用水进行定期监督抽测措施,以确保加工产品的安全。研究结果提示单增李斯特菌虽然具有较强的环境适应能力,及时有效的消毒措施,可以消除污染并切断传播途径。
[1] Ramaswamy V, Cresence V M, Rejitha J S, et al. Listeriareview of epidemiology and pathogenesis[J]. J Microbiol Immunol Infect, 2007,40(1): 4-13.
[2] Schlech W F. Foodborne listeriosis[J]. Clin Infect Dis,2000,31(3): 770-775.
[3] 仝志琴,杨琼.2010年洛阳市食源性致病菌检测结果分析[J].现代预防医学, 2013, 40(1):23-24.
[4] 董峰光, 宫春波, 王朝霞, 等. 2011年烟台市市售肉及肉制品污染状况调查[J].职业与健康, 2013,29(9):1096-1098.
[5] Somer L, Kashi Y. A PCR method based on 16S rRNA sequence for simultaneous detection of the genus Listeria and the species Listeria monocytogenes in food products[J]. J Food Prot, 2003,66(9): 1658-1665.
[6] Iida T,Kanzaki M, Nakama A, et al. Detection of Listeria monocytogenes in humans, animals and foods[J]. J Vet Med Sci, 1998,60(12): 1341-1343.
[7] Orsi R H, den B H C, Wiedmann M. Listeria monocytogenes lineages: Genomics, evolution, ecology, and phenotypic characteristics[J]. Int J Med Microbiol, 2011, 301(2): 79-96.
[8] 张兰荣, 王艳, 张扬, 等. 2007—2011年北京市通州区分离单增李斯特菌的生物学及分子流行病学特征[J].疾病监测, 2012, 27(7):562-564.
[9] Gray M L, Killinger A H. Listeria monocytogenes and listeric infections[J]. Bacteriol Rev, 1966, 30(2): 309-382.
[10] Orsi R H, Borowsky M L, Lauer P, et al. Shortterm genome evolution of Listeria monocytogenes in a noncontrolled environment[J]. B M C Genomics, 2008(9): 539.
Investigation of Listeria monocytogenes in Swine Stool in an Abattoir
Liu Kai1,Wang Yan1,Wang Tianshu2,He Chunyue3,Dai Hang1,Yu Bo1,Yuan Xuejiao1,Ye Zhengxing1,Wang Yi1,Xu Huaqing4,Meng Shuang1,Ye Changyun1
(1.State Key Laboratory for Infectious Disease Prevention and Control, National Institute for Communicable Disease Control and Prevention, Beijing, 102206;2.Clinical Laboratory of Qiannan People’s Hospital, Dujun Guizhou 558000, China; 3. Huaihua Maternal and Child Hospital,Huaihua Hunan, 418000;4. The Department of Microbiology of Guiyang Medical University,Guiyang Guizhou, 550004)
To fnd out the Listeria infection in swine and the contamination risks in the processing environment,1322 stools of swine and 104 environmental samples were collected for the isolation of Listeria from March 2011 to February 2012. Seven Listeria monocytogenes and ffty-six Listeria innocua were identifed. In order to understand the epidemiological characteristic of L. monocytogenes,all the seven isolates were subtyped by serotyping,multi-locus sequence typing(MLST)and pulse feld gel electrophoresis(PFGE). Five L. monocytogenes strains belonged to 1/2c(ST9),the rest two strains were 1/2a(ST199)and 1/2b(ST5),respectively. Four of fve 1/2c serotype strains showed the same pulsotype,which was very similar with the remaining 1/2c serotype strain. The other two strains(1/2a and 1/2b serotype),showed distinct pulsotypes from that of 1/2c strains. The result showed that the infection rate of L. monocytogenes in swine was low, and the contamination of environment could possibly happen if the infected swine enter the process. The contamination and spreading of L. monocytogenes could be avoided by proper disinfection in slaughterhouse.
Listeria monocytogenes;Stool sample of swine;Molecular subtyping
R378.994
:A
:1005-944X(2014)06-0047-04
国家重大传染病防治科技重大专项(2011ZX10004-001,2013ZX10004-101)资助
叶长芸
注:刘凯、王艳共为第一作者
