海宁裕丰传统玫瑰醋优势醋酸菌分离及培养
2014-02-20高泽鑫孙晓彤黄勋高冰
高泽鑫,孙晓彤,黄勋,高冰*
(1.武汉生物工程学院生物科学与技术系,湖北武汉430415;2.武汉轻工大学生物与制药工程学院,湖北武汉430023;3.湖北工业大学轻工学部,湖北武汉430068)
海宁裕丰传统玫瑰醋优势醋酸菌分离及培养
高泽鑫1,孙晓彤2,黄勋1,高冰3*
(1.武汉生物工程学院生物科学与技术系,湖北武汉430415;2.武汉轻工大学生物与制药工程学院,湖北武汉430023;3.湖北工业大学轻工学部,湖北武汉430068)
以浙江海宁裕丰玫瑰醋醋醪为实验材料,从醋醪中分离培养出3株发酵性能高且菌种活力稳定的优势醋酸菌菌株As4,Af6,Ad2。利用形态学观察、培养特征和生理生化特征对其进行细菌学鉴定,最后将其确定为醋酸杆菌属中的醋化醋杆菌Ad2、巴氏醋杆菌As4和恶臭醋杆菌Af6。其中醋化醋杆菌Ad2菌株醋酸产量在分离菌株中最高,且在实验室条件下32 h内总产酸可达1.02 g/mol,是可进一步诱变提高其产酸率并用于生产的理想菌株。
玫瑰醋;培养;鉴定;醋酸杆菌
食醋在我国已具有两千多年的历史,是我国传统的酸性调味品。我国传统的酿造醋有镇江香醋、山西老陈醋、福建红曲醋、四川麸醋、北京熏醋、浙江玫瑰醋等产品[1],各具特色。浙江玫瑰米醋以其天然玫瑰红色来命名,酸味柔和绵长,醋香纯正,鲜而微甜,独具风味,是我国食醋中的佳品。该食醋不但用作调味品,而且是理想的保健食品可调配饮用。
传统的玫瑰醋生产是以大米为原料,在浙江地理环境基础下,利用环境中天然野生菌种(如醋酸菌、霉菌、酵母菌),经表面静置液态发酵法酿造而成的不添加任何色素、甜味剂、酸味剂,具有玫瑰红色的酿造食醋[2-4]。生产工艺简单,但环境依赖性大,由于是天然发酵,产品质量容易受气温、湿度等环境因素的影响。因此有必要对浙江玫瑰醋的微生物群落结构变化进行研究,并对其发酵过程中的优势菌种进行改进,从而改善其生产工艺,缩短生产周期[5-7]。从而提高其生产效率,达到增加产品在市场中的竞争力与影响力的目的。
本研究以浙江玫瑰米醋作为实验对象,从醋醪中分离出产酸效能高的优势醋酸菌菌株[8],并对其进行纯化,研究其生物学特征鉴定其归属。这对研究浙江玫瑰醋发酵中微生物的区系分布有一定的意义[9]。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
菌种来源于浙江海宁裕丰酿造有限公司,从该公司玫瑰米醋醋醪中分离得到的醋酸菌菌株,现由武汉轻工大学生化楼409实验室保藏。
1.1.2 培养基
醋酸菌增殖培养基:葡萄糖10 g/L,酵母膏10 g/L,pH自然,121℃灭菌20 min,30 mL/L无水乙醇,乙醇在灭菌后培养基温度降至75℃左右加入。
醋酸菌固体分离培养基:葡萄糖10 g/L,酵母膏10 g/L,琼脂粉20 g/L,碳酸钙20 g/L,pH自然,121℃灭菌20 min,30mL/L无水乙醇(灭菌后加入)。
保藏斜面培养基:葡萄糖5 g/L,酵母膏10 g/L,琼脂粉20 g/L,碳酸钙15 g/L,pH 5.5,121℃灭菌20 min,30 mL/L无水乙醇(灭菌后加入)。
产酸试验培养基:葡萄糖10 g/L,酵母膏10 g/L,pH自然,121℃灭菌20 min,30 mL/L无水乙醇(灭菌后加入)。
醋酸菌种子液培养基:蒸馏水25 mL,葡萄糖0.25 g,酵母膏0.25 g,pH自然,121℃灭菌20 min,750 μL无水乙醇(灭菌后加入)。
1.1.3 主要试剂
葡萄糖(分析纯)、碳酸钙(分析纯):国药集团化学试剂有限公司;酵母膏:北京奥博星生物技术有限责任公司;琼脂粉:天津市科密欧化学试剂有限公司;无水乙醇(分析纯):上海强顺化学试剂有限公司。其他化学试剂均为分析纯。
1.2 仪器与设备
LHS-250SC型恒温恒湿培养箱:上海浦东荣丰科学仪器有限公司;SLY-2112B型恒温培养摇床:金坛市盛蓝仪器制造有限公司;SW-CJ-2D型超净工作台:广东瑞智科学仪器有限公司;YM50F型压力蒸汽灭菌器:上海三申医疗器械有限公司;BM2000型光学显微镜:南京江南永新光学有限公司;LIV-1800PC型紫外可见分光光度计:上海光谱达仪器有限公司;BL6100电子天平:德国SARTORIUS公司。
1.3 方法
1.3.1 醋酸菌纯化分离试验流程

1.3.2 操作要点
增殖培养:从玫瑰香醋醋醪中吸取1 mL原始醋醪液加入100 mL醋酸菌增殖培养基中放入30℃的恒温培养摇床中180 r/min培养1 d,从而得到大量混合菌种。
光镜观察:用接种环从增殖培养基中蘸取混合液样品到已经滴好生理盐水的载玻片上,轻轻搅动让其混合均匀,再放入显微镜下观察菌落形态。
平板稀释涂布[10]:吸取醋酸菌增殖培养基中的菌液1mL到EP管中,再通过EP管进行依次稀释,稀释至1×10-6梯度。吸取1×10-4、1×10-5、1×10-6这三种梯度的EP管液各100μL加入到醋酸菌固体分离培养基中。涂好后将培养基放入恒温培养箱中30℃倒置培养48 h。
革兰氏染色:挑选出溶钙圈大,菌膜丰满,边缘整齐的单菌落,放置于新的固体分离培养基平板上划线培养,得到较纯的醋酸菌菌种,进行革兰氏染色。
菌种发酵培养:将分离得到的不同种类的醋酸菌菌株分别放入醋酸菌种子液培养基中,30℃、180 r/min培养12h,再倒入200 mL产酸试验培养基中,30℃的恒温培养摇床180 r/min培养2 d。
1.3.3 产醋酸定性试验
将分得的疑似醋酸菌菌株分别接种于醋酸菌种子液培养基中,30℃培养48 h后,取5 mL培养液,用10%NaOH将培养基pH值中和至中性,后加入10%氯化铁2~3滴摇匀,形成红褐色沉淀者为产醋酸菌。
1.3.4 初筛
将分得的疑似醋酸菌菌株根据革兰氏染色和产醋酸定性试验筛选出革兰氏阴性且产醋酸的菌株为醋酸菌。
1.3.5 产酸定量试验
将已确定为醋酸菌菌种的种子培养液以10%的接种量接种于产酸试验培养基中,30℃、180r/min条件下振荡培养48h,在这段时间中每2h对发酵液总酸度进行测量。总酸测定方法依照GB/T 12456—2008《食品中总酸的测定》[11]。
1.3.6 菌株生长曲线[12]
每隔2d取一定量的发酵液分光光度计测其波长600 nm处吸光度值。测得的吸光度值再减去原始发酵培养基(没加入种子液的发酵培养基)的吸光度值,余下的则为菌株的种子生长系数。
1.3.7 优势菌株筛选
根据不同属种的醋酸菌菌株产酸性能的高低和菌株种子生长曲线进行对比,从而选择出优势的醋酸菌菌株。
1.3.8 菌株鉴定[13-14]
依据《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》对已确定为醋酸菌的菌株进行鉴定对比,以确定醋杆菌的属种。
2 结果与分析
2.1 初筛结果与分析
2.1.1 光镜下观察结果

图1 光学显微镜下的菌落形态特征(×400)Fig.1 Colony morphology characteristics of optical microscope(×400)
通过图1可以看出,对浙江玫瑰醋初次增殖培养出的菌种不纯,有球菌、杆菌和弧菌等。根据这种情况体现出传统浙江玫瑰醋发酵是多种微生物参与的混合发酵,因此对发酵过程中的优势菌种进行改进,首先要对浙江玫瑰醋的传统工艺和微生物来源及演化规律进行深入研究,这是首要的环节,也是其他各项工作开展的前提条件,同时也反映出对其单一传统优势菌种进行纯化分离与鉴定的必要。
2.1.2 菌落形态特征
通过稀释涂布的醋酸菌固体分离培养基生长中得到的单一菌落,应用溶钙圈法初筛,再经过纯化分离(划线法),最后采用梯度稀释,将稀释后的菌样接种到固体培养基上,挑选出溶钙圈最大的三株菌株As4、Ad2、Af6,结果见图2。

图2 As4、Ad2、Af6醋酸菌菌株培养第2天的菌落形态特征Fig.2 Colony morphology of As4,Ad2,Af6acetic acid bacteria strains on the second day cultivation
2.1.3 菌株发酵培养与产酸性能对比
将初筛选出的3株菌种分别接种于发酵培养基中,30℃,180 r/min条件下振荡培养24 h,测定发酵液中总酸含量。

图3 优势醋酸菌菌株的产酸情况Fig.3 Acid production conditions of the dominant strains
通过图3可以看出,这三种菌株的发酵结果为Ad2菌株产酸量高于As4菌株和Af6菌株,由此可得出Ad2菌株为优势菌株,对Ad2菌株用试管斜面培养基进行转接,4℃低温保藏备用。
2.2 菌种复筛结果与分析
2.2.1 光镜下观察结果
通过图4可以看出,复筛培养出的Ad2菌株形态特征多为椭圆状菌体有少许退化型特征,多为球状和伸长状,单生或成对或成链生长,大小为(0.6~0.7)μm×(0.9~1.5)μm,不产生芽孢。菌落圆形,突起,表面光滑,在含碳酸钙的固体培养基上能产生透明圈,且菌落为肉色。

图4 光学显微镜下的Ad2菌株形态特征(×400)Fig.4 Ad2strain morphology under an optical microscope(×400)
2.2.2 Ad2菌株发酵产酸性能与菌株生长曲线

图5 Ad2菌株种子生长曲线Fig.5 Growth curve of Ad2strain
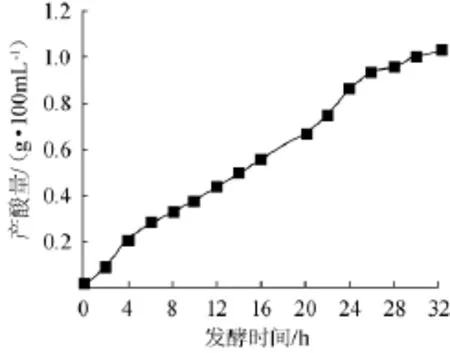
图6 Ad2菌株产酸情况Fig.6 Acid production condition of Ad2strain
通过对Ad2菌株进行深层发酵,得出该菌株生长的最佳活性时期是发酵前12 h,并通过对菌体OD值的测定,绘出菌株种子的生长曲线见图5。由于菌体干质量测量经过的步骤比较多,所受的影响也比较大,如每个三角瓶在接种时会存在一定的系统误差;离心后烘至质量恒定会受到时间、温度以及分析天平的影响,因此该方法的准确度不是很高并且工作量较大。但采用测OD值的方法可以解决这种缺点,而使得菌体周期的测定变得简洁和具有较高的精确度。由图6可以看出,Ad2菌株产酸量随时间增长一直在稳步上升,28 h后醋酸菌产酸量达到一个缓慢增长的时期,32 h内总产酸为1.02 g/100 mL。在食醋酿造中醋酸菌产酸占据了非常重要的地位,提高其产酸量对食醋增产有很大意义。
2.3 菌株的鉴定
2.3.1 形态学特征
三株菌株的形态特征见表1,As4与Af6形态成椭圆形,Ad2的形态成短杆状,都无芽胞。As4与Ad2排列特征为成对或成链,Af6为单个或成对。

表1 菌株的形态特征Table 1 Morphological characteristic of strains
2.3.2 菌落培养特征
三株菌株的单菌落特征见表2。

表2 菌株的培养特征Table 2 Cultural characteristic of strains
2.3.3 生理生化特征
三株菌的生理生化特征见表3。

表3 菌株的生理生化特征Table 3 Physiological and biochemical characteristics of strains
2.3.4 鉴定结果
在表1~表3中所列生物学特性的前提上,依据《常见细菌系统鉴定手册》及《伯杰细菌鉴定手册》,鉴定本试验分离出的菌株均为醋酸杆菌属(Acetobacter),主要依据生化反应鉴定As4为巴氏醋杆菌(Acetobacter pasteurianus),Af6为恶臭醋杆菌(Acetobacter rancens),Ad2为醋化醋杆菌(Acetobacter aceti)。
3 结论
本研究以浙江玫瑰米醋作为研究对象,从醋醪中分离筛选出了一株产酸效能高且菌种生长活力旺盛的醋酸菌菌株Ad2菌株。Ad2菌种在实验室条件下32 h内总产酸为1.02 g/100 mL。相对于在同期发酵产酸的As4和Af6菌株,Ad2菌株发酵性能好,是优势菌株。
通过生理生化鉴定,得出Ad2菌株为革兰阴性菌,初步确定该株菌属于醋化醋杆菌(Acetobactor aceti),该菌种严格好氧,适宜生长温度28~35℃,pH为5.5~6.3,酸性氧化乙醇为醋酸,产酸能力稳定,且生长活力旺盛。由于Ad2菌株的优良特征,如果在后期对其进行完整分子生物学鉴定并确定其菌株的亚种,即可进一步诱变提高菌种产酸能力,让该菌种成为可用于生产的理想菌株。醋酸菌代谢控制的关键在于适当增加菌株代谢溶解氧、前体物和适宜的发酵温度[15],适当的调整发酵条件来找到该菌株的最佳生长环境。
[1]叶荷生.国内几种传统名醋介绍[J].江苏调味副食品,1999(2):18-20.
[2]杨希娟,樊明涛,师俊玲,等.西藏灵菇发酵乳中优势菌群的分离鉴定[J].中国酿造,2007,26(6):52-55.
[3]国建娜,蒋予箭,王丽,等.浙江玫瑰醋酒化发酵工艺条件的优化[J].中国酿造,2008,27(15):31-32.
[4]沈子林.话说浙江玫瑰米醋[J].中国酿造,2005,24(2):60-61.
[5]朱扬玲.采用PCR-DGGE方法研究浙江玫瑰醋酿造过程中的微生物多样性[D].杭州:浙江工商大学硕士论文,2009.
[6]SOKOLLEK S J,HERTEL C,HAMMES W P.Description ofAcetobacter oboedienssp.nov.andAcetobacter pomorumsp.Nov.two new species isolated from industrial vinegar fermentations[J].Int J Syst Bacteriol,1998,48(7):935-940.
[7]MORALES M L,GONZALEZ A G,TRONCOSO A M.Ion-exclusion chromatographic determination of organic acid in vinegars[J].J Chromatogr A,1998,822(9):45-51.
[8]李素燕.醋酸菌的分离鉴定及冬枣醋饮料的研制[D].天津:天津大学硕士论文,2008.
[9]舒畅,吴春生,钟慈平,等.发酵食品微生物多样性研究方法进展[J].食品科学,2013,34(15):397-402.
[10]胡建华,孙凤萍,王英,等.鸭疫里氏杆菌分离及免疫研究[J].上海农业学报,2003,19(4):2-3.
[11]全国食品工业标准化技术委员会.GB/T 12456—2008食品中总酸的测定[S].北京:中国标准出版社,2008.
[12]高林峰,吴天祥.测菌体的OD值法探索松口蘑种子最佳生长周期[J].贵州大学学报:自然科学版,2010,27(1):40-42.
[13]R E布坎南,E吉本斯.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001. [15]林森,蒋予箭,国建娜,等.醋酸发酵工艺条件优化的研究[J].中国酿造,2008,27(1):39-40.
Separation and cultivation of dominantAcetobacter aceticfrom traditional rose vinegar in Haining Yufeng area
GAO Zexin1,SUN Xiaotong2,HUANG Xun1,GAO Bing3*
(1.Department of Biological Science&Technology,Wuhan Institute of Bioengineering,Wuhan 430415,China; 2.College of Biological and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China; 3.College of Light Industry,Hubei University of Technology,Wuhan 430068,China)
Using rose vinegar mash in Zhejiang Haining Yufeng as experiment material,three strains of acetic acid bacteria with high fermentation performance and stable culture activity As4Af6,Ad2were separated from vinegar mash.Bacteriology identification was conducted by morphological observation,cultural characteristics,physiological and biochemical characteristics observation.In the end,Ad2was identified asAcetobacter aceti, As4asAcetobacter pasteurianus,and Af6asAcetobacter rancens.Among the three strains,Acetobacter acetiAd2had the highest acid production,and the total acid output in 32 h could reach 1.02 g/mol under laboratory conditions,it could be further induced to improve its acid production rate,and it would be an ideal strain in practice of vinegar production.
rose vinegar;cultivation;identification;Bacillus aceticus
TS201.3
A
0254-5071(2014)07-0126-04
10.11882/j.issn.0254-5071.2014.07.029
2014-05-18
高泽鑫(1993-),男,本科生,研究方向为发酵食品。
*通讯作者:高冰(1963-),男,高级工程师,本科,研究方向为微生物发酵。
