外源性天然色素掺伪果酒和饮料鉴别检测方法的研究
2014-02-20刘浩赵广西葛娜李峰杨帛杜伟
刘浩,赵广西*,葛娜,李峰,杨帛,杜伟
(1.国家葡萄、葡萄酒质量监督检验中心(秦皇岛),河北秦皇岛066000;2.秦皇岛出入境检验检疫局检验检疫技术中心,河北秦皇岛066000;3.南通食品职业技术学院,江苏南通226000)
外源性天然色素掺伪果酒和饮料鉴别检测方法的研究
刘浩1,赵广西1*,葛娜2,李峰3,杨帛1,杜伟1
(1.国家葡萄、葡萄酒质量监督检验中心(秦皇岛),河北秦皇岛066000;2.秦皇岛出入境检验检疫局检验检疫技术中心,河北秦皇岛066000;3.南通食品职业技术学院,江苏南通226000)
研究了5种天然色素-越橘红、红米红、黑加仑红、萝卜红、葡萄皮红的高效液相色谱检测法,样品处理后,甲醇-乙腈-甲酸为流动相进行梯度洗脱,在检测波长为515 nm条件下对5种目标物同时进行检测。试验表明,5种色素检测的相对标准偏差为5.7%~7.4%,回收率为74.1%~94.7%,检出限为5.6~7.5 mg/L。由此可知,本研究建立的天然色素检测方法简单快速,精确可靠,重复性好。
掺伪;鉴别;检测;天然色素
食品的安全性已成为人们关注的焦点,人们对待食品不再只停留在色、香、味上,更在于其安全、营养。天然色素不仅可以改善食品性状,增加食欲,还对人体有多种有益作用,因此开发安全可靠的天然食用色素对保障人类健康和促进食品工业等的发展具有十分重要的意义,已受到世界各国的高度关注。近年来天然食用色素的使用量呈快速增长的趋势,其的安全使用势必成为食品安全领域的新热点[1-3]。
天然色素的大量使用有助于产品质量的提升,但由于检测方法的缺乏,使得部分产品借机以次充好、以假充真,扰乱了正常的市场秩序。越橘红、红米红、黑加仑红、萝卜红、葡萄皮红5种天然色素产量较大[4-5],在果酒和饮料中应用广泛但研究较少,尤其缺乏对样品中掺杂使用的具体检测方法,特别是红米红在葡萄酒中被大量应用,对葡萄酒市场的正常秩序造成了很大冲击,而近年来葡萄酒中葡萄皮红色素的使用也在迅速发展[6]。研究这些色素的使用具有很强的代表意义。由于几种色素都是从植物中提取出来,其中含有较多成分,因此研究针对主要呈色物质进行。根据文献确定这5种色素的主要呈色物质分别为红米红(矢车菊素-3-葡萄糖苷),越橘红(矢车菊-3-半乳糖苷),黑加仑红(飞燕草素-3-芸香糖苷),萝卜红(天竺葵-O-葡萄糖苷),葡萄皮红(锦葵色素-3-葡萄糖苷)[7-11]。
目前天然色素检测方法主要有层析法[12]、分光光度法[13]、液相色谱法[14-18]、高效逆流色谱法[19]、液质联用法[20-23]等。其中层析法、分光光度法很难实现对色素中不同组分的检测,应用有较大局限。高效液相色谱-串联质谱法分析花色苷所需流动相pH较低,容易抑制质谱的离子化,影响分析。高效逆流色谱法应用较少,无显著优点。本研究利用高效液相色谱仪同时检测果酒和饮料中5种天然色素,得到的方法快捷、简便、准确,可广泛应用于饮料和果酒中天然色素的检测。
1 材料与方法
1.1 材料与试剂
萝卜红色素:北京金晔生物技术有限公司;越橘红色素:佛山市南海怡康天然制品有限公司;红米红色素:晨光生物科技集团股份有限公司;葡萄皮红色素:广州市中旺生物科技有限公司:黑加仑红:河南明瑞食品添加剂有限公司。果酒是葡萄酒和饮料同为秦皇岛本地市售产品。
乙腈(色谱纯)、甲醇(色谱纯):北京迪马科技有限公司;三氟乙酸、氨水、甲酸(均为分析纯):天津市化学试剂三厂。矢车菊-3-半乳糖苷、矢车菊素-3-葡萄糖苷、锦葵色素-3-葡萄糖苷、飞燕草素-3-芸香糖苷、天竺葵-O-葡萄糖苷:美国Sigma公司。
1.2 仪器与设备
Agilent 1100高效液相色谱仪(配有紫外检测器):美国安捷伦公司;HHS-21-8型智能数显电热恒温水浴锅:NOKI诺基仪器有限公司;IKA旋转蒸发仪:德国IKA集团公司。Cleanert PCX(6 mL/500 mg)固相萃取小柱:天津博纳艾杰尔科技有限公司。
1.3 试验方法
1.3.1 色谱条件
色谱柱:Phenomenex C18(2.1 mm×250 mm,5 μm);柱温箱温度:30℃;流动相:水/甲酸(95∶5)(A)和甲醇/乙腈/水/甲酸(22.5∶22.5∶45∶5)(B),梯度洗脱,洗脱程序见表1。流速1 mL/min,进样量10 μL,检测器为紫外检测器,检测波长515 nm。

表1 流动相梯度洗脱程序Table 1 Gradient elution program of mobile phase
1.3.2 样品处理
将样品温热,搅拌均匀后,取5 mL经过2%三氟乙酸12 mL活化后的Cleanert PCX小柱,酸化甲醇12 mL清洗杂质,5%氨水/甲醇(40∶60)6 mL洗脱,收集洗脱液加甲酸调节pH值至2后旋蒸定容至5 mL,用0.45 μm的超滤膜过滤提取液,供分析用。
1.3.3 标品处理
取适量标品用超纯水溶解后定容,配制成10 mg/L、50 mg/L、100 mg/L、500 mg/L的标准溶液,置于4℃冰箱中备用。
2 结果与分析
2.1 检出限
图1显示了果汁样品5种色素的出峰顺序,依次分别为1:飞燕草素-3-芸香糖苷;2:矢车菊-3-半乳糖苷;3:锦葵色素-3-葡萄糖苷;4:矢车菊素-3-葡萄糖苷;5:天竺葵-O-葡萄糖苷。
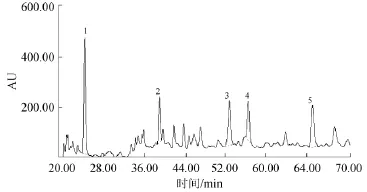
图1 样品中5种色素高效液相色谱图Fig.1 High performance liquid chromatogram of 5 pigments in samples
将一系列不同浓度的色素混合标准溶液按1.3试验方法进行测定,以峰面积对质量浓度绘制工作曲线,得到线性回归方程和相关系数,以3倍信噪比确定检出限,结果见表2。

表2 色素的回归分析结果和检出限Table 2 Regression analysis results and detection limit of 5 pigments
由表2可知,5种色素质量浓度在10~500 mg/L范围内呈现良好的线性关系,而且方法的分离度好,检出限低。试验过程105 min时间较长,但样品往往基质复杂,花色苷类型多样,长时间的试验保证花色苷的有效分离。
2.2 精密度和加标回收率试验
采用标准加入法,称取7份葡萄酒样品,其中一份作为空白,另外6份样品分别加入一定质量浓度的混合标准溶液,按上述方法进行提取净化,分别进样,加标回收,计算平均回收率和相对标准偏差(relative standard deviation,RSD),3个添加水平的平均回收率范围和精密度结果见表3。
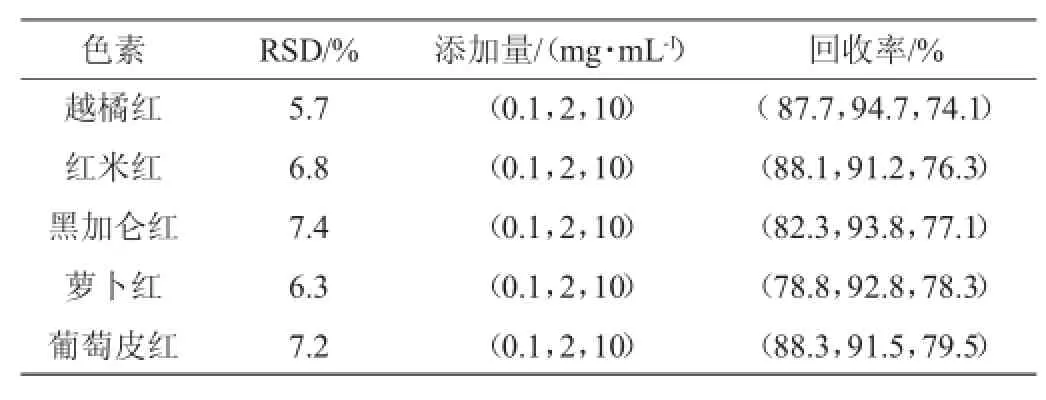
表3 精密度及加标回收率试验结果Table 3 Results of precision and recovery rate of 5 pigments
由表3可知,5种红色素精密度试验的相对标准偏差为5.7%~7.4%,加标回收率为74.1%~94.7%,表明该方法精密度好,准确度高。
2.3 样品中5种色素的检测
图2是对当地产红葡萄酒中样品矢车菊素-3-葡萄糖苷高效液相色谱检测图,检测中发现部分葡萄酒中含有一定量的矢车菊素-3-葡萄糖苷,含量范围在13~30 mg/kg。

图2 葡萄酒中矢车菊素-3-葡萄糖苷高效液相色谱图Fig.2 High performance liquid chromatogram of cornflower-3-glucoside in grape wine
试验测定了果汁饮料20份,葡萄酒10份共30份样品,其中越橘红的检出率为33%,平均质量浓度为46mg/L;红米红的检出率为60%,平均质量浓度为108 mg/L;黑加仑红的检出率为40%,平均质量浓度为65 mg/L;萝卜红的检出率为33%,平均质量浓度为58 mg/L;葡萄皮红的检出率为20%,平均质量浓度为25 mg/L。
3 结论
试验选择越橘红、红米红、黑加仑红、萝卜红、葡萄皮红5种色素作为研究对象,研究建立了应用高相液相仪检测果酒和饮料中天然色素的方法,通过对样品前处理方法及色谱柱、流动相等色谱条件的优化和改进,Cleanert PCX固相萃取小柱净化和富集天然色素,用Phenomenex C18柱,以水/甲酸(95∶5)(A)和甲醇/乙腈/水/甲酸(22.5∶22.5∶45∶5)(B)为流动相在波长515 nm处进行测定,同时检测了越橘红、红米红、黑加仑红、萝卜红、葡萄皮红5种色素。
结果表明,在色素质量浓度为10~500mg/L时线性关系良好。对样品进行的精密度及加标回收率试验结果表明,5种色素检测的相对标准偏差(RSD)为5.7%~7.4%,回收率为74.1%~94.7%,检出限为5.6~7.5 mg/L。由此可知,本研究建立的天然色素检测方法简单快速,精确可靠,重复性好。
[1]马丽,方尚玲,胡爱红.天然食用色素研究现状与进展[J].山东食品科技,2002(7):3-5.
[2]高彦祥,许正虹.食用天然色素安全性研究进展[J].食品科学,2005,26(S1):158-162.
[3]邹志飞,蒲民,李建军,等.各国(地区)食用色素的使用现况与比对分析[J].中国食品卫生杂志,2010,22(2):112-121.
[4]朱海燕.浅谈我国食用色素的现状及对策[J].内蒙古石油化工,2011,21(21):47-48.
[5]卢雪华,成坚,白卫东.我国食用色素工业的现状及对策[J].中国调味品,2010(5):35-39.
[6]朱卫华,董广阳,黄珺.天然色素龙头踏上新征程[R].晨光生物投资价值分析报告,2010-11-11.
[7]邓慧颖,张晓芳,高伟,等.七种花色苷色素中矢车菊-3-葡萄糖苷含量研究[J].中国食品添加剂,2013(6):88-92.
[8]张晓芳,高伟,邓慧颖,等.红米红中矢车菊-3-葡萄糖苷含量与色价的相关性分析[J].食品科学,2013,34(20):135-138.
[9]咸漠,何淑华.黑加仑色素的分离及组成初步鉴定[J].吉林大学自然科学学报,1998(4):91-93.
[10]游辉,欧阳杰,武彦文,等.萝卜红花色苷的高效液相色谱法测定[J].分析测试学报,2010,29(3):310-312.
[11]邹宇,魏红云,王伟君,等.山葡萄皮红色素提取及稳定性研究[J].食品研究与开发,2008,29(1):190-192.
[12]BONDRE S,PATIL P,KULKARNI A,et al.Study on isolation and purification of anthocyanins and its application as pH indicator[J].Int J Adv Biot Res,2012,3(3):698-702.
[13]QIN C G,LI Y,NIU W N,et al.Analysis and characterisation of anthocyanins in mulberry fruit[J].Czech J Food Sci,2010,28(2):117-126.
[14]PERATI P P,DE BORBA B M,ROHRER J S.Food Components and Characteristics[C]//Rapid separation of anthocyanins in cranberry and bilberry extracts using a core-shell particle column,Sunnyvale,USA, 2012.
[15]FICZEK G,VÉGVÁRI G,SÁNDOR G,et al.HPLC evaluation of anthocyanin components in the fruits of Hungarian sour cherry cultivars during ripening[J].J Food Agr Environ,2011,9(1):30-35.
[16]GOUVÊA A C M S,DE ARAUJO M C P,SCHULZ D F,et al.Anthocyanins standards(cyanidin-3-O-glucoside and cyanidin-3-O-rutinoside) isolation from freeze-dried açaí(Euterpe oleraceaeMart.)by HPLC[J]. Ciênc Tecnol Aliment,32(1):33-35.
[17]张晓芳,高伟,邓慧颖,等.红米红中矢车菊-3-葡萄糖苷含量与色价的相关性分析[J].食品科学,2013,34(15):135-138.
[18]肖长城,李甲明,姚改芳,等.不同红梨品种果皮中花色素苷组分及含量特征分析[J].南京农业大学学报,2014,37(4):60-66.
[19]VELICˇKOVSKAL S K,MIRHOSSEINI H,BOGEVA E.Isolation ofanthocyanins by high-speed countercurrent chromatography and application of the color activity concept to different varieties of red grape pomace from macedonia[J].J Nutr Food Sci,2013,3(6):243-249.
[20]HUANG W J,ZHANG S L,QIN G H,et al.Isolation and determination of major anthocyanin pigments in the pericarp ofP.communisL.cv.‘Red Du Comices’and their association with antioxidant activity[J]. African J Agr Res,2012,7(26):3772-3780.
[21]LC-MSAnalysisofanthocyaninsin bilberryextract[EB/OL].Application brief 134 part of thermo fisher scientific(2011).http:∥www.thermoscientific.com/dionex.
[22]高玥,李新生,韩豪,等.UPLC-MS/MS定性测定紫薯花青苷方法研究[J].食品工业科技,2013,34(3):317-320.
[23]BARNES J S.Analytical characterization of anthocyanins from natural products by reverse-phase liquid chromatography-photodiode arrayelectrospray ionization-ion trap-time of flight mass spectrometry[D]. Arlington:University of Texas,2010.
Determination of exogenous natural pigment in adulterating fruit wine and drink
LIU Hao1,ZHAO Guangxi1*,GE Na2,LI Feng3,YANG Bo1,DU Wei1
(1.National Center of Supervision&Inspection on Grape and Wine Quality,Qinhuangdao 066000,China;2.Qinhuangdao Entry-Exit Inspection and Quarantine Bureau of China Inspection and Quarantine Technique Centre,Qinhuangdao 066000,China; 3.Nantong Food Vocational Technology College,Nantong 226000,China)
A simple and accurate method for the determination of 5 natural pigments in adulterated food was developed.In order to determine these constituents by RP-HPLC,cowberry red,red kermel color,black currant red,radish red and grape-skin red were gradient eluted using methanol-acetonitrile-formic acid as mobile phase.Samples were detected simultaneously at the wavelength was 515 nm.Result showed that the relative standard deviation,average recovery and detection limit were 5.7%-7.4%,74.1%-94.7%,5.6-7.5mg/L,respectively.The HPLC method to simultaneously determine five natural pigments was simple,fast,accurate,and reliable with good repeatability.
adulteration;distinguishing;detection;natural pigment
O657.7
A
0254-5071(2014)07-0105-04
10.11882/j.issn.0254-5071.2014.07.024
2014-04-25
河北省技术监督局项目(2011ZB16)
刘浩(1977-),男,高级工程师,本科,研究方向为食品安全检测。
*通讯作者:赵广西(1979-),男,工程师,硕士,研究方向为食品安全检测。
