纯种米曲霉酒曲的制备工艺优化研究
2014-02-20赵中开杨建刚马莹莹林秋林艳四川理工学院生物工程学院四川自贡643000
赵中开,杨建刚*,马莹莹,林秋,林艳(四川理工学院生物工程学院,四川自贡643000)
纯种米曲霉酒曲的制备工艺优化研究
赵中开,杨建刚*,马莹莹,林秋,林艳
(四川理工学院生物工程学院,四川自贡643000)
在单因素试验的基础上,选取影响纯种米曲霉酒曲糖化酶活力的3个主要因素(培养温度、培养时间、接种量),应用响应面试验对制曲的最佳工艺条件进行了研究,结果显示3个因素对米曲糖化酶活力的影响是显著的。利用Design-Expert软件对试验数据进行处理,得到制曲的最佳工艺条件为:培养温度38.70℃,接种量0.85‰,培养时间50.47 h。在此条件下米曲糖化酶活力的预测值为1 111.52 U。在最佳培养条件下对预测值进行验证,所测得的实际值与预测值基本一致。
响应面;米曲霉;纯种酒曲;工艺优化
用曲酿酒是我国古代劳动人民的一项伟大发明,曲的作用主要体现在三个方面:一是为酒母和醪液提供酶源,使原料中的淀粉、蛋白质和脂肪等溶出和分解;二是在曲菌繁殖和产酶的同时,产生葡萄糖、氨基酸、维生素等成分,为酵母提供营养来源,并生成有机酸、高级醇及酯类等成分;三是曲香及曲的其他成分,作为酒的前体物质赋予酒以独特的风味[1]。因此,千百年来酿酒先辈们从实践中总结出了“曲乃酒之骨”和“好曲出好酒”的精辟论断[2]。米曲霉(Aspergillus oryzae)是我国黄酒和日本清酒酿造过程中的重要糖化菌株,该菌不仅产酶种类丰富[3-7],而且酶活力高,是酿酒制曲的理想微生物。
米曲霉在国内外酱油、制酱、酿酒等工业生产上的应用历史悠久。1987年,联合国粮食及农业组织/世界卫生组织食品添加剂联合专家委员会批准米曲霉可用于食品工业酶制剂的生产。美国环境保护局对米曲霉与其他物种的分类关系、对人类健康和环境的危害和工业应用的风险性评价结果表明,米曲霉对动植物无致病性,是人类应用较为广泛的安全酿造微生物。应用米曲霉发酵所加工的产品及食品对人类或动物具有一定的保健功效。所以,研究米曲霉特性及其应用对大力发展轻工业、研发高质量的产品有着广泛的发展前景[8]。由于米曲霉的产糖化酶特性在酿酒中占有至关重要的地位,故试验以南方籼米为制曲原料,应用单因素试验和BBD响应面试验对影响纯种米曲霉酒曲糖化酶活力的主要因素及制曲的最佳工艺条件进行研究,旨在为米曲霉酒曲的规模化制备提供参考依据。
1 材料与方法
1.1 材料与试剂
米曲霉(Aspergillus oryzae)A52820121203:实验室保藏;南方籼米:市售,含水量12.5%;酿造水:符合GB5749—2006《生活饮用水卫生标准》;葡萄糖(分析纯):成都市科龙化工试剂厂。
1.2 仪器与设备
LHP-250恒温培养箱:常州普天仪器制造有限公司;DZKW-4电子恒温水浴锅:北京中兴伟业仪器有限公司;SYQ-DSX-280B高温蒸汽灭菌锅:申安医疗器诫厂;6102电子天平:杭州友恒称重有限公司;BCD-256L电冰箱:青岛乐家电器有限公司;超净工作台:苏净集团安泰公司制造。
1.3 试验方法
1.3.1 工艺流程
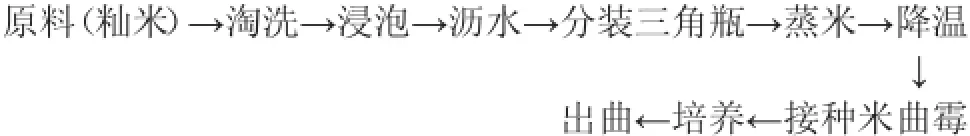
1.3.2 操作要点
洗米:除去附在米粒表面的杂质,如糠、尘土及夹杂物等。
浸米:由于籼米的吸水性较差[9],故需浸泡较长时间,在20℃的条件下,需浸泡12 h以上(因为籼米吸水较慢,12 h以下不能满足含水量30%以上的试验要求)。当米粒从外观上看透明感消失,变成纯白色,用手碾米粒,能将米粒碾碎时,即可将籼米捞出,沥水0.5 h后,分装蒸米。
蒸米:用高压蒸汽灭菌锅蒸米,条件为110℃,45 min。使蒸出的籼米熟而不烂,内无白心生米。
降温:将蒸熟后的米置于接种箱内降温。
接种:当米的品温降至约31℃时,以无菌操作的方式接种米曲霉孢子粉。
恒温培养:前24 h为31℃恒温培养,24 h之后调至所需温度培养。
扣瓶:米曲霉是一种好氧性微生物[8],其菌丝在生长时会相互缠绕,造成米粒结块,导致曲料内部缺氧,因此应及时扣瓶,将结块的米粒打散。本试验的扣瓶频率为每12 h一次。
1.3.3 粗酶液的制备
称取2 g绝干米曲样品,置于研钵中充分研磨,然后向研钵中加入10 mL乙酸-乙酸钠缓冲液(pH4.6),继续研磨至糊状。用30 mL蒸馏水将其完全转移至100 mL烧杯中,35℃水浴浸提1 h,期间每15 min搅拌1次。浸提完成后以脱脂棉过滤,滤液即为供试酶液[10]。
1.3.4 糖化酶活力的测定
采用GB 8276—2006《食品添加剂-糖化酶制剂》中规定的方法对米曲的糖化酶活力进行测定[11]。
糖化酶活力的定义:1 g固体酶粉(或1 mL液体酶)于40℃、pH4.6的条件下,1 h分解可溶性淀粉产生1 mg葡萄糖即为一个酶活力单位,U/g或U/mL。
1.3.5 单因素试验设计
(1)温度对米曲糖化酶活力的影响
制曲的前24 h在31℃的条件下培养,24 h之后将温度分别调至31℃、33℃、35℃、37℃、39℃、41℃进行制曲试验,培养结束后,取样测糖化酶活力。该单因素试验中接种量为0.8‰,制曲时间为50 h,每12 h翻曲一次。
(2)接种量对米曲糖化酶活力的影响
分别采用0.4‰、0.8‰、1.2‰、1.6‰的接种量进行单因素试验,培养结束后,取样测糖化酶活力。该单因素试验温度为33℃,培养时间为50 h,每12 h翻曲一次。
(3)培养时间对米曲糖化酶活力的影响
分别采用42 h、46 h、50 h、54 h、58 h的制曲时间进行单因素试验,培养结束后,取样测糖化酶活力。该单因素试验温度为33℃,接种量为0.8‰,每12 h翻曲一次。
1.3.6 响应面试验设计
Box-Behnken Design(BBD)是响应面优化法中常用的试验设计方法[12-14]。在单因素试验的基础上,以米曲糖化酶活力为指标,以培养温度、接种量、培养时间3个因素为自变量,应用BBD响应面试验法对制备纯种米曲霉曲的工艺条件进行优化。各因素的试验水平范围见表1。

表1 响应面试验因素水平Table 1 Factor and levels of the response surface methodology
2 结果与讨论
2.1 单因素试验
2.1.1 温度对米曲糖化酶活力的影响

图1 培养温度对糖化酶活力的影响Fig.1 Effect of culture temperature on glucoamylase activity
由图1可知,随着温度的升高,米曲糖化酶活力呈现出先升高后降低的变化规律,在35~37℃时,糖化酶活力较高。当温度>37℃时,糖化酶活力开始逐渐降低。究其原因,可能是因为在温度较低时,米曲霉的生长不旺盛,产酶量较低,而温度过高时同样也会对米曲霉的生长产生抑制,使曲的糖化酶活力下降。因此在响应面设计时,选用33℃、
37℃、41℃的培养温度。
2.1.2 接种量对米曲糖化酶活力的影响

图2 接种量对糖化酶活力的影响Fig.2 Effect of inoculum on glucoamylase activity
由图2可知,接种量在0.4‰~1.6‰的范围内变化时,糖化酶活力先上升后下降。当接种量为0.8‰时,糖化酶活力最高,随着接种量的继续增大,糖化酶活力开始逐渐降低。一般而言,接种量越大微生物的生长越快,但是当接种量过大时,微生物个体间会形成营养竞争,这对菌体的生长将产生不利影响。在响应面试验中选择0.4‰、0.8‰、1.2‰3个接种量。
2.1.3 培养时间对米曲糖化酶活力的影响

图3 培养时间对米曲糖化酶活力的影响Fig.3 Effect of culture time on glucoamylase activity
由图3可知,当培养时间为42~58 h时,糖化酶活力随培养时间的增加先上升后下降,在50 h时糖化酶活力达到最大,随着培养时间的继续延长,糖化酶活力开始逐渐降低并最终趋于平稳。这可能是由于当培养时间过长时,菌丝出现老化并产生孢子,从而消耗了米曲中的酶类物质。在响应面试验中选择46 h、50 h、54 h的培养时间。
2.2 响应面试验
为了研究不同因素对米曲糖化酶活力的影响,确定其最佳工艺条件,本研究选择对米曲糖化酶活力影响较大的3个因素(培养温度、接种量、培养时间)做响应面回归分析,试验结果见表2。
在该响应面试验中共包含15个试验点,这15个试验点大体可分为两类:一类是析因点,是自变量取值在正方体棱的中间处的试验点,共有12个;另一类是零点,是自变量取值在正方体中心的试验点,零点试验共重复3次,用来估计试验误差。

表2 响应面试验设计及结果Table 2 Experiment design and result of response surfacemethodology
利用Design-Expect软件对试验数据进行分析[15],最后得到的回归方程为:Y=1 086.35+105.21A+18.11B+27.15C+ 4.32AB+5.00AC+23.20BC-124.82A2-88.83B2-136.37C2,R2=0.982 7。对回归方程进行方差分析,其结果见表3。

表3 回归模型的方差分析Table 3 Variance analysis for regression model
从表3可以看出,此模型的P<0.01,说明该响应面回归模型达到极显著水平。其决定系数R2=0.982 7,表明模型中98.27%的数据可用这个模型解释。本试验所建模型中A、C、A2、B2、C2对糖化酶活力的影响显著(P<0.05),失拟项数据分析表明该模型失拟不显著,因此该二次模型能够较好地拟合真实的响应面数据。
2.3 模型分析讨论
利用Design-Expect 8.0.6软件对试验数据进行处理,得到响应曲面(RSM)的三维图,其综合反映了各变量与响应值之间、变量与变量之间的关系[16]。
2.3.1 培养温度和接种量的交互作用
由图4可知,响应曲面的坡度较为陡峭,表明响应值(糖化酶活力)对培养温度和接种量的改变较为敏感。当接种量保持不变时,随着培养温度的升高,糖化酶活力先快速升高再缓慢下降;当培养温度保持恒定时,随着接种量的加大,糖化酶活力先缓慢升高再缓慢下降,当温度在37.8~39.8℃、接种量在0.72‰~0.96‰时对提高糖化酶活力最为有利。从等高线图可以看出,两个因素的交互作用较弱,对糖化酶活力的影响不显著。

图4 糖化酶活力与培养温度和接种量关系的响应面图和等高线图Fig.4 Response surface plot and contour line of effects between culture temperature and inoculum on glucoamylase activity
2.3.2 培养温度和培养时间的交互作用
由图5可知,响应曲面的坡度较为陡峭,表明响应值(糖化酶活力)对培养温度和培养时间的改变较为敏感。当培养时间保持不变时,随着培养温度的升高,糖化酶活力先快速升高再缓慢下降;当培养温度保持恒定时,随着培养时间的延长,糖化酶活力先增加后减少,当温度在37.6~40℃、培养时间在49.4~51.6 h时对提高糖化酶活力最为有利。从等高线图可以看出,两个因素的交互作用较弱,对糖化酶活力的影响不显著。

图5 糖化酶活力与培养温度和培养时间关系的响应面图和等高线图Fig.5 Response surface plot and contour line of effects between culture temperature and time on glucoamylase activity
2.3.3 接种量和培养时间的交互作用

图6 糖化酶活力与接种量和培养时间关系的响应面图和等高线图Fig.6 Response surface plot and contour line of effects between inoculum and culture time on glucoamylase activity
由图6可知,响应曲面的坡度较为陡峭,表明响应值(糖化酶活力)对接种量和培养时间的改变较为敏感。当培养时间和接种量分别保持不变时,糖化酶活力随接种量和培养时间的变化规律基本相同,均为先增高后降低。当培养时间在48.4~52 h、接种量在0.6‰~1.1‰时对提高糖化酶活力最有利。从等高线图可以看出两个因素的交互作用较弱,对糖化酶活力的影响不显著。
2.4 验证试验
在以上试验结果分析及模型拟合的基础上,利用“Design-Expert”软件中的Optimization功能对制曲工艺进行优化,得到其最佳工艺养条件为培养温度38.70℃,接种量0.85‰,培养时间50.47 h。在此条件下糖化酶活力的预测值为1 111.52 U/g。在最佳培养条件下对预测值进行验证,实际测得的糖化酶活力为(1 110.79±5.71)U/g,与预测值基本一致,表明预测值和真实值之间拟合较好,验证了模型的可靠性。
3 结论
通过BBD响应面设计试验对影响米曲糖化酶活力的3个主要因素(培养温度、培养时间、接种量)及制曲的最佳工艺条件进行了研究,结果显示3个因素对米曲糖化酶活力的影响是显著的。利用统计学方法建立了米曲糖化酶活力与3个因素间的二次回归模型,其回归方程为:Y=1086.35+ 105.21A+18.11B+27.15C+4.32AB+5.00AC+23.20BC-124.82A2-88.83B2-136.37C2,决定系数R2=0.9827。并得到其最佳工艺条件为:培养温度38.70℃,接种量0.85‰,培养时间50.47h。在此条件下糖化酶活力的预测值为1111.52U/g。在最佳培养条件下对预测值进行验证,实际测得的糖化酶活力为(1 110.79±5.71)U/g,与预测值基本一致。
[1]周立平,孙佰申,陈旭峰.酿酒用米曲霉若干菌株的培养特性研究[J].酿酒科技,2004(3):30-32.
[2]汪健国.传统麦曲在黄酒酿造中的作用和特色[J].中国酿造,2004,23(10):29-31.
[3]卢燕云,林建国,李明,等.复合诱变选育酸性蛋白酶高产菌株[J].中国酿造,2009,28(1):49-51.
[4]唐湘华,许锁链,慕跃林,等.米曲霉ASP-m21产果胶酶及其酶活性质[J].食品与生物技术学报,2008,27(2):112-116
[5]刘毅,袁月华.米曲霉产氨基酰化酶最佳活力条件的研究[J].氨基酸和生物资源,2009,31(1):29-32.
[6]FEBE F.Use of response surface methodology for optimizing process parameters for the production of amylase byAsperillus oryzae[J].Biochem Eng J,2003,15(2):107-115.
[7]许牡丹,范金波,檀志芬,等.米曲霉β-半乳糖苷酶的纯化与性质研究[J].陕西科技大学学报,2003(4):13-16.
[8]赵飞龙,徐亚平.米曲霉的应用研究进展[J].中国酿造,2006,25(3):8-10.
[9]张玉荣,周显青,张秀华,等.大米蒸煮条件及蒸煮过程中米粒形态结构变化的研究[J].粮食与饲料工业,2008(10):1-4.
[10]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
[11]全国食品发酵标准化中心.GB 8276—2006食品添加剂-糖化酶制剂[S].北京:中国标准出版社,2006.
[12]刘寅,张永光,张汝兵,等.响应面法优化产酸丙酸杆菌丙酸发酵条件的研究[J].食品工业科技,2010(5):167-170.
[13]邓苗毅,任伟新.基于响应面方法的结构有限元模型修正研究进展[J].铁道科学与工程学报,2008(6):42-45.
[14]DYAH H,WARDHANI,JOSE A,et al.Optimization of antioxidants extraction from soybeans fermented byAspergillus oryzae[J].Food Chem,2010,118(3):731-739.
[15]徐向宏,何明珠.试验设计与Design—Expect、SPSS应用[M].北京:科学出版社,2010,7.
[16]吴海滨.利用米曲霉发酵鳕鱼皮制备生物活性肽的研究[D].青岛:中国海洋大学硕士论文,2011.
Optimization ofAspergillus oryzaekoji preparation technology
ZHAO Zhongkai,YANG Jiangang*,MA Yingying,LIN Qiu,LIN Yan
(College of Bioengineering,Sichuan University of Science&Engineering,Zigong 643000)
On the basis of single factor experiment,three main factors of culture temperature,time and inoculum which affect the glucoamylase activity ofAspergillus oryzaewere selected,and the optimal processing condition was studied by response surface methodology.Result showed that the effect of three factors on glucoamylase activity ofA.oryzaewas significant.The Design-Expert software was applied to process the experimental data,and the optimal process conditions were as follows:culture temperature 38.70℃,inoculum 0.85‰,culture time 50.47 h.Under these conditions,the perdictive value of glucoamylase activity was 1 111.52 U.The verification test was conducted under the optimal condition,it showed that the actual value was very close to the predictive value.
response surface methodology;Aspergillus oryzae;process optimization
TS261.1
A
0254-5071(2014)07-0083-05
10.11882/j.issn.0254-5071.2014.07.018
2014-04-28
四川理工学院基金(2011RC001;2012RC014);酿酒生物技术与应用四川省重点实验室基金(NJ2012-13)
赵中开(1988-),男,硕士研究生,研究方向为发酵工程。
*通讯作者:杨建刚(1961-),男,教授,博士,研究方向为酿酒工程与技术。
