椰纤果发酵液中降解细菌纤维素酵母菌株的分离及鉴定
2014-02-20李斌钟春燕王锡彬王志国向东海南大学食品学院海南海口5708海南椰国食品有限公司海南海口5703
李斌,钟春燕,王锡彬,王志国,向东*(.海南大学食品学院,海南海口5708;.海南椰国食品有限公司,海南海口5703)
椰纤果发酵液中降解细菌纤维素酵母菌株的分离及鉴定
李斌1,钟春燕2,王锡彬1,王志国1,向东1*
(1.海南大学食品学院,海南海口570228;2.海南椰国食品有限公司,海南海口570311)
从被微生物污染的椰纤果发酵液中分离筛选出13株能够降解细菌纤维素的酵母菌株,并对这些菌株产生的纤维素酶粗酶液进行了酶活测定。选择羧甲基纤维素酶活(CMCA)和滤纸酶活(FPA)较高的酵母菌株3-1进行了鉴定,鉴定酵母菌株3-1为东方伊萨酵母(Issatchenkia orientalis),菌株培养液CMCA为71.48 IU,FPA为81.07 IU。
东方伊萨酵母;纤维素酶;分离;细菌纤维素
以椰子水作为生产培养基的发酵产品“椰纤果”(俗称“椰果”或“高纤椰果”),其主要成分是细菌纤维素(bacterial cellulose,BC),纤维素通常占干质量的95%以上。由于采用浅盘静置发酵,最终发酵得到的细菌纤维素成品通常呈膜状,具有一定厚度,呈白色凝胶状。细菌纤维素的结构与植物纤维素的结构一致,同属于天然纤维素,其分子结构上与天然(植物)纤维素相同,均是D-葡萄糖之间以β-1,4糖苷键聚合而成[1-2],细菌纤维素与植物纤维素的主要区别在于:无木质素、果胶和半纤维素等伴生产物,具有高结晶度(可达95%,植物纤维素的为65%)以及高的聚合度(degree of polymerization,DP)值(2 000~8 000)。从分子结构和纤维素酶催化水解纤维素的机理来看,能够降解植物纤维素的纤维素酶也能够降解细菌纤维素,但目前这方面的研究较少报道。
从自然界中筛选产纤维素酶的微生物菌株,较为常见的是霉菌,这些菌株已被应用生产或可为生产高活性纤维素酶提供新菌种或酶基因[3],不同霉菌产纤维素酶的培养条件及酶学性质也有较多报道[4-7]。除霉菌外,利用细菌发酵也可生产纤维素酶,细菌分泌的纤维素酶大部分都适应中性和偏碱性的环境,对天然纤维素具有很强的分解能力,相关研究报道较多[8-11]。在菌株选育方面,文献报道了利用紫外线和亚硝酸复合诱变进行高产纤维素酶菌株的选育,产酶性能稳定[12]。近年来利用基因重组技术获得产纤维素酶的工程菌株成为研究热点[13],有文献报道将具有纤维素酶基因的重组工程菌株定植于动物消化道内,从而提高饲料粗纤维消化率[14-15]。酵母菌通常被认为不产或极少产纤维素酶,相关报道较少,有研究者报道了从海洋微生物中筛选到一株产纤维素酶的酵母菌,具有较高的酶活力[16]。本研究从被污染的椰纤果发酵液中筛选分离出能够降解细菌纤维素凝胶的酵母菌株,并对其中纤维素酶活力较强的菌株进行了鉴定。
1 材料与方法
1.1 材料与试剂
化学试剂均为分析纯:上海国药集团;生化试剂:上海生工公司。
1.1.1 菌株
细菌纤维素凝胶生产菌株:木醋杆菌(Acetobacter xylinum)HN001,海南大学食品综合实验室保藏。
细菌纤维素降解菌株:海南某椰纤果生产车间中发生污染的椰纤果发酵液中采样。
1.1.2 培养基
细菌纤维素凝胶生产培养基:椰子水50 mL,KH2PO40.1g,MgSO4·7H2O0.2g,蔗糖3g,蒸馏水50mL,pH值自然。
菌株筛选固体培养基:羧甲基纤维素钠(sodium carboxyl methyl cellulose,CMC-Na)0.6 g,蛋白胨1.0 g,酵母膏0.5 g,KH2PO40.1g,MgSO4·7H2O0.2g,琼脂2.0g,蒸馏水100mL,pH值自然。
菌株产酶培养基:CMC-Na 1.0 g,蛋白胨0.5 g,酵母膏0.5 g,蒸馏水100 mL,pH值自然。
1.2 仪器与设备
SW-CJ-1F单人双面净化工作台:苏州净化设备有限公司;YX280A手提式不锈钢蒸汽消毒器:上海三申医疗器械有限公司;SHP-1500生化培养箱:上海精宏实验设备有限公司;SHZ-82气浴恒温振荡器:常州市华普达教学仪器有限公司;WFJ7200型分光光度计:上海尤尼柯实验设备有限公司。1.3菌株的筛选与分离
1.3.1 采样
采样地点为海南某椰纤果生产车间,椰纤果生产方式为浅盘静置发酵。挑选被微生物污染而发生明显纤维素降解的发酵盘,用灭菌的移液管吸取椰纤果污染部位5 mL发酵液,装入灭菌的空试管中备用。
1.3.2 细菌纤维素凝胶的培养
将菌株A.xylinumHN001接种于细菌纤维素凝胶生产培养基中,28℃培养2~3 d,直至液体培养基上层出现一层3~5 mm厚度的细菌纤维素凝胶薄膜。
1.3.3 降解细菌纤维素菌株的筛选与分离
将1.3.1采样获得的发酵液做系列稀释梯度100、10-1、10-2、10-3、10-4、10-5,分别涂布筛选平板,平板采用1.1.2中所述的菌株筛选固体培养基。倒置恒温28℃培养2 d,分离出能够旺盛生长的菌株,将菌株编号,用接种环挑取少许菌体涂布于1.3.2中所获得的细菌纤维素凝胶薄膜表面,培养观察2~3 d,若发现细菌纤维素凝胶膜出现明显的降解,则证明该菌株能够产生纤维素酶,并具有降解细菌纤维素的能力。
1.4 酶活的测定
筛选出的菌株用1.1.2所述的菌株产酶培养基培养5 d,粗酶液采用国际理论与应用化学联合会(internationalunion of pure and applied chemistry,IUPAC)推荐的方法[17]来测定滤纸酶活(filter paper activity,FPA)和羧甲基纤维素酶活(carboxyl methyl cellulose enzyme activity,CMCase)。酶活力单位用国际单位IU来表示,纤维素酶酶活力单位的定义:在酶的催化下,每分钟形成1 μmol葡萄糖时所用该酶的量为1个酶活国际单位(IU)。
1.5 菌株的鉴定
筛选出纤维素酶活力较高的菌株,委托中国科学院微生物研究所进行鉴定。
2 结果与分析
2.1 菌株的采样
从海南某椰纤果厂生产车间中挑选出被微生物污染的细菌纤维素凝胶,图1为凝胶表面部分纤维素被降解,表面出现空洞状,图2凝胶完全被降解,呈液体状。图1和图2表明在污染椰纤果细菌纤维素凝胶的微生物中,存在能够产生纤维素酶的微生物,导致细菌纤维素发生降解。按照1.3.1所述的方式进行采样,可以筛选出产纤维素酶的微生物菌株。

图1 部分被降解的细菌纤维素Fig.1 Partly degraded bacterial cellulose

图2 全部被降解的细菌纤维素Fig.2 Completely degraded bacterial cellulose
2.2 筛选和分离
按照1.3.3所述的方法对菌株进行筛选和分离,共筛选分离出13株能够产纤维素酶的菌株,分别编号为1-1;1-2;1-3;2-1;3-1;3-2;3-3;4-1;4-2;4-3;5-1;5-2;5-3,通过显微镜观察,发现这些菌株均为酵母菌。这些菌株的菌体涂布于1.3.2所述的细菌纤维素凝胶膜表面,均能对细菌纤维素进行降解。
2.3 酶活测定
2.3.1 羧甲基纤维素酶活力测定
对筛选出的13株酵母按1.1.2中的产酶培养基进行产酶培养,离心分离后测定其上清液CMC酶活力,结果发现各株酵母培养液均有一定CMC酶活,但差异较大,由图3可知,1-2酵母菌株培养液CMC酶活性较高。

图3 菌株发酵液CMC酶活Fig.3 CMCA of strain fermentation broth
2.3.2 滤纸酶活力的测定结果
对筛选出13株酵母按1.4中的方法进行产酶培养后,离心分离后测定其上清夜FPA酶活力,结果发现各株酵母培养液均有一定FPA酶活,如图4所示。由图4可知,3-1,1-3酵母菌株培养液FPA酶活性较高。
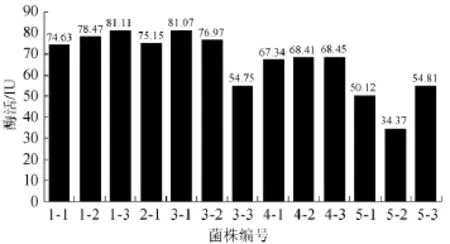
图4 菌株发酵液滤纸酶活Fig.4 FPA of strain fermentation broth
从上述13株酵母菌选择CMC酶活及FPA酶活都相对较高的菌株3-1,委托中国科学院微生物研究所进行鉴定。
2.4 菌株的鉴定
2.4.1 培养和显微形态特征
麦芽汁液体培养基中25℃培养3 d,细胞球形、腊肠形,大小为(3.6~10.8)μm×(2.4~6.0)μm,有沉淀形成。麦芽汁琼脂斜面25℃培养30 d,菌落奶酪状,乳白色,表面平滑,不反光,边缘须状。玉米粉琼脂Dalmau平板培养,产生假菌丝。菌株3-1显微形态如图5所示。

图5 酵母菌株3-1显微形态Fig.5 Morphology of yeast strain 3-1
2.4.2 理化特征
由表1可知,菌株3-1可发酵葡萄糖,但不能发酵麦芽糖、蔗糖、半乳糖、乳糖、棉子糖等其他糖类,碳源只能同化琥珀酸及柠檬酸,不能同化其他碳源,这表明本菌株可利用的碳源范围较窄,在培养环境中出现碳源缺乏时,可产生纤维素酶对纤维素进行降解,使之产生能够利用的葡萄糖单元。
2.4.3 rRNA基因ITS区序列测定
通过rRNA基因ITS区序列,结果如下:
GTCTCGCAACACTCGCTCTCGGCCGCCAAGCGT CCCTGAAAAAAGTCTAGTTCGCTCGGCCAGCTTCGC TCCCTTTCAGGCGAGTCGCAGCTCCGACGCTCCTTT ACACGTCCGCTCCCCCAACTCTGCGCACGCGCAAGA TGGAAACGACGCTCAAACAGGCATGCCCCCCGGAA TGCCGAGGGGCGCAATGTGCGTTCAAGAACTCGAT GATTCACGATGGCTGCAATTCACACTAGGTATCGCA TTTCGCTGCGCTCTTCATCGATGCGAGAACCAAGAG ATCCGTTGTTGAAAGTTTTGTTTGTTTTTCGTAGATT TCTCTTGTCGACTATATTCCACATTTTAGGTGTTGTT GTTTTCGTTCCGCTCACGCAGTCTAGTACTAAATCA CAGTAAGATCCTTCCGCAGGTTCACCTACGGAAACC TTGTTACGAC。
根据上述鉴定结果,最终鉴定菌株3-1为一株东方伊萨酵母(Issatchenkia orientalis)。
3 结论
海南自1997年开始,利用丰富的椰子水资源作为培养基,以木醋杆菌为菌种生产细菌纤维素凝胶(又称椰纤果),采用浅盘方式培养,生产周期为4~7 d。目前年生产能力近30万t,产值超过10亿元,是近年来海南新兴的食品工业的支柱产业,纤维素凝胶的主要成分为纤维素,凝胶干质量中99%都为纤维素。而由于生产技术不成熟,杂菌污染严重,损失约占总产量的40%~50%。经调查研究表明,造成细菌纤维素凝胶生产损失的微生物有酵母、霉菌和细菌。而其中能造成毁灭性破坏的只有酵母菌,约占总损失量的90%。一盘300 g的椰纤果细菌纤维素凝胶48 h就可以被酵母菌降解为液体,这与相关报道酵母菌很少产酶或不产酶十分矛盾。
本研究筛选的一株东方伊萨酵母(Issatchenkia orientalis)在产酶培养液中培养5d,测定的CMC酶活达71.48IU,FPA滤纸酶活达81.07IU,离心后的清液干质量为4%,如按干质量计算CMC酶活达2026.75IU,FPA酶活达1167.5IU。而产酶较高的木霉的CMC酶活在1 200~1 800 IU,FPA滤纸酶活在300~600 IU左右。由此可知,酵母产酶活性可与目前产酶量最高的木霉相媲美,与目前市售纤维素酶试剂相当。本研究证明一些酵母菌在特定条件下,能大量地产生纤维素酶,而且具有较高的酶活力。酵母菌安全性高,而且具有酶的外分泌性和产酶量高的特点,高产纤维素酶酵母的发现,必将对纤维素酶的研究与利用产生重大的影响。
[1]孙召霞,张素风,梅星贤.细菌纤维素的结构与性质及其应用研究进展[J].湖北造纸,2013(3):12-14.
[2]李静.细菌纤维素的制备及结构与性能研究[D].青岛:青岛大学硕士论文,2008.
[3]闫峰,徐凤花,顾金刚,等.木霉属真菌的生物降解及生物转化作用研究进展[J].微生物学杂志,2009,29(3):77-80.
[4]刘森林,邢苗,刘刚,等.碱性纤维素酶革兰氏阴性菌株筛选及酶学性质研究[J].微生物通报,2005,32(4):91-94.
[5]林志伟,孙冬梅,张红梅,等.黄绿木霉菌产纤维素酶条件优化[J].微生物通报,2008,35(1):59-62.
[6]伍红,陆兆新,吕玫,等.黑曲霉AF-98固体发酵产纤维素酶的产酶条件研究[J].菌物学报,2006,25(3):475-480.
[7]胡翠英,李良智,赵建,等.三种霉菌产纤维素酶能力分析与培养条件优化[J].生物技术通报,2014(1):182-187.
[8]桂春燕.耐盐碱产纤维素酶芽孢杆菌的选育及酶学特性的研究[D].泰安:山东农业大学硕士论文,2010.
[9]韩学易.枯草芽孢杆菌纤维素酶产酶条件及酶学性质研究[D].雅安:四川农业大学硕士论文,2006.
[10]吴敏峰.产纤维素酶兼性厌氧芽孢杆菌的分离筛选及在动物生产上的初步应用[D].雅安:四川农业大学硕士论文,2007.
[11]程仕伟,李坦坦,梁会会,等.响应面优化金橙黄微杆菌YT9的发酵条件生产纤维素酶[J].中国酿造,2013,32(4):48-51.
[12]武秀琴.纤维素酶高产菌株的诱变选育[J].中国酿造,2009,28(3):84-86.
[13]赵莹.酸性纤维素酶基因在大肠杆菌和乳酸杆菌的表达及其活性检测[D].长春:吉林农业大学硕士论文,2008.
[14]孙琳.无抗性标记表达纤维素酶的罗伊乳杆菌重组菌的构建[D].杨凌:西北农林科技大学硕士论文,2011.
[15]李旺.纤维素酶基因重组野生型乳酸杆菌表达系统的构建[D].杨凌:西北农林科技大学硕士论文,2010.
[16]张亮.产纤维素酶海洋普鲁兰类酵母的初步研究及CMCase的纯化与性质研究[D].青岛:中国海洋大学硕士论文,2008.
[17]GHOSE T K.Measurement of cellulase activities[J].Pure Appl Chem, 1987,59(2):257-268.
Isolation and identification of yeast strains fromnata decoco fermentation broth for degrading bacterial cellulose
LI Bin1,ZHONG Chunyan2,WANG Xibin1,WANG Zhiguo1,XIANG Dong1*
(1.College of Food Science and Technology,Hainan University,Haikou 570228,China; 2.Hainan Yeguo Foods Co.,Ltd.,Haikou 570311,China)
From fermentation broth of polluted natade coco,13 yeast strains for degrading bacterial cellulose were isolated and the filter paper activity (FPA)and carboxyl methyl cellulose enzyme activity(CMCA)in crude fermentation broth were measured.The yeast strain 3-1 was chosen based on its higher FPA and CMCA,and it was identified asIssatchenkia orientalis.The CMCA and FPA of the strain 3-1 fermentation broth were 71.48 IU and 81.07 IU,respectively.
Issatchenkia orientalis;cellulase;isolation;bacterial cellulose
Q93-335
A
0254-5071(2014)07-0051-04
10.11882/j.issn.0254-5071.2014.07.011
2014-04-01
海南省自然科学基金(312076)
李斌(1966-),男,实验师,专科,研究方向为食品发酵工程及食品分析。
*通讯作者:向东(1976-),男,副教授,硕士,研究方向为食品科学及食品发酵工程。
