全球H5N1亚型流感病毒NA和NS基因进化趋势
2014-02-17,,,,,,
,,,,,,
(扬州大学兽医学院 农业部畜禽传染病学重点开放实验室/禽类预防医学教育部重点实验室,江苏扬州 225009)
全球H5N1亚型流感病毒NA和NS基因进化趋势
李彦芳,张治业,宋庆庆,顾 敏,陈素娟,彭大新,刘秀梵
(扬州大学兽医学院 农业部畜禽传染病学重点开放实验室/禽类预防医学教育部重点实验室,江苏扬州 225009)
为了探讨全球H5N1亚型流感病毒(IV)NA和NS基因的分子流行病学特点,本文从NCBI下载1996-2013年全球H5N1 IV的NA、NS基因序列并进行进化分析。结果显示NA和NS双基因部分缺失株在H5N1亚型IV中占有绝对的优势,NA和 NS基因部分缺失能显著影响毒株间的遗传距离,2010年后分离的H5N1亚型IV的NA基因优势流行基因型是Group-6 like,NS基因优势流行基因型为Group-2 like。
H5N1亚型;流感病毒;NA基因;NS基因;缺失
流感病毒是分节段的负链RNA病毒,为了适应环境和宿主的变化,极易发生变异,而其中一些适应株会在不断的进化过程中得以生存和保留。H5N1亚型禽流感病毒(AIV)早期水禽源的代表株A/Goose/Guangdong/1/96 具有完整的NA和NS基因。近年来,H5N1亚型AIV的NA茎部在49-68位出现了20个氨基酸的缺失(Δ NA),其NS1蛋白在80-84位出现了5个氨基酸的缺失(Δ NS),研究者们发现自2003年以来,大多数H5N1亚型流感病毒都有 Δ NA[1-3]和 Δ NS[4-7]这两种缺失现象。但是对于Δ NA、Δ NS这两种缺失现象在H5N1亚型流感病毒中首次出现的时间、宿主来源差异、现今流行情况等分子流行病学信息还不是很清楚。有鉴于此,本文对1996—2013年之间GenBank数据库中收录的所有H5N1亚型流感病毒代表株的NA和NS基因序列进行了统计分析及分子遗传进化分析,旨在了解近十几年来全球H5N1亚型流感病毒的NA和NS基因部分缺失的分子流行病学特点和遗传进化规律。
1 材料与方法
1.1 H5N1亚型流感病毒的序列来源
我们从NCBI网站上的流感病毒专用数据库中(http://www.ncbi.nlm.nih.gov/genomes/FLU/ Database/nph-select.cgi?go=database)下载了1996-2013年之间全球H5N1亚型流感病毒代表株的NA、NS基因序列。这些毒株同时具有NA和NS基因序列。
1.2 对所下载毒株的NA和NS基因的部分氨基酸缺失情况进行统计分析
以A/Goose/Guangdong/1/96 作为参考毒株,其NA和NS基因均未发生氨基酸缺失现象,属于NA和NS基因均未缺失株(NANS)。以A/ mallard/Huadong/S/2005[8]作为另一个参考毒株,其NA茎部在49-68位发生了20个氨基酸的缺失,NS1蛋白在80-84位发生了5个氨基酸的缺失,属于NA和NS双基因部分缺失株(Δ NA Δ NS)。
将所下载毒株的NA和NS基因序列用MegA-lign进行多序列比对分析,记录各个毒株的NA和NS蛋白是否有部分氨基酸缺失情况,分类为NANS、 NA单基因缺失株(Δ NANS)、NS单基因缺失株(NA Δ NS)、Δ NA Δ NS,统计各类毒株的时间分布情况、宿主来源情况,并计算出Δ NA Δ NS所占的百分比。
1.3 序列的编辑、比对以及遗传进化树的绘制
使用DNASTAR Lasergene7.1版本软件中的EditSeq 与MegAlign模块对所下载的序列进行编辑、拼接和比对。用Bioedit 7.0软件编辑所下载的序列,删除一些不完整的基因序列,将所有序列剪辑成等长,便于后期遗传进化树的绘制。采用Molecular Evolutionary Genetics Analysis 5.0软件中的邻接距离法(Neighbor-joining,NJ)生成遗传进化树,分支处的数值表示1000次重复抽样检验的百分率数值,标尺显示序列两两之间的进化距离[9]。用 MEGA 5.0 软件计算种群平均变异率,依据遗传距离小于种群平均变异率的毒株归于一个分支的标准,对遗传进化树进行分组。
2 结果
2.1 历年来H5N1亚型流感病毒的NA和NS基因部分缺失情况
为了使所下载的序列信息能最大限度地接近于H5N1亚型流感病毒的整个群体情况。我们将流感毒株名称中“型别/宿主/分离地点/毒株编号/分离年代” 除了毒株编号不同之外,其余信息都完全相同的分离株默认为一个子代病毒群,仅随机下载其中的一个毒株序列,作为该群的代表毒株。我们共下载了949株H5N1亚型流感病毒的NA和NS基因序列,分别来源于家禽、野生禽类、哺乳动物和环境。样本来源分析显示,57%的H5N1亚型流感病毒来源于家禽,28.9% 的毒株来源于野生禽类,表明家禽是H5N1亚型流感病毒的主要宿主,其次是野生禽类。
与参考毒株的相应基因比对分析发现:1997年首次出现了Δ NANS,而NA Δ NS首次出现的时间是2000年,Δ NA Δ NS首次出现的时间是2002年。值得注意的是,在Δ NA Δ NS出现的第二年,即2003年,Δ NA Δ NS已占当年所有H5N1亚型流感病毒的76.1%,而到2004年时,Δ NA Δ NS所占的比例已高达90%,随后一直保持在相对稳定的水平上,成为H5N1亚型流感病毒的绝对优势流行株(表1)。分析还发现,NA和NS基因部分缺失现象分别占鸡源H5N1亚型AIVs的96.2%和94.9%;占野生禽源 H5N1 亚型AIVs的93.3%和94.1%;占鸭源 H5N1 亚型AIVs的81.2%和81.8%;占鹅源H5N1亚型AIVs的51.2%和69.8%。
2.2 NA基因以及NS基因的遗传进化分析
1996年的H5N1亚型流感病毒仅有1株病毒A/Goose/Guangdong/1/96,该病毒具有完整的NA和NS基因。1997年共有13株H5N1亚型流感病毒,按照区域和宿主来源是否相同的标准,至少可分为湖北鸡源、广东鹅源、香港鸡源、香港人源、香港环境共5个群;而按照NA茎部氨基酸是否缺失以及缺失的位置是否相同的标准,可分为NA茎部未缺失、NA茎部在49-68位缺失20个氨基酸、NA茎部在55-74位缺失20个氨基酸、NA茎部在55-73位缺失19个氨基酸共4个群。由此看来,A/Goose/Guangdong/1/96-like 的H5N1亚型流感病毒在第2年就在不同宿主、不同地区流行起来,并且NA基因型也相对复杂。
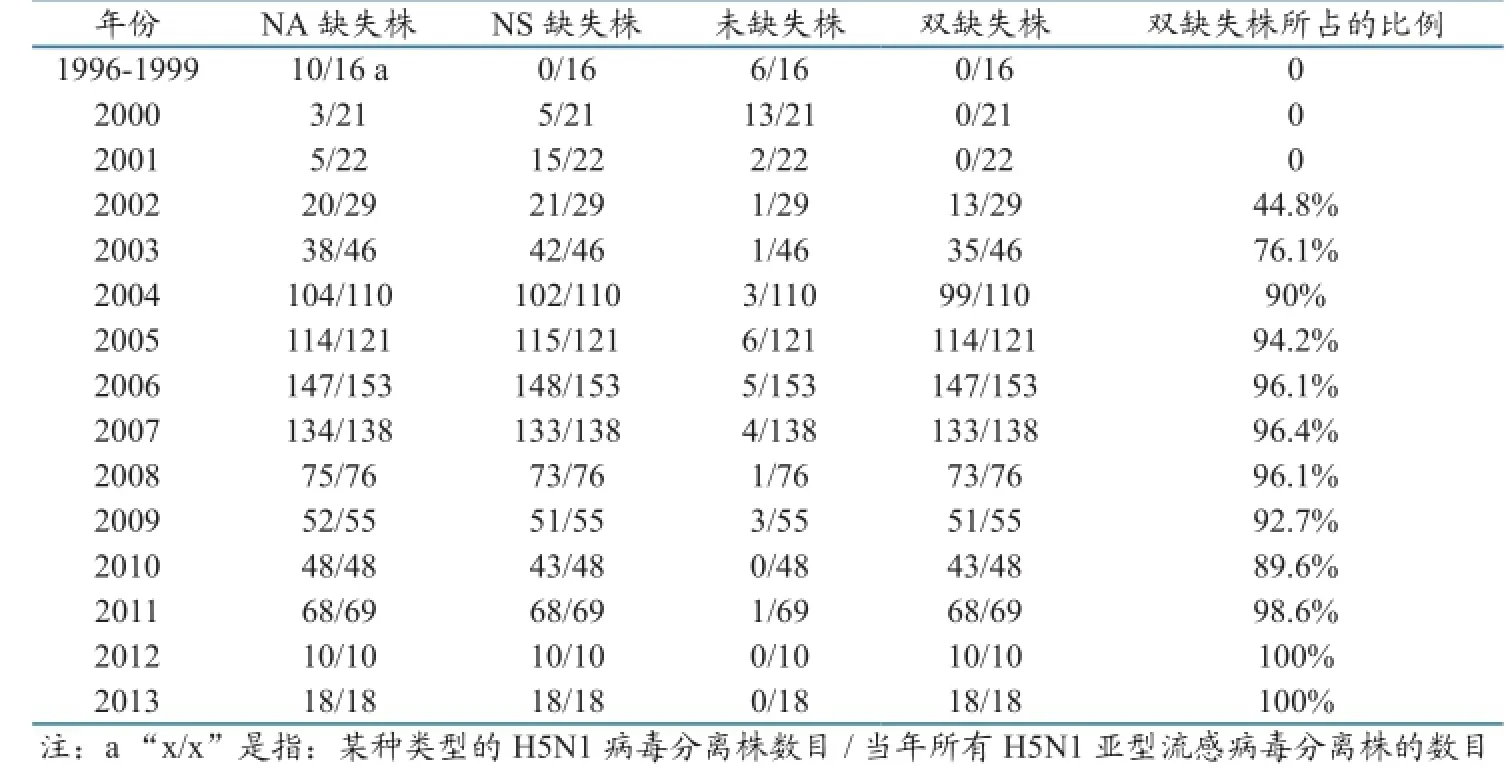
表1 1996—2013年全球H5N1亚型流感病毒的NA、NS基因部分缺失情况统计分析
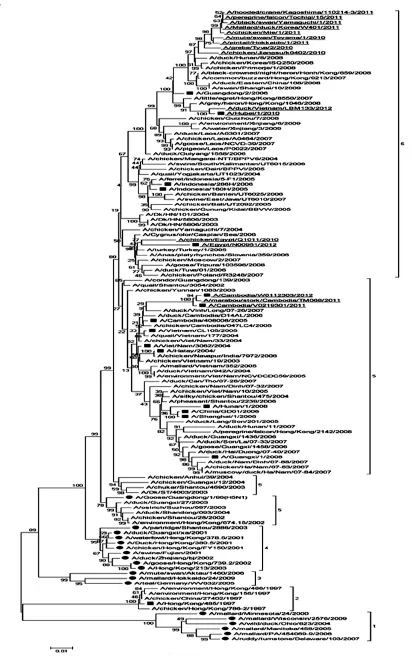
图1 H5N1亚型流感病毒的NA基因进化树
H5N1亚型流感病毒NA基因的种群平均变异率为3.5%,根据序列之间的遗传距离小于3.5%归属于同一分支的划分标准,将NA基因遗传进化发生树划分为 6个分支。由于进化树过于庞大,在每个分支中随机选出1/5的毒株序列绘制了一个小进化树(图1)。其中NA茎部未缺失的毒株分处于3个独立的分支上;而 NA茎部缺失的毒株则分布于其余的3个分支中。2010年后分离的H5N1亚型流感病毒的NA基因主要集中在5、6分支上,其中分支6中流行株最多,可能是近年来H5N1亚型流感病毒NA基因的主要优势流行基因型。
H5N1亚型流感病毒NS基因的种群间平均变异率为2.5%,根据序列之间的遗传距离小于2.5%归属于同一分支的划分标准,将NS基因的遗传进化发生树划分为7个分支。同样在每个分支中随机选出1/5的毒株序列绘制了一个小进化树(图2)。其中NS基因未缺失的毒株主要集中在1和5分支上;而 NS1蛋白在80-84位缺失5aa的毒株则分布于其余的5个分支中。2010—2012年之间分离的大多数H5N1亚型流感病毒的NS基因主要集中在2、4、7这3个三支上,其中分支2中的流行株最多,可能是近年来H5N1亚型流感病毒NS基因的主要优势流行基因型。绝大多数人源H5N1亚型流感病毒都属于Δ NA Δ NS,并且毒株较为分散地位于遗传进化树的主要分支内,都与某些禽源毒株的同源性较高。对NA和NS基因的遗传进化树进行对比分析发现,NA基因处于相邻位置的大多数H5N1亚型流感病毒的NS基因也处于相邻位置。
3 讨论
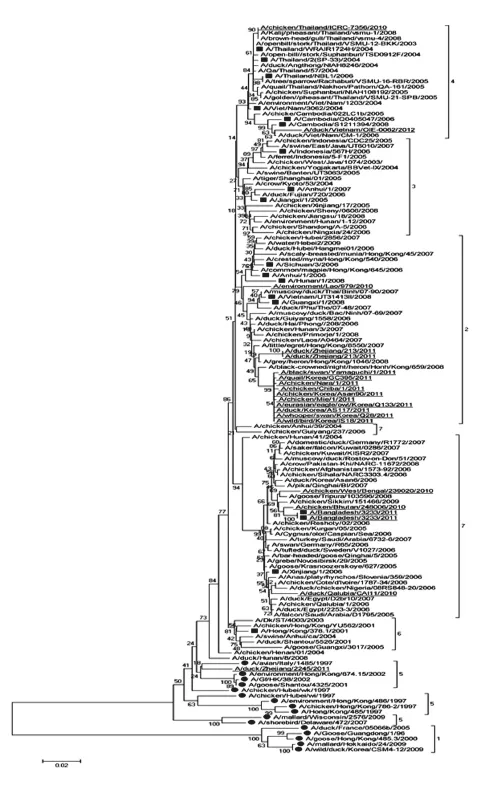
图2 H5N1亚型流感病毒的NS基因进化树
流感病毒的NA茎部缺失现象较为多见。迄今为止,N1亚型流感病毒的NA茎部氨基酸模式大致有以下6种情况:茎部没有氨基酸缺失(A/Gs/ GD/96/H5N1-like);在57-72位缺失16个氨基酸(A/ WSN/33/H1N1-like);在63-77位缺失15个氨基酸(A/PR8/34/H1N1-like);在55-73位缺失19个氨基酸(A/HK/97/ H5N1-like);在54-75位缺失22个氨基酸(A/ Ck/Italy/99/H7N1-like);在49-68位缺失20个氨基酸(Δ NA)[10-11]。自2003年以来,Δ NA已成为H5N1高致病性禽流感病毒的特征性标志,大多数研究学者从流行病学角度推测认为 Δ NA是H5N1亚型AIV从水禽向陆生禽类进化的适应性分子标志[1-3]。非结构蛋白1(NS1)基因的核酸序列在进化上分为A和B两个系,同系间毒株的同源性为 93-100%;而不同系之间的毒株同源性却只有62%左右[12-13]。在2000年,H5N1亚型AIV 的NS1蛋白在80-84位出现了5个氨基酸的缺失[6],而2001年以后,除了基因型X0-X3的毒株外,几乎所有的H5N1亚型流感病毒都有Δ NS缺失现象[4-7]。
本研究对GenBank 数据库中历年来的H5N1亚型流感病毒分离株的NA 和NS基因部分缺失情况进行了统计,结果显示H5N1亚型流感病毒的NA、NS基因部分缺失现象在不同宿主中的分布情况有所差异,鸡源分离株中NA、NS基因缺失现象最普遍,水禽源的比例略低,这表明Δ NA和 Δ NS缺失现象很可能都是H5N1亚型AIV从水禽向陆生禽类进化的适应性分子标志。2004年以后,Δ NA Δ NS所占的比例都维持在90%左右,这表明Δ NA Δ NS在H5N1亚型流感病毒中占有绝对的生存优势[3,6-7,10]。由此推测,与NANS、Δ NANS和NA Δ NS相比,Δ NA Δ NS可能具有更强的生存优势,具体的机制和生物学意义还有待于进一步研究。
从历年H5N1亚型流感病毒的NA和NS基因的遗传进化树中可以看出,NA基因部分缺失株与NA基因未缺失株所在的分支相对独立,且NS基因部分缺失株与NS基因未缺失株所在的分支也相对独立,这表明Δ NA和Δ NS缺失现象能显著影响H5N1亚型流感病毒之间的遗传距离。由于2010年后分离的大多数H5N1亚型流感病毒的NA基因位于分支6中,而NS基因则位于分支2中,并且NA基因处于相邻位置的大多数病毒的NS基因也处于相邻位置。因此,我们推断自2010年以来,H5N1亚型流感病毒的NA基因主要优势流行基因型是Group-6 like,NS基因主要优势流行基因型为Group-2 like,并且病毒NA和NS基因的进化是同步的。
[1] Campitelli L,Mogavero E,De Marco M A,et al. Interspecies transmission of an H7N3 infuenza virus from wild birds to intensively reared domestic poultry in Italy[J]. Virology ,2004,323(1):24-36.
[2] Guan Y,Poon L L,Cheung C Y,et al. H5N1 infuenza:a protean pandemic threat[J]. Proc Natl Acad Sci U S A ,2004,101(21):8156-8161.
[3] Wang Q Z,Long J X,Hu S L,et al. [Biological signifcance of amino acids deletion in NA stalk of H5N1 avian infuenza virus[J]. Wei Sheng Wu Xue Bao,2006,46:542-546.
[4] Li K S,Guan Y,Wang J ,et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia[J]. Nature ,2004,430(6996):209-213.
[5] Lipatov A S,Andreansky S,Webby R J ,et al. Pathogen-Fesis of Hong Kong H5N1 infuenza virus NS gene reassortants in mice:the role of cytokines and B- and T-cell responses[J]. J Gen Virol,2005,86:1121-1130.
[6] Long J X,Xue F,Peng Y,et al. The deletion of nucleotides of NS gene from 263 to 277 of H5N1 increases viral virulence in chicken[J]. Wei Sheng Wu Xue Bao,2006,46(2):301-305.
[7] Zhou H,Jin M,Chen H,et al. Genome-sequence analysis of the pathogenic H5N1 avian infuenza A virus isolated in China in 2004[J]. Virus Genes ,2006,32:85-95.
[8] Tang Y H,Wu P P,Sun Q,et al. Role of amino acid residues at positions 322 and 329 of hemagglutinin in virulence of H5N1 avian infuenza virus[J]. Bing Du Xue Bao,2008,24:340-344.
[9] Toward a unifed nomenclature system for highly pathogenic avian infuenza virus(H5N1)[J]. Emerg Infect Dis,2008,14:e1.
[10] Zhou H,Yu Z,Hu Y ,et al. The special neuraminidase stalk-motif responsible for increased virulence and pathogenesis of H5N1 influenza A virus[J]. PLoS One ,2009,4(7):e6277.
[11] Li J,Zu Dohna H,Cardona C J,et al.Emergence and genetic variation of neuraminidase stalk deletions in avian infuenza viruses[J]. PLoS One ,2011,6(2):e14722.
[12] Ludwig S,Schultz U,Mandler J,et al. Phylogenetic relationship of the nonstructural (NS) genes of influenza A viruses[J]. Virology ,1991,183(2):566-577.
[13] Treanor J J,Snyder M H,London W T,et al.The B allele of the NS gene of avian influenza viruses,but not the A allele,attenuates a human influenza A virus for squirrel monkeys[J]. Virology ,1989,171(1):1-9.
Global Evolution Trend of NA and NS Genes of H5N1 Subtype Infuenza Viruses
Li Yanfang,Zhang Zhiye,Song Qingqing,Gu Min,Chen Sujuan Peng Daxin,Liu Xiufan
(Key Laboratory of Animal Infectious Disease,Ministry of Agriculture; Key Laboratory for Avian Preventive Medicine,Ministry of Education; College of Veterinary Medicine,Yangzhou University, Yangzhou,Jiangsu 225009)
To elucidate the molecular epidemiological characteristics of NA and NS genes of H5N1 subtype infuenza viruses in the world,the sequences of NA and NS genes of H5N1 subtype infuenza viruses from 1996 to 2013 were downloaded from NCBI database,and the phylogenetic tree was constructed. The results showed that H5N1 viruses with partial deletions in both NA and NS protein became the prevailing strains worldwide. The deletions in NA and NS proteins affected the genetic distance. In particular,H5N1 viruses isolated since 2010 possessed Group-6 like NA gene and Group-2 like NS gene.
H5N1 subtype;infuenza virus; NA gene;NS gene; deletion
S855.3 < class="emphasis_bold"> 文献标识码:C
C
1005-944X(2014)07-0025-05
973计划(2011CB505003);国家科技重大专项(2012ZX10004214-001-002);江苏省自然科学研究重大项目(10KJA230055);江苏省研究生科研创新计划(CXLX11_1031);江苏省青蓝工程项目(苏教师[201027号]);教育部创新团队项目(IRT0978);江苏省高校优势学科建设工程资助项目。
彭大新,刘秀梵
