激素在低钾性周期性麻痹中作用机制的研究进展
2014-02-16徐宏燕姚合斌
徐宏燕,姚合斌
激素在低钾性周期性麻痹中作用机制的研究进展
徐宏燕,姚合斌
低钾性周期性麻痹是一组与钾离子代谢相关的疾病,发病机制目前未明。临床上表现为四肢对称性迟缓性瘫痪,伴肌张力减低,腱反射减弱或消失,严重者可致严重的心律失常、呼吸肌麻痹而危及生命。发作前常有明显诱因,发作时伴内源性激素水平的变化,如胰岛素、甲状腺素、肾上腺素等。作者对上述各激素在低钾性周期性麻痹发生中的作用及潜在机制进行综述。
低钾性周期性麻痹;激素;作用机制
低钾性周期性麻痹(hypokalemicperiodic paralysis,HOPP)是一组以周期性反复发作的弛缓性骨骼肌无力或肌麻痹为特点的离子通道异常的神经肌肉疾病[1],常伴有低钾血症及心电图改变,多表现为四肢对称性迟缓性瘫痪、伴肌张力减低、腱反射减弱或消失,严重者可致严重的心律失常、呼吸肌麻痹而危及生命。HOPP常在一定的诱因下发生,多伴随体内激素水平的变化。
1 HOPP的特点和诱发因素
HOPP特征性的临床表现为低钾血症。低钾血症按其病因可以分为缺钾性低钾血症、转移性低钾血症及稀释性低钾血症。HOPP即属于转移性低钾血症,因细胞外钾转移至细胞内引起,表现为体内总钾量正常,细胞内钾增多,血清钾浓度降低。HOPP可分为原发性及继发性,目前认为原发性HOPP是一种与离子通道异常有关的常染色体显性遗传性肌肉病,发病率为1/10万,男性多于女性,男性约占62%,女性约占38%[2]。而原发性又分为家族性和散发性2型,西方国家以家族性多见,而亚洲各国则以散发性多见[3],具有显著的人种特点。在中国人群中继发性HOPP多见,且存在多种类型,最常见的是甲状腺功能亢进性周期性麻痹(thyrotoxic periodic paralysis,TPP),约占90%以上。
通常HOPP在发病前伴随明显的诱因,如饱餐、剧烈活动、应用皮质激素、大量输入葡萄糖等,这些诱因均可导致体内激素水平的变化,如胰岛素、甲状腺素,造成血钾的转移,从而诱发HOPP的发生,这种观点已经被很多研究所证实[4-6]。目前,认为HOPP发生时影响细胞内外钾分布异常的主要因素有甲状腺素、胰岛素、肾上腺素;另外,HOPP的男性发病率高于女性,这可能与雄性激素密切相关。Tran和Reeves[7]报道1例HOPP的病例,患者是一位遗传性别为女性的48岁菲律宾人,19岁时进行变性手术,社会性别由女性变为男性,每8周需注射1次外源性雄激素(睾酮);后因罹患丙型病毒性肝炎,肝脏对糖的代谢出现障碍,伴有糖耐量异常,出现高胰岛素血症,使用干扰素-γ治疗而不幸诱发甲状腺炎,伴高甲状腺素血症;静脉补钾无效,患者又不能耐受普萘洛尔治疗引起的心动过缓,遂改为螺内酯治疗,患者血钾升至正常。螺内酯之所以有效,是因为螺内酯能与雄激素共同竞争其受体,进而降低雄激素活性。2周后,患者血钾水平进一步升高,考虑与此时体内外源性雄激素作用正在逐渐减弱有关。对该病例的分析可以发现,HOPP的发生是相关激素共同作用的结果,其发病机制与激素的变化有着密不可分的关系。
2 相关激素的作用机制
2.1 胰岛素 HOPP发作时伴血钾降低,钾代谢障碍是导致麻痹的主要因素。目前,HOPP的发病机制虽尚不清楚,但倾向于肌细胞异常学说,即发作时细胞膜的钠钾泵兴奋性增加,使大量钾离子从细胞外流入细胞内,细胞外及血清中钾离子减少,造成细胞内外钾离子浓度差发生变化,引起细胞膜的去极化和对电刺激的无反应,最终造成神经肌肉传递阻滞,导致肌无力或瘫痪的发生。胰岛素可增加Na+-K+-ATP酶的活性,在葡萄糖被利用或糖原形成时,促进钾离子向胰岛素敏感的组织转运,如肌肉和肝脏[8],以利于餐后血钾的下降,维持正常钾离子的浓度梯度和膜电位,也可以解释摄入大量碳水化合物或静脉输入葡萄糖和胰岛素引起HOPP发作的原因。目前,认为胰岛素至少有2种途径促使钾离子流入细胞内:①激活细胞膜Na+-K+-ATP酶,使钠钾泵的分子变构,活性增加,细胞膜上的钾通道开放,钾离子流入细胞内;②促进糖进入细胞内,使糖原聚集,从而把钾离子带入细胞内。
张从艳等[9]对33例HOPP患者的血糖观测中发现,HOPP组较正常对照组血浆胰岛素水平明显升高,存在胰岛素抵抗现象。目前,研究公认高胰岛素血症通过诱发钾离子由细胞外转移到细胞内而引起HOPP发作[4]。体内Na+-K+-ATP酶主要分布在骨骼肌细胞膜表面,正常骨骼肌细胞外钾离子浓度降低可使正常骨骼肌细胞超极化[10]。但有研究发现,正常肌细胞在外钾离子浓度正常时可出现一定频率的去极化电位,这与肌细胞兴奋性降低有关;而在HOPP患者中,去极化电位频率较正常肌细胞明显增多并随细胞外钾离子浓度降低而明显增高[11]。HOPP患者在某些诱因作用下,可在高胰岛素血症基础上出现胰岛素脉冲式分泌,血中过多胰岛素通过作用于 Na+-H+、Na+-K+-Cl2-交换蛋白及 Na+-K+-ATP酶使钾离子大量流入细胞内,细胞外钾离子浓度降低,去极化电位频率增多而使肌细胞兴奋性降低诱发HOPP发作[12]。这可能是高胰岛素血症致HOPP发作的电生理机制之一。
2.2 甲状腺激素 TPP占继发性HOPP的90%以上,是甲状腺毒症的一种临床表现,甲状腺素对HOPP的作用已被公认,目前认为可能通过以下机制进行作用:①骨骼肌细胞膜共表达有5种钠钾泵亚单位(α1、α2、β1、β2和β4),在这5种亚单位基因序列的上游存在甲状腺激素反应元件,甲状腺激素能通过直接调节钠钾泵亚单位的转录及转录后变化增强Na+-K+-ATP酶活性,使细胞外钾离子进入细胞内增多,血清钾浓度降低[13];②甲状腺素通过增加骨骼肌上β-肾上腺素受体数目,提高β-肾上腺素受体功能,改变细胞膜对钾离子的通透性,促进钾离子从细胞外向细胞内转移,血清钾浓度降低;③甲状腺素能促进肠道对糖的吸收,故甲状腺功能亢进患者糖负荷或饱餐后血糖水平增高,并加速糖的氧化利用和肝糖原分解,促进细胞外钾离子迅速向细胞内转移,血清钾浓度降低;④与肾素-血管紧张素-醛固酮系统激活有关,肾素-血管紧张素-醛固酮系统激活可使醛固酮分泌增加,尿钾排出过多,引起血钾水平降低[14];⑤与交感神经兴奋性有关,在劳累、饱食、饮酒、受凉等条件下均可诱发HOPP,引起交感神经兴奋增强及血儿茶酚胺增高[15],增加骨骼肌中Na+-K+-ATP酶的活性,促进钾离子向细胞内转移,血清钾浓度降低。
2.3 肾上腺激素 肾上腺素对体内钾平衡有着直接的作用。有研究发现,在体内注射肾上腺素后,可立即出现短暂的高血钾,随之出现持续整个注射时期的低血钾[16]。肾上腺素诱发低钾血症主要是通过刺激β-肾上腺受体,增加Na+-K+-ATP酶活动及肌肉和肝脏对钾的摄取增多,肾上腺素也能直接或间接刺激胰岛素的释放。尽管如此,但在动物实验中将胰腺切除并不能改变由肾上腺素产生的对钾耐量增高,胰岛素并不能调节肾上腺素的低钾效果。因此,可以证明肾上腺素对钾的作用主要是β-肾上腺素能激活剂的直接作用,增加Na+-K+-ATP酶活性所致。在动物实验中,肾上腺切除动物显示出细胞对钾摄取减弱,而用肾上腺素替代后恢复正常,也提示内源性肾上腺素在调节体内钾平衡中起重要作用[17],故采用β受体阻断剂普萘洛尔可预防周期性麻痹发生。据此推测,甲状腺功能亢进者的高肾上腺素能状态与周期性麻痹有关。
2.4 性激素 由于HOPP在男性致病率高于女性,说明HOPP的发生与雄性激素关系密切。雄激素可以增加Na+-K+-ATP酶活性,而雌激素和孕激素可以抑制Na+-K+-ATP酶活性;同时,雄激素有协同甲状腺素作用,并加速与β肾上腺素能受体的结合,这也极大地证明了HOPP好发于后青春期性成熟的男性。田浩明等[18]对19例TPP患者性激素的观测中也发现,TPP组患者血清总睾酮水平明显高于无低钾肌麻痹的对照组,且血清总睾酮的变化与血清总三碘甲状腺原氨酸的变化呈正相关,与血清钾的变化呈明显的负相关,这说明TPP的发生与性激素密切相关。考虑是在高代谢状态下,性激素结合球蛋白大量增加,促使合成更多的血清总睾酮,同时血清总睾酮代谢清除率下降所致。
3 从分子生物学水平寻找相关激素在HOPP中存在的共同信号转导通路
从以上可以发现,各类激素在HOPP的发生过程中存在着交互作用,最终均通过Na+-K+-ATP酶发挥作用。由于既往研究大多从电生理的角度单独阐述各类激素在HOPP中可能的发病机制,那么可否从分子生物学水平找寻它们之间所存在的一种共同信号转导通路呢?
在进餐后,胰岛素与其受体结合增多,并能通过增加骨骼肌质膜(肌膜、T小管)泵的表达来增加Na+-K+-ATP酶的活性,其对质膜的调节可能是通过从细胞内磷脂酰肌醇3-激酶(phospho inositide3-kinase,PI3K)和非典型蛋白激酶C-依赖途径对Na+-K+-ATP酶的α、β亚基进行转位,细胞外信号调节激酶亚基1和2(extracellular signal-regulated kinase 1/2,ERK1/2)催化Na+-K+-ATP酶的磷酸化,然后通过调节膜的转运来应对胰岛素对膜的丰盈度的增加。此外,在骨骼肌中,胰岛素能诱导磷酸神经膜(一种磷酸神经膜蛋白抑制剂)的磷酸化,随后的调节会协同增加Na+-K+-ATP酶的功能[19]。Lei等[20]对成人肺泡上皮细胞的研究中发现,三碘甲状腺原氨酸对Na+-K+-ATP酶活性的影响是通过剂量依赖方法来增加ERK1/2活性,U0126和PD-98059是ERK1/2激酶的2个抑制剂,它们可以消除三碘甲状腺原氨酸诱导的Na+-K+-ATP酶α1亚基膜蛋白数量的增加和Na+-K+-ATP酶的活性。Lei等[21]在对鸡的胚胎肝细胞的研究中也发现,三碘甲状腺原氨酸可以通过质膜触发非基因信号转导通路,首先结合整合蛋白αVβ3亚基或直接结合甲状腺素受体,然后通过激活一系列的信使,包括PI3K、蛋白激酶A、蛋白激酶C、ERK1/2等,最终达到调节Na+-K+-ATP酶活性的目的[21]。而肾上腺素通过兴奋β2受体,增加Na+-K+-ATP酶β1亚基蛋白的表达来增加Na+-K+-ATP酶活性。Pesce等[22]对肺上皮细胞培育的研究发现,使用ERK1/2的抑制剂U0126和PD-98059后,Na+-K+-ATP酶活性明显下降。由此推测,β受体激动剂调节Na+-K+-ATP酶可能是通过ERK1/2途径。当β受体激动剂与受体结合后,通过瀑布式反应,激活蛋白激酶A、蛋白激酶C、环磷酸腺苷等,增加钠泵与钠的亲和力,并提高反应速度,加速钠离子外排同时将钾离子转移至细胞内,恢复细胞内外的电、化学梯度,维持细胞的可兴奋性。另外,Kang等[23]对于雄性激素在人类骨骼发育中所起作用的研究中也发现,其主要通过PI3K信号途径起作用,特殊的PI3K抑制剂LY294002能减弱雄性激素对于小鼠成骨细胞的作用。虽然该实验并不是针对Na+-K+-ATP酶的研究,但是足以说明性激素和其他激素有着相似的信号转导途径。
由此可见,各类激素在调节Na+-K+-ATP酶的反应都与ERK1/2信号途径有关(图1),由于这些实验都是在肺泡细胞、肝细胞或成骨细胞内完成,而HOPP与骨骼肌细胞相关,由于存在组织特异性,那么ERK1/2信号途径是否为各类激素在HOPP中调节Na+-K+-ATP酶的共同且唯一途径目前尚待证实,也是下一步实验力求解决的问题之一。
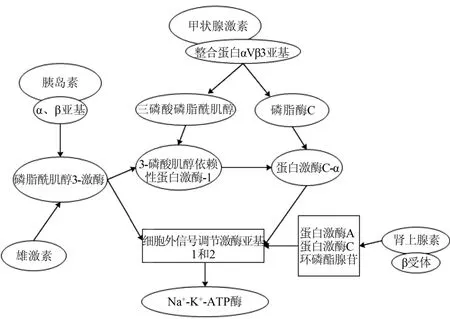
图1 各类激素调节Na+-K+-ATP酶途径
综上所述,激素与HOPP的发生关系密切。目前伴随着膜片钳及基因克隆测序技术的广泛开展,对于HOPP的研究也越来越深入。但是HOPP的发生机制仍不明确,希望能够通过对激素在HOPP发生时的信号转导通路的研究揭示HOPP发生的机制,可以更好地为今后的临床治疗提供新的依据。
【参考文献】
[1]Wu F,Mi W,Hernández-Ochoa EO,et al.A calcium channelmutantmousemodel of hypokalemic periodic paralysis[J].JClin Invest,2012,122(12):4580-4591
[2]Finsterer J.Primary periodic paralyses[J].Acta Neurol Scand,2008,117(3):145-158.
[3]Tricarico D,Camerino DC.Recent advances in the pathogenesis and drug action in periodic paralyses and related channelopathies[J].Front Pharmacol,2011,2:8.
[4]Soonthornpun S,Setasuban W,Thamprasit A.Insulin resistance in subjects with a history of thyrotoxic periodic paralysis(TPP)[J].Clin Endocrinol(Oxf),2009,70 (5):794-797.
[5]Kalita J,Goyal G,Bhoi SK,etal.Comparative study of thyrotoxic periodic paralysis from idiopathic hypokalemic periodic paralysis:an experience from India[J].Ann Indian Acad Neurol,2012,15(3):186-910.
[6]Yeh FC,Chiang WF,Wang CC,et al.Thyrotoxic periodic paralysis triggered byβ2-adrenergic bronchodilators[J]. CJEM,2013,15:1-5.
[7]Tran HA,Reeves GE.Hepatitis C infection and thyrotoxic periodic paralysis--a novel use of an old drug[J].Am J Med Sci,2008,336(6):515-518.
[8]陈国强,冉丕鑫.基础病理生理学[M].上海:上海科学技术出版社,2009:57.
[9]张从艳,刘维,郑方遒,等.低钾型周期性麻痹33例临床分析[J].天津医药,2011,39(4):370-371.
[10]Jurkat-Rott K,Weber MA,Fauler M,et al.K+-dependent paradoxicalmembrane depolarization and Na+overload,major and reversible contributors to weakness by ion channel leaks[J].Proc Natl Acad Sci USA,2009,106(10): 4036-4041.
[11]陈冬梅,余叶蓉.超重/肥胖患者高胰岛素血症与低钾周期性瘫痪的关系研究[J].四川大学学报:医学版,2013,44(4):592-595.
[12]Boini KM,Graf D,Kuhl D,et al.SGK1 dependence of insulin induced hypokalemia[J].Pflugers Arch,2009,457 (4):955-961.
[13]唐明珠,田源.甲状腺毒症性周期性瘫痪的研究进展[J].中华全科医学,2013,11(4):609-610.
[14]甘淑芳.甲状腺功能亢进合并低钾性周期性麻痹68例临床分析[J].中国医疗前沿,2013,8(18):28.
[15]刘虹兵,王民登.32例住院及门诊原发性甲状腺功能亢进症患者的误诊分析[J].右江民族医学院学报,2014,36(1):22-23.
[16]贾晓静.低钾型周期性瘫痪国内外研究现状[J].中国老年学杂志,2012,1(32):430-432.
[17]张晓山.甲亢合并周期性麻痹18例临床分析[J].中国社区医师:医学专业,2010,12(36):27.
[18]田浩明,周蓉,杨丽,等.男性甲亢性低钾周瘫患者血清甲状腺激素及性激素水平的变化[J].中国全科医学杂志,1999,2(1):23-25.
[19]Ho K.A critically swift response:insulin-stimulated potassium and glucose transport in skeletalmuscle[J].Clin J Am Soc Nephrol,2011,6(7):1513-1516.
[20]Lei J,Mariash CN,Bhargava M,et al.T3 increases Na-KATPase activity via a MAPK/ERK1/2-dependent pathway in ratadultalveolar epithelial cells[J].Am JPhysiol Lung Cell Mol Physiol,2008,294(4):L749-L754.
[21]Lei J,Bhargava M,Ingbar DH.Cell-specific signal transduction pathways regulating Na+-K+-ATPase.Focus on "short-term effects of thyroid hormones on the Na+-K+-ATPase activity of chick embryo hepatocytes during development:focus on signal transduction"[J].Am JPhysiol Cell Physiol,2009,296(1):C1-C3.
[22]Pesce L,Guerrero C,Comellas A,et al.beta-agonists regulate Na,K-ATPase via novel MAPK/ERK and rapamycinsensitive pathways[J].FEBSLett,2000,486(3):310-314.
[23]Kang HY,Cho CL,Huang KL,et al.Nongenomic androgen activation of phosphatidylinositol 3-kinase/Akt signaling pathway in MC3T3-E1 osteoblasts[J].JBone Miner Res,2004,19(7):1181-1190.
Effect of hormone in hypokalem ic periodic paralysis and its potentialmechanism
XU Hongyan,YAO Hebin
(Department of Endocrinology and Rheumatology,Navy General Hospital,Beijing 100048,China)
Hypokalemic periodic paralysis hypokalemic periodic paralysis(HOPP)is a disease with potassium ion metabolism,the pathogenesis is unclear.Clinicalmanifestations are symmetrical flaccid paralysis of limbs,hypotonia,tendon hyporeflexia or areflexia,severe cases can causes erious arrhythmias,respiratorymuscle paralysis and even endanger life.Before the onset patients often have significant incentives changes of endogenous hormone levels during the attack,such as insulin,thyroxine,epinephrine.This paper is to review the role of the various hormones in the occurrence of HOPP and the underlyingmechanism.
Hypokalemic periodic paralysis;Hormone;Mechanism of action
R746.3
A
2095-3097(2014)06-0381-04
10.3969/j.issn.2095-3097.2014.06.016
2014-07-29 本文编辑:冯 博)
国家自然科学基金面上项目(81170800)
100048北京,海军总医院内分泌风湿免疫科(徐宏燕,姚合斌)
姚合斌,E-mail:yhb196321@163.com
