硫色镰刀菌(Fusarium sulphureum)体外产毒条件的筛选
2014-02-13唐亚梅薛华丽沈科萍
唐亚梅,薛华丽,毕 阳,赵 莹,沈科萍,王 毅
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
干腐病是我国西北地区马铃薯块茎贮藏期的重要病害[1-5],多种镰刀菌(Fusariumspp.)与干腐病的发生相关,其中硫色镰刀菌(F.sulphureum)是最重要的病原物[5]。该菌具有较强的产生真菌毒素的能力,主要包括单端孢霉烯族毒素、玉米赤霉烯酮、串珠镰刀菌素和伏马菌素等[6-9],这些毒素不但引起人畜急性中毒,还具有致癌、致畸、致突变等潜在危害[7,10-13]。环境条件对镰刀菌的生长具有较大的影响,梨形镰孢(F.poae)适宜相对干燥温暖的环境,禾谷镰孢(F.graminearum)在温暖潮湿的环境中生长良好,而燕麦镰孢(F.avenaceum)和黄色镰孢(F.culmorum)则适宜凉爽和潮湿[15]。玉米串珠镰孢(F.moniliform)在25℃和pH 5的Richard培养基中培养10 d产毒能力最强[14];串珠镰孢(F.moniliform)的最佳产毒条件为马铃薯+葡萄糖培养液、pH 9、12 h光暗交替、25 ℃、培养10 d[15];尖孢镰孢(F.oxysporum)在25~30℃的PD培养液中培养15 d具有良好的产毒能力,光照和连续振荡培养有利于产毒,但pH值对产毒影响不大[16]。进一步的研究表明,27℃最有利于F.oxysporum产毒[17]。 但尚未见F.sulphureum产毒条件的报道。本实验在培养基种类、pH值、培养方式、温度和时间5种单因素筛选的基础上,通过响应面法优化F.sulphureum的最佳产毒条件,并对粗毒素的致病性进行测定,旨在为F.sulphureum的毒素研究提供参考。
1 材料与方法
1.1 材料与仪器
供试马铃薯块茎(品种:陇薯6号)2012年10月购于渭源县会川甘肃省农业科学院试验基地;F.sulphureum由甘肃省农业科学院植物保护所提供;绿豆种子购自华联连锁超市兰州安宁店。
SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;DHP-9272B型恒温培养箱 上海一恒科技有限公司。
1.2 方法
1.2.1 毒素滤液的制备
参照魏晋梅等[18]方法,将PDA上培养3~5 d的病菌接种于液体培养基中,在不同条件下培养,双层灭菌纱布过滤,滤去菌丝体,即获得具有毒素活性的培养滤液。
1.2.2 粗毒素浓缩液的制备
将最优条件下所得培养滤液及对照旋转蒸至2 mL,即得粗毒素浓缩液。
1.2.3 体外产毒条件的单因素筛选
参照柴兆祥等[19]方法,采用3个培养温度(20、25、30 ℃)、3 个培养时间(7、10、17 d)、5 个pH值(3.0、4.5、6.0、7.0、8.0)、2 种培养方式(振荡(90 r/min)与静止)及3 种培养基(PSC、Richard、Czapack)研究对F.sulphureum体外产毒的影响。
1.2.4 响应面法优化试验
在单因素试验的基础上,根据Box-Behnken的中心组合试验设计原理,以绿豆种子胚根平均长度为响应值,选择对绿豆种子胚根抑制率有显著影响的3个因素,以培养温度(X1)、pH值(X2)和培养时间(X3)为自变量,以胚根平均长度为响应值,设计三因素三水平的Box-Behnken响应面分析试验。
1.3 毒素生物活性测定
1.3.1 滤液毒性测定
参照魏晋梅等[18]方法,用培养滤液对绿豆种子胚根长度的影响表示产毒情况。将大小均匀,颗粒饱满的绿豆种子用2%次氯酸钠溶液表面消毒5 min,无菌水冲洗3 次,放入铺有灭菌滤纸、加入2 mL培养滤液和3 mL无菌水(稀释度为1∶1.5)的培养皿内,26~28 ℃恒温、黑暗条件下培养3 d后,测量胚根长度,计算平均值。每处理用种子20 粒,重复3 次。
1.3.2 粗毒素致病性测定
参照杨志敏等[5]方法,选择大小均匀、无病虫害、无损伤的马铃薯块茎,清洗后用0.5%的次氯酸钠溶液消毒20 min,冲洗后将马铃薯块茎制作成1 cm×3.5 cm的切片,先用无菌水清洗,再用75%酒精擦洗并在酒精灯火焰上灼烧去除多余酒精,置于铺有已灭菌的湿滤纸的培养皿(内径17 cm)上,黑暗恒温恒湿培养2 h后,分别将0.5 mL培养滤液浓缩液、对照滤液、无菌水滴至切片中央,27 ℃恒温培养4 d后采用El-Hassan等[20]方法调查发病率。每处理用切片8 片,重复3 次。
1.4 数据处理
全部数据采用Microsoft Excel 2003软件进行统计分析,计算标准差,并采用SPSS Statistics 17.0软件进行Duncan’s多重差异显著分析,利用Design-Expert 7.0软件进行方差分析和二次多项回归拟合。
2 结果与分析
2.1 5种单因素对F.sulphureum体外产毒的影响

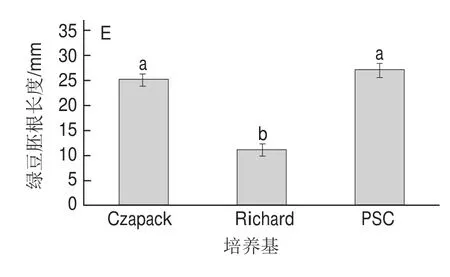
图1 培养温度(A)、培养时间(B)、pH值(C)、培养方式(D)和培养基(E)对绿豆胚根长度的影响Fig.1 Effects of temperature (A), time (B), pH (C), aeration (D) and medium (E) on the length of mung bean radicles
由图1A可知,温度对F.sulphureum的产毒具有显著的影响,25 ℃培养滤液处理后的绿豆种子胚根长度分别是20 ℃和30 ℃滤液处理的79.63%、56.21%。由此表明,在20~30 ℃的培养温度范围内,25 ℃最有利于F.sulphureum体外产毒。由图1B可知,培养时间对F.sulphureumt体外产毒具有较大的影响,培养7~10 d时,毒素产量逐渐提高,第10天达到最大,绿豆种子胚根长度分别是7 d和17 d处理的67.75%和84.21%,但进一步延长培养时间毒素产量反而降低。由图1C可知,pH值对F.sulphureum体外产毒也具有明显的影响,pH 4.5的培养滤液处理后的绿豆种子胚根长度仅分别是pH 3.0、6.0、7.0和8.0处理的65.10%、52.13%、51.50%和52.24%。由图1D可知,培养方式对F.sulphureum产毒也有一定的影响,振荡培养比静止培养更有利于产毒,振荡培养滤液对绿豆种子胚根生长的抑制效果比静止培养高出近1倍。由图1E可知,在供试的3种培养基中,Richard培养基最有利于F.sulphureum体外产毒,该滤液处理后的绿豆种子胚根长度仅分别是PSC和Czapack培养滤液处理的40.64%和43.88%。
2.2 响应曲面法优化试验结果
2.2.1 回归模型的确定
利用Design-Expert 7.0软件对表1进行二次多项回归拟合试验和方差分析,反映培养温度、pH值和培养时间对绿豆种子胚根平均长度的影响,拟合所得多元二次回归方程如下:
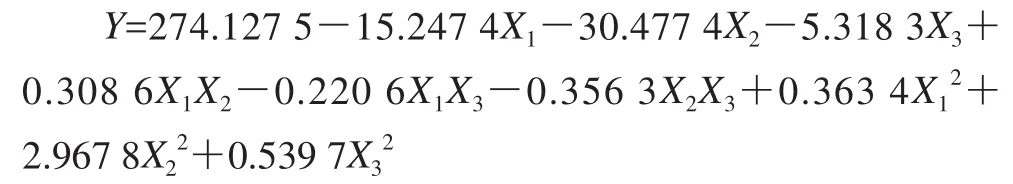
该方程复相关系数R2为0.973 2,响应变量R2为0.938 8,因此,可以充分描述独立变量对绿豆胚根平均长度的影响。该模型Prob>F值为0.000 1,模型极显著,模型拟合程度良好。
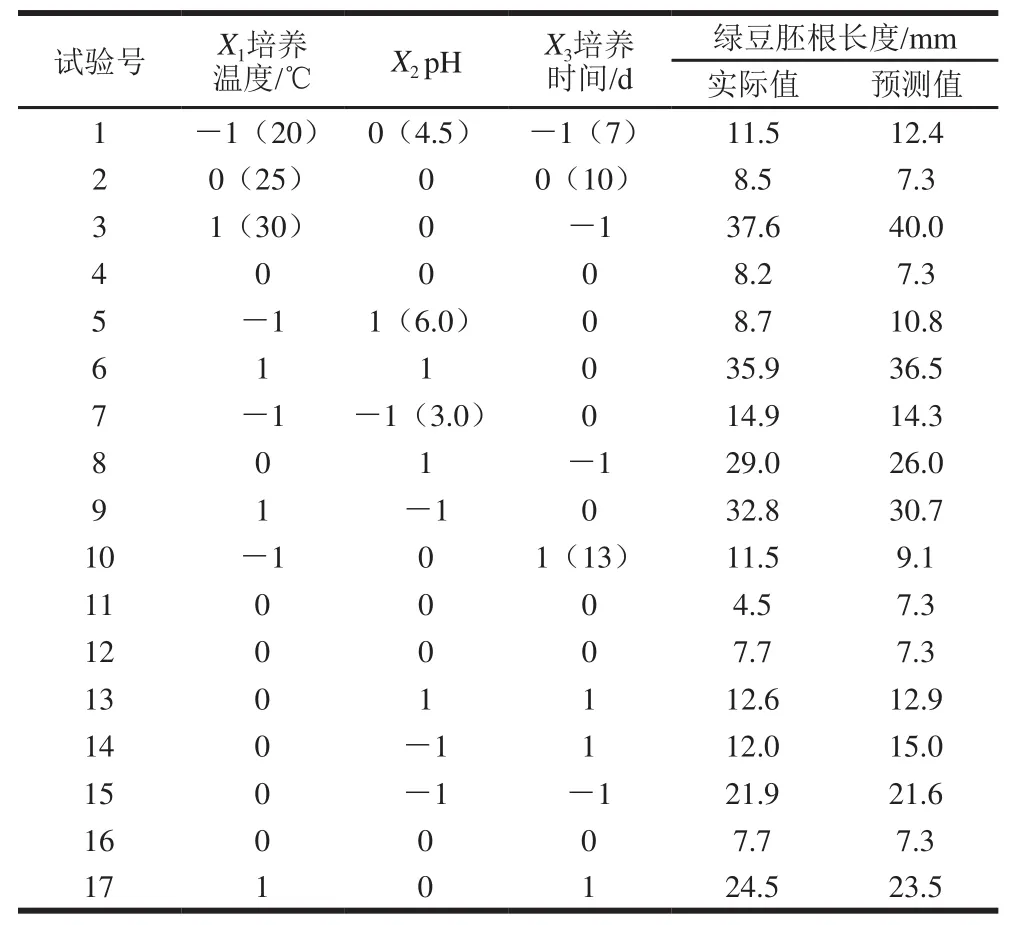
表1 Box-Behnken 响应面试验分析结果Table 1 Results of Box-Behnken response surface design
2.2.2 回归方程的方差分析
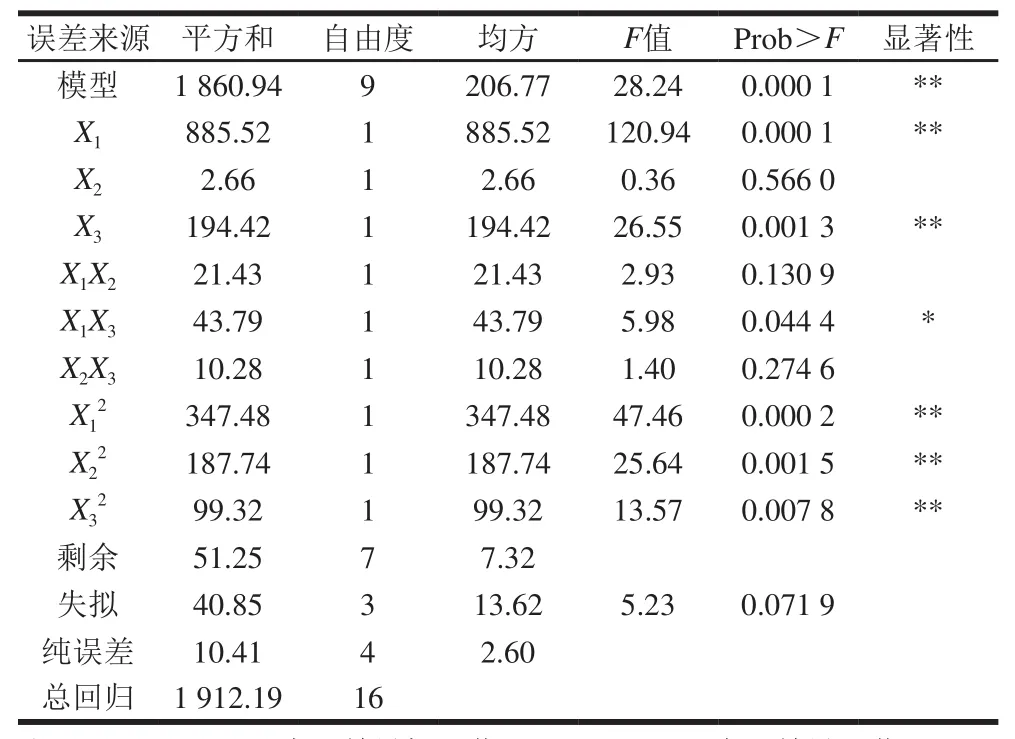
表2 回归方程各项的方差分析Table 2 Variance analysis for each item of the regression equation
由表2可知,绿豆胚根长度方程的一次项(除X2外)和二次项极其显著,说明各具体因素对响应值的影响不是简单的一次线性关系。交互项X1X3显著,因此说明X1和X3之间的交互作用很好,整个响应面基于各因素间的交互作用构成。另外,模型的变异系数为15.89%,证明回归方程拟合程度较好,说明试验具有很高的可信性和准确性。失拟项不显著,因此说明实验的误差很小。
2.2.3 响应面试验结果分析及验证实验
根据回归方程预测3个因素对绿豆种子胚根长度的响应曲面图直观地反映了各因素对响应值的影响(图2)。由响应曲面和等高线图以及回归方程分析可知,有利于F.sulphureum体外产毒的最佳条件为:温度22.2℃、pH 5.1、时间12 d,按上述优化条件培养的滤液对绿豆种子胚根的生长抑制良好。
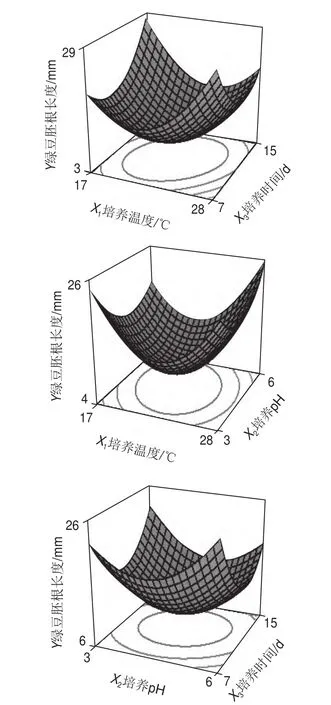
图2 培养温度(X1)、pH值(X2)和培养时间(X3)对绿豆胚根平均长度影响的响应曲面图Fig.2 Response surface plots for the effects of temperature (X1), pH (X2)and time (X3) on the average length of mung bean seed radicles
2.3 粗毒素致病性验证
由图3可知,粗毒素浓缩液对马铃薯块茎切片的发病率、病斑直径分别为37.50%和25.6 mm,而对照和无菌水处理者未见发病。由此表明,F.sulphureum产生的粗毒素对马铃薯块茎切片具有良好的致病力。

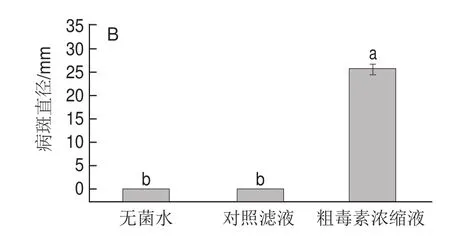
图3 粗毒素对马铃薯切片的致病性Fig.3 Pathogenicity of crude toxin on potato tuber slices
3 讨 论
本研究结果表明,温度、时间、pH值、培养方式和培养基对F.sulphureum的产毒均有不同程度的影响。前期本课题组已证明单端孢霉烯族毒素是F.sulphureum最主要的代谢毒素并具有较强的致病能力。25℃最有利于产毒是因为该类毒素的生物合成是典型的生化过程[22],温度对酶活性有显著影响,不同类型的酶均有其作用的最适温度,低于该温度酶的活性受到抑制,高于该温度则使酶变性失活,均不利于产毒[23]。培养10 d最有利于产毒是因为该类毒素的积累在10 d达到最大,随着培养时间的进一步延长毒素含量减少,可能与毒素在该条件下自我降解有关[14];此外,菌丝老化也会降低毒素的产量[15]。pH 4.5最有利于该菌生长繁殖,且产生的单端孢霉烯族毒素稳定性良好[7]。振荡培养有利于产毒是因为振荡有利于底物或代谢产物更好的在体系内转移和发挥作用,使培养基中的营养成分有效地得到利用。此外,通过振荡可以让更多的氧气溶解于培养液中,也更有利于菌体生长[24]。
种子的发芽抑制实验是检测病原物粗毒素的常用生物学方法之一[25],但单纯通过单因素筛选,很难客观地反映病原物产毒的最优条件,由于不同的因素之间具有交互作用[26]。因此,采用响应曲面分析试验可较全面地反映病原菌产毒与环境条件间的关系。本实验从培养基种类、pH值、温度、培养方式、培养时间等方面首次系统地研究了影响F.sulphureum体外产毒的因素,明确了该菌产生粗毒素的最优条件,但对体外培养产生的单端孢霉烯族毒素的分离、纯化和定性定量分析仍有待于进一步研究。
[1]叶琪明, 王拱辰.浙江马铃薯干腐病病原研究初报[J].植物病理学报, 1995, 25(2): 148-152.
[2]孙小娟, 李永才, 毕阳, 等.西北地区马铃薯贮藏期病害调查分析[J].中国马铃薯, 2009, 23(6): 364-365.
[3]何苏琴, 金秀琳, 魏周全, 等.甘肃省定西地区马铃薯块茎干腐病病原真菌的分离鉴定[J].云南农业大学学报, 2004, 19(5): 550-552.
[4]SUN Xiaojuan, BI Yang, LI Yongcai, el at.postharvest chitosan treatment induces resistance in potato againstFusarium sulphureum[J].Agricultural Sciences in China, 2008, 7(5): 615-621.
[5]杨志敏, 毕阳, 李永才, 等.马铃薯干腐病菌侵染过程中切片组织细胞壁降解酶的变化[J].中国农业科学, 2012, 45(1): 127-134.
[6]王春红, 张宝善, 孟泉科.常见真菌毒素对人体的危害及生物降解研究进展[J].陕西农业科学, 2009(4): 99-107.
[7]邹忠义, 贺稚非, 李洪军, 等.单端孢霉烯族毒素转化降解研究进展[J].食品科学, 2010, 31(19): 443-448.
[8]ROCHA O, ANSARI K, DOOHAN F M.Effects of trichothecene mycotoxins on eukaryotic cells: a review[J].Food Additives and Contaminants, 2005, 22: 369-378.
[9]LI Yansheng, WANG Zhanhui, BEIER R C, et al.T-2 toxin, a trichothecene mycotoxin: review of toxicity, metabolism, and analytical methods[J].Journal of Agricultural and Food Chemistry,2011, 59: 3441-3453.
[10]MORGAVI D P, RILEY R T.Fusariumand their toxins: mycology,occurrence, toxicity, control and economic impact[J].Animal Feed Science and Technology, 2007, 137: 199-200.
[11]彭双清, 罗毅, 杨进生, 等.镰刀菌毒素的系统提取分离分析及其毒理学的研究[J].医学研究通讯, 2000, 29(1): 25-27.
[12]付莹, 孟凡刚, 邓佳云, 等.2008年四川省阿坝州大骨节病相对活跃病区硒及T-2毒素水平调查[J].中国地方病学杂志, 2010, 29(3):325-329.
[13]薛山, 贺稚非, 李洪军.食物中 T-2 毒素检测及脱除研究进展[J].食品科学, 2013, 34(15): 349-354.
[14]李俊霞, 廖大国.四川玉米串珠镰刀菌产毒素条件的研究[J].粮食储藏, 2011, 40(2): 44-46.
[15]田雪亮, 陈锡岭, 王洪亮.串珠镰刀菌产生毒素条件研究[J].微生物学杂志, 2006, 26(6): 45-47.
[16]WALKER S L, LEATH S, HAGLER W M, Jr, et al.variation among isolates of fusarium graminearum associated withFusariumhead blight in north carolina[J].Plant Disease, 2001, 85(4): 404-410.
[17]LARKIN R P, FRAVEL D R.effects of varying environmental conditions on biological control of fusarium wilt of tomato by nonpathogenicFusariumspp.[J].Phytopathology, 2002, 92(11): 1160-1166.
[18]魏晋梅, 周围, 毕阳.粉红单端孢体外产毒条件的探讨及粗毒素活性测定[J].食品工业科技, 2007, 28(5): 110-112.
[19]柴兆祥, 李金花, 李敏权, 等.白兰瓜果腐病病原菌的分离鉴定及优势菌的毒性测定[J].应用与环境生物学报, 2004, 10(5): 671-674.
[20]El-HASSAN K I, El-SAMAN M G, et al.variation amongFusariumspp.the causal of potato tuber dry rot in their pathogenicity and mycotoxins production[J].Egyption Journal of Phytopathology, 2007, 35(2): 53-68.
[21]章红, 罗毅.镰刀菌毒素与某些疾病的关系[J].环境科学, 1994,15(1): 65-68.
[22]陈利锋.镰孢菌单端孢霉烯族毒素的生物合成(综述)[J].农业生物技术学报, 1998, 6(1): 85-89.
[23]许冰, 贾爱芳, 赵文献.温度对酶活性的影响[J].临床合理用药杂志,2010, 3(7): 28.
[24]马国斌, 林德佩, 王叶筠, 等.培养条件对西瓜枯萎病菌镰刀菌酸产生的影响[J].植物病理学报, 1996, 26(2): 187-191.
[25]杜晓昱.禾谷镰刀菌产毒分析及其毒素检测方法的研究[D].福州:福建农林大学, 2005.
[26]徐向宏, 何明珠.实验设计与Design-Expert、SPSS应用[M].北京:科学出版社, 2010.
