乳酸乳球菌乳脂亚种冷冻干燥保护剂优化及其贮藏稳定性
2014-02-13陈俊亮张慧芸霍贵成康怀彬
陈俊亮,张慧芸,田 芬,霍贵成,康怀彬
(1.河南科技大学食品与生物工程学院,河南 洛阳 471003;2.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;3.杭州娃哈哈集团有限公司研究院,浙江 杭州 310018)
乳酸乳球菌是乳球菌属最重要和最典型的1个种,包含乳酸乳球菌乳酸亚种和乳酸乳球菌乳脂亚种[1-2],被用作乳品发酵剂具有悠久的历史[3-4],主要用于生产干酪、黄油和酪乳[5]。在乳制品发酵工业中,乳酸乳球菌可将牛奶中的乳糖发酵形成乳酸,进而产生风味物质双乙酰和乙醛[6],并在干酪成熟过程中,其胞内肽酶和胞外蛋白酶可促进干酪中蛋白质水解,对成熟干酪风味物质形成具有重要作用[7]。
乳酸乳球菌菌粉制备通常采用真空冷冻干燥技术,但在冻干过程中会导致部分菌体细胞的损伤或死亡,以及某些蛋白酶分子钝化,从而造成发酵活力下降[8]。通过添加保护剂可有效地减少冷冻干燥对乳酸菌伤害,在直投式发酵剂制备过程中具有重要作用[9]。
本实验以内蒙古自治区发酵乳中的乳酸乳球菌乳脂亚种KLDS4.0326为研究目标[10],首先采用单因素试验和Plackett-Burman试验设计研究不同冻干保护剂对菌体细胞存活率的影响,筛选关键因素,再利用最陡爬坡试验和Box-Behnken响应面设计确定主要影响因素的最佳质量浓度,以提高真空冷冻干燥过程中菌体细胞的存活率,为开发新型干酪菌种保护剂提供理论依据。
1 材料与方法
1.1 材料与试剂
乳酸乳球菌乳脂亚种KLDS4.0326 乳品科学教育部重点实验室工业微生物菌种保藏中心(KLDSDICC)。
MRS培养基:胰蛋白胨10 g/L、蛋白胨5 g/L、牛肉膏5 g/L、酵母粉5 g/L、葡萄糖20 g/L、吐温-80 1mL/L、乙酸钠5 g/L、硫酸锰0.25 g/L、硫酸镁0.58 g/L、柠檬酸氢二铵2 g/L、磷酸氢二钾2 g/L,pH 6.8,121 ℃灭菌15 min。固体培养基添加15 g/L琼脂。
脱脂乳粉 德国 Nordmilch AG公司;海藻糖 上海华精生物高科技有限公司;VC 上海晶纯试剂有限公司;蔗糖、乳糖、谷氨酸钠、甘油 天津基准化学试剂有限公司;脱脂乳粉、海藻糖和谷氨酸钠为食品级;其他均为国产分析纯。
1.2 仪器与设备
KLF2000型发酵罐 瑞士比欧生物工程公司;Christ Alpha 1-4型冻干机 德国Marin Christ公司;ES-2030型冷冻干燥仪 日本Hitachi公司;GL-21M高速冷冻离心机 上海离心机械研究所;SPX-150B生化培养箱 上海智城分析仪器制造有限公司;HVE-50型高压灭菌器 日本Hirayama公司。
1.3 方法
1.3.1 菌种的培养与收集
乳酸乳球菌乳脂亚种KLDS4.0326经过活化后,以4%接种量接种到发酵罐中,恒温培养至稳定期前期,在4 ℃条件下4 500 r/min离心15 min,收集菌体。
1.3.2 真空冷冻干燥工艺
用等体积0.85 g/100 mL无菌生理盐水充分悬浮混合菌体,接着4 ℃离心收集菌体,然后等体积加入不同质量浓度的保护剂于安培瓶中;样品先放置在-80 ℃预冷冻24 h后,再放入真空冷冻干燥机中进行冻干,通过菌体细胞存活率反映保护剂的保护效果[11]。
1.3.3 活菌计数
采用梯度稀释平板活菌计数法[12],恒温培养48 h后计数。
1.3.4 菌体细胞存活率计算

1.3.5 保护剂筛选单因素试验
选取脱脂乳粉、谷氨酸钠、蔗糖、乳糖、海藻糖、甘油、硫酸锰和VC作为冻干保护剂,将上述8 种物质用蒸馏水分别配制成以下质量浓度的溶液:乳粉、蔗糖、乳糖、海藻糖分别为2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0 g/100 mL,甘油为1.0、2.0、3.0、4.0、5.0、6.0 g/100 mL,谷氨酸钠1.0、2.0、3.0、4.0、5.0 g/100 mL,VC为0.3、0.6、0.9、1.2、1.5、1.8 g/100 mL,硫酸锰为0.25、0.5、0.75、1.0、1.25、1.5 g/100 mL。脱脂乳粉115 ℃保温杀菌10 min[13];甘油、硫酸锰121 ℃保温杀菌15 min;VC、蔗糖、乳糖、海藻糖、谷氨酸钠溶液采用0.22 μm膜过滤除菌[14],冷却后置于4 ℃冰箱备用,以灭菌蒸馏水作为对照,测定冻干前后活菌数,计算菌体细胞存活率。
1.3.6 Plackett-Burman析因试验
利用Design-Expert软件进行Plackett-Burman析因设计,选择次数为N=12的实验,对8 种保护剂进行效应分析,每个因素分别取-1、+1两个水平,设定高水平为低水平的1.5 倍,响应值为冻干后的细胞存活率。
1.3.7 最陡爬坡试验
根据析因试验结果设计最陡爬坡试验路径[15],按照一定梯度增加脱脂乳粉的质量浓度,降低海藻糖和甘油的质量浓度,其他5个因素均固定为初始质量浓度,检测冻干后菌体细胞存活率的变化,以确定3个因素的最适质量浓度范围。
1.3.8 中心组合设计试验
以菌体存活率Y为响应值,采用Box-Behnken方法进行试验设计,根据实验结果建立二次响应面回归模型,以寻求最优实验数据。实验选用三因素三水平共17 个试验点的响应面法试验,其中析因部分试验次数为12 次,中心点重复试验次数为5 次,用以估计试验误差。
1.3.9 冻干菌粉的贮藏稳定性实验
使用最佳保护剂制备冻干菌粉,将其分别放置于4 ℃和25 ℃保存12 个月,每隔30 d测定菌体细胞存活率,平行3 次实验,检测菌粉的贮藏稳定性[16]。
1.4 数据统计分析
所有数据均为3个重复样品的平均值,采用SPSS13.0软件进行统计分析,判断彼此间的差异显著性。
2 结果与分析
2.1 不同冻干保护剂对乳酸乳球菌冻干存活率的影响
对不同质量浓度的8种保护剂及不加保护剂的对照组进行单因素试验,通过测定乳酸乳球菌乳脂亚种KLDS4.0326在冻干前后活菌数,比较不同保护剂对菌体的保护效果,结果见图1。

表1 Plackett-Burman试验设计及结果Table 1 Plackett-Burman experimental design and corresponding response of cell survival rate
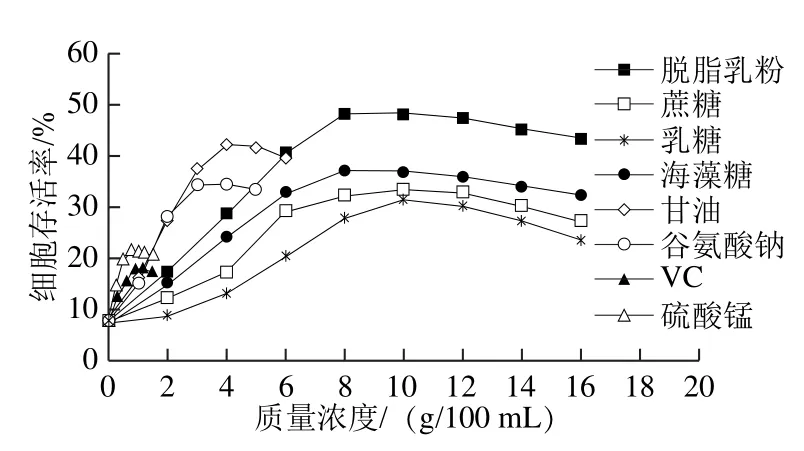
图1 不同冻干保护剂对乳酸乳球菌乳脂亚种KLDS4.0326冻干存活率的影响Fig.1 Effect of different cryoprotectants on the survival rate of Lactococcus lactis subsp.cremoris KLDS 4.0326
由图1可知,未添加保护剂的乳酸乳球菌乳脂亚种KLDS4.0326冻干存活率为7.53%,当添加8 种单一保护剂后,均对其产生保护效果。由图中曲线变化趋势可知,随着保护剂添加量的增加,菌体的存活率不断提高。当单一保护剂脱脂乳粉、蔗糖、乳糖、海藻糖、甘油、谷氨酸钠、VC、硫酸锰的质量浓度分别为8.0、10.0、10.0、8.0、4.0、3.0、0.9、0.7 g/100 mL时,菌体存活率分别达到最高值:48.26%、33.43%、31.25%、36.92%、42.02%、34.36%、18.12%和21.52%,此后继续增加保护剂质量浓度,保护效果反而呈现降低趋势,这是由于高质量浓度的保护剂会加速细胞内的蛋白质聚合,形成较强玻璃化结构,反而不利于菌体细胞的保存,并且复水效果不理想,因此,当保护剂质量浓度超过它们的最佳质量浓度后,菌体存活率随着各种保护剂添加量的增加反而下降[17]。
2.2 Plackett-Burman试验筛选主要影响因素
Plackett-Burman实验结果见表1。利用Design-Expert软件对表1中的细胞存活率数据进行回归分析,得到各影响因子的偏回归系数及其显著性(表2)。
由表1可知,脱脂乳粉、谷氨酸钠、蔗糖、硫酸锰对细胞存活率的影响为正效应,而其他因素产生负效应。脱脂乳粉和海藻糖对菌体存活率的影响高度显著(P<0.01),甘油对菌体存活率的影响显著(P<0.05),其他因素差异不显著,因此选取脱脂乳粉、海藻糖、甘油3个因素作为研究对象。

表2 Plackett-Burman试验设计各因素的效应评价Table 2 Estimated effects of Plackett-Burman design
2.3 最陡爬坡试验结果和中心试验点的确定
根据Plackett-Burman实验结果设计最陡爬坡试验路径,试验结果如表3所示,4号试验中脱脂乳粉、海藻糖、甘油的质量浓度分别为10.5、7.5、3.0 g/100 mL时,菌体细胞存活率达到最大值84.05%,然后随着质量浓度的变化细胞存活率逐渐降低。结果表明,4号试验中3个因素的质量浓度接近最大响应区域,因此将其作为中心组合试验的中心点。

表3 最陡爬坡试验设计及结果Table 3 Steepest ascent experimental design and corresponding results
2.4 响应面试验优化最佳保护剂配比
2.4.1 Box-Behnken试验结果及回归方程方差分析
Box-Behnken试验结果见表4,对实验数据进行响应面分析,回归方程的方差分析结果如表5所示。

表4 Box-Behnken优化设计及结果Table 4 Box-Behnken design and corresponding results
将所有数据进行多元回归拟合,获得菌体细胞存活率对编码自变量脱脂乳粉、海藻糖和甘油的二次多项回归方程为:

从模型的方差分析表可知,本实验所选用的二次多项模型具有高度显著性(PModel<0.000 1),失拟项不显著(PLotoffit=0.116 1),其校正决定系数为R2Adj=0.984 6,说明有98.46%的菌种细胞存活率变化能由此模型进行解释;相关系数为R2=0.993 2,说明模型对实际情况拟合较好,可用此模型对细胞存活率进行分析和预测。

表5 回归方程方差分析Table 5 Analysis of variance for the regression equation
2.4.2 响应面图及等高线图分析
利用Design-Expert软件设计得到的响应面图和等高线图,可直观地反映各因素对响应值的影响,以及在反应过程中的交互作用影响。在等高线图中,椭圆型或者马鞍型的等高线表示因素之间交互作用显著,而圆型的等高线表示因素之间交互作用较弱。由图2可知,脱脂乳粉与海藻糖、海藻糖与甘油对菌体存活率影响的交互作用高度显著,而脱脂乳粉与甘油的交互作用不显著。


图2 各因素及交互作用对菌体存活率影响的响应面和等高线图Fig.2 Response surface and contour plot showing the effects of different factors and their interaction on cell survival rate
2.4.3 验证实验结果
通过Design-Expert软件进行数据分析,以获得最大菌体存活率为目标,计算得到的最佳配方质量浓度为:脱脂乳粉10.77 g/100 mL、海藻糖7.81 g/100 mL、甘油3.31 g/100 mL,在此基础上得到菌体细胞存活率理论预测值为89.12%。使用最佳保护剂配比进行9 组验证实验,菌体细胞存活率达到(87.43±1.62)%,实测值与预测值相近,说明响应面法建立的数学模型较准确可靠。
2.5 菌粉的保存稳定性实验结果

图3 KLDS4.0326冻干菌粉在4℃和25℃条件下保存期间菌体细胞存活率的变化Fig.3 Changes in cell survival rate of KLDS 4.0326 with storage time at 4 and 25 ℃
制备的乳酸乳球菌乳脂亚种KLDS4.0326菌粉分别在4 ℃和25 ℃条件下保存12 个月,由图3可知,随着保存时间的增加,活菌数均呈现下降趋势,但是25 ℃贮藏时存活率下降更明显,在第12个月末检测两种保藏温度下的活菌数分别为1.04×109CFU/g和2.19×108CFU/g,均保持较高的活菌数;两种保藏温度下菌体细胞的存活率分别为40.63%和8.67%,结果表明4 ℃贮藏条件下的保存效果优于25 ℃。
3 讨 论
本实验中脱脂乳粉、海藻糖、甘油、谷氨酸钠对乳酸乳球菌乳脂亚种KLDS4.0326冻干保护效果显著,这是因为在真空冷冻干燥过程中,乳清蛋白能在菌体外形成蛋白膜,对细胞加以保护,并可以固定冻干的酶类,防止由于细胞壁蛋白质损坏而引起的胞内物质泄漏,而且乳中其他成分(如乳糖等)同样可以提高菌体的冻干存活率[18]。
目前主要有两种假说解释海藻糖稳定生物分子的机理:一种是“水替代”假说,生物体大分子由一层水膜所包围,这层水膜对维持生物大分子的功能及结构起到至关重要的作用,当生物大分子失去维持其结构和功能特性的水膜时,海藻糖可在生物大分子失水部位以氢键的形式连接,形成一层保护膜以代替失去的结构水膜;另一种是“玻璃态”假说,该假说认为通过海藻糖玻璃化转变的趋势,导致无定形连续相的形成,在这种结构中分子运动和分子变性反应非常微弱[19-20]。
甘油属于多元醇类,是一类应用较为普遍的冻干保护剂。由于醇和糖类相似都具有羟基官能团,均能产生“优先水化作用”以及改变体系的玻璃态转变温度等,因此在发挥保护效果方面与糖类具有一定共性。此外,甘油具有良好渗透能力,可进入细胞内部,与胞内大分子形成氢键,以取代干燥脱除的水分,从而维持蛋白质、碳水化合物及脂肪等大分子活性物质的原有结构。此外,甘油还可起到降低细胞脱水皱缩和缓解复水肿胀的效果[21]。Savini等[22]利用甘油、甘露醇、山梨糖醇及其他添加剂作为冻干保护剂对鼠李糖乳杆菌和乳酸杆菌的冷冻干燥过程进行研究,得出多元醇类作为保护剂提高菌体细胞冻干存活率效果良好,并且甘油的稳定效果最显著。
单一保护剂实验结果表明,VC和硫酸锰也能够增强KLDS4.0326菌体细胞存活率,这是由于VC不仅是碳水化合物,其羟基与磷脂的磷酸基团连接形成氢键,从而阻止和限制细胞膜因失水而融合,而且它是一种渗透性物质,可以氢键形式或其他方式与膜上的磷脂极性端结合,从而取代水分保护细胞结构的完整性[23]。而硫酸锰在冻干保护剂中作为缓冲盐,能够渗透到细胞内部从而调节菌体内部理化平衡,同时还能与保护剂中的其他成分产生联合作用,从而更好的对冻干菌体起到保护作用[24]。Desmons[25]在乳酸菌冻干机理研究中发现,在脱脂乳和甘油为基础保护剂的配方中添加量为0.1%硫酸锰后,能够使嗜酸乳杆菌冻干存活率由83%提高到92%。因此硫酸锰在冻干过程中对乳酸菌起到了重要的保护作用。
在真空冷冻干燥过程中,单一的保护剂不能满足生产工艺要求,一般使用复合冻干保护剂。复合保护剂中各成分在冷冻干燥中均发挥着各自的作用,同时相互间又具有协同作用,只有各组分在比例和浓度达到协调时,冻干保护剂才具备最佳效果[26]。
[1]DHAISNE A, GUELLERIN M, LAROUTE V, et al.Genotypic and phenotypic analysis of dairyLactococcus lactisbiodiversity in milk:volatile organic compounds as discriminating markers[J].Applied and Environmental Microbiology, 2013, 79(15): 4643-4652.
[2]SCHLEIFER K, KRAUS J, DVORAK C, et al.Transfer ofStreptococcus lactisand relatedStreptococcito the genusLactococcusgen.nov[J].Systematic and Applied Microbiology, 1985, 6(2): 183-195.
[3]DAVIDSON B E, KORDIAS N, DOBOS M, et al.Genomic organization of lactic acid bacteria[J].Antonie van Leeuwenhoek,1996, 70(2/4): 161-183.
[4]SALAMA M S, MUSAFIJA-JEKNIC T, SANDINE W E, et al.An ecological study of lactic acid bacteria: isolation of new strains ofLactococcusincludingLactococcus lactissubspeciescremoris[J].Journal of Dairy Science, 1995, 78(5): 1004-1017.
[5]HENRIKSEN C M, NILSSON D, HANSEN S, et al.Industrial applications of genetically modified microorganisms: gene technology at Chr.Hansen A/S[J].International Dairy Journal, 1999, 9(1): 17-23.
[6]VLIEG J, RADEMAKER J L W, BACHMANN H, et al.Natural diversity and adaptive responses ofLactococcus lactis[J].Current Opinion in Biotechnology, 2006, 17(2): 183-190.
[7]LAW J, FITZGERALD G, UNIACKE-LOWE T, et al.The contribution of lactococcal starter proteinases to proteolysis in Cheddar cheese[J].Journal of Dairy Science, 1993, 76(9): 2455-2467.
[8]CARVALHO A S, SILVA J, HO P, et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal, 2004, 14(10): 835-847.
[9]JAGANNATH A, RAJU P S, BAWA A S.Comparative evaluation of bacterial cellulose (nata) as a cryoprotectant and carrier support during the freeze drying process of probiotic lactic acid bacteria[J].LWTFood Science and Technology, 2010, 43(8): 1197-1203.
[10]CHEN Junliang, WANG Deguo, YE Wei, et al.Phenotypic, genotypic and technological characterization ofLactococcus lactisin traditional fermented dairy products from China[J].Milchwissenschaft, 2011,66(1): 72-75.
[11]SAARELA M, VIRKAJÄRVI I, ALAKOMI H L, et al.Stability and functionality of freeze-dried probioticBifidobacteriumcells during storage in juice and milk[J].International Dairy Journal, 2006, 16(12): 1477-1482.
[12]食品安全国家标准.GB 4789.2—2010食品微生物学检验菌落总数测定[S].北京: 中国标准出版社, 2010.
[13]张娟, 刘茜, 吴重德, 等.应用新型复合保护剂制备高活性直投式干酪乳杆菌发酵剂[J].食品与生物技术学报, 2012, 31(11): 1128-1135.
[14]韩德权, 杨丽娟, 孙庆申, 等.响应面法优化植物乳杆菌冻干保护剂[J].食品科学, 2010, 31(5): 219-224.
[15]MONTGOMERY D C.Design and analysis of experiments[M].New York: John Wiley & Sons, Inc, 2005.
[16]田芬, 陈俊亮, 霍贵成.益生菌冻干保护剂优化及菌粉保存稳定性研究[J].食品科技, 2012, 37(2): 15-19.
[17]熊涛, 黄锦卿, 宋苏华, 等.植物乳杆菌真空冷冻干燥保护剂配方优化[J].南昌大学学报: 理科版, 2010, 34(6): 561-565.
[18]HAN B, BISCHOF J C.Direct cell injury associated with eutectic crystallization during freezing[J].Cryobiology, 2004, 48(1): 8-21.
[19]CROWE J H, CROWE L M, CHAPMAN D.Preservation of membranes in anhydrobiotic organisms: the role of trehalose[J].Science, 1984, 223: 701-703.
[20]VINDEROLA C, MOCCHIUTTI P, REINHEIMER J.Interactions among lactic acid starter and probiotic bacteria used for fermented dairy products[J].Journal of Dairy Science, 2002, 85(4): 721-729.
[21]徐致远, 刘荣, 郭本恒, 等.保护剂在乳酸菌冻干过程中的应用[M].乳业科学与技术, 2006(4): 155-157.
[22]SAVINI M, CECCHINI C, VERDENELLI M C, et al.Pilot-scale production and viability analysis of freeze-dried probiotic bacteria using different protective agents[J].Nutrients, 2010, 2(3): 330-339.
[23]严佩峰, 豆成林, 李建芳.保加利亚乳杆菌冻干保护剂的研究[J].饮料工业, 2012, 15(3): 23-25.
[24]CONRAD P B, MILLER D P, CIELENSKI P R, et al.Stabilization and preservation ofLactobacilius acidophilusin saccharide matrice[J].Cryobiology, 2000, 41: 17-24.
[25]DESMONS S.Freeze-drying of lactic acid bacteria:Lactobacillus acidophilus[J].Medical Faculty Land Bouww, University of Gent,1997, 62(4b): 1713-1716.
[26]张刚.乳酸细菌: 基础, 技术和应用[M].北京: 化学工业出版社, 2007.
