草鱼皮胶原的体外自组装动力学研究
2014-01-18邓明霞汪海波
赵 燕,鲁 亮,杨 玲,邓明霞,杨 欢,汪海波*
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
草鱼皮胶原的体外自组装动力学研究
赵 燕,鲁 亮,杨 玲,邓明霞,杨 欢,汪海波*
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
体外自组装是天然胶原的重要分子行为特征之一,并对胶原基产品性能产生显著影响。以草鱼皮酶溶性胶原蛋白为研究对象,重点开展胶原体外自组装动力学行为、影响因素、组装纤维的微观结构及其热稳定性能研究。浊度实验和自组装程度分析的结果表明,草鱼皮胶原蛋白具备体外自组装能力,其自组装进程受胶原质量浓度、pH值、离子强度、温度等因素的影响。在pH 7~8、胶原质量浓度3~5 mg/mL、体系温度25~30 ℃以及NaCl浓度0~200 mmol/L 条件下胶原自组装进程较快、自组装程度较高;组装动力学分析的结果表明,在较高的离子强度(NaCl浓度300 mmol/L)和较低的组装温度(20 ℃)时,胶原组装进程表现为:成核、组装和平衡3 个阶段,而在较高组装温度(25~30 ℃)和较低离子强度时(NaCl浓度0~200 mmol/L),胶原组装进程表现为:快速组装段、低速组装段和平衡段;胶原纤维形态学观察结果表明,草鱼皮胶原组装纤维具有典型的D周期特征但D周期长度值(64.6 nm)小于哺乳动物胶原纤维(约67 nm);示差扫描量热法(differential scanning calorimetry,DSC)分析结果表明,经纤维重组后,草鱼皮胶原蛋白的热稳定性得到明显提升。
淡水鱼;胶原蛋白;自组装;动力学
胶原蛋白(collagen)是多细胞生物中含量最丰富、分布最广泛的蛋白质种类之一。在生物体内,胶原蛋白与聚多糖等成分一起形成精密有序的细胞间网络结构——细胞外基质(extracellular matrix,ECM),对机体细胞的发育、迁移以及机体组织的形成和功能发挥等均产生重要作用。目前已知的胶原蛋白种类超过27 种,分别被命名为Ⅰ型、Ⅱ型、Ⅲ型等[1]。经过数十年的研究历程,现在已基本明确了胶原的体内生物合成路径、分子结构等基础性问题。与此同时,天然胶原(特别是Ⅰ型胶原)在食品添加剂、生物医学材料、医学组织工程等领域也得到了越来越广泛的应用。与传统来源的哺乳动物胶原相比,鱼源胶原在来源的广泛性、生物安全性和产品成本等方面均具有更大的优势。中国是世界渔业大国,鱼深加工过程中产生的大量废弃物中均富含胶原蛋白,这为鱼源胶原的开发与利用提供了充足的资源供给。因此,围绕鱼源胶原蛋白的性能研究及其在生物医学材料领域中的潜在应用备受瞩目[2-4]。但是,与哺乳动物胶原相比,鱼胶原在热稳定性、耐酶降解性、生物力学性能等方面亦存在明显不足。如何利用现代技术手段改善胶原性能以满足应用需要已成为鱼源胶原在生物医学材料领域中应用的关键问题。
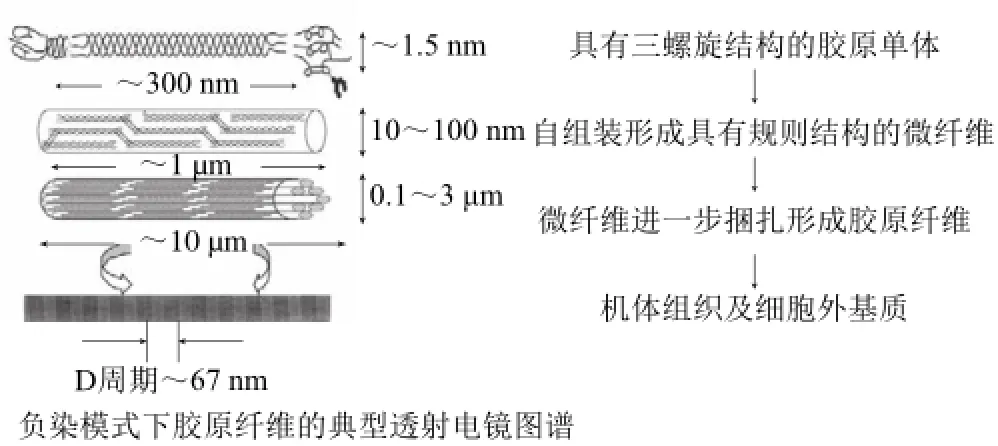
图1 天然胶原分子自组装示意图[[55]]Fig.1 Diagram of natural collagen self-assembly[[55]]
自组装(self-assemble)是天然胶原的重要分子行为特征,即具有完整三螺旋结构的胶原分子单体可以通过分子间的有序排列,形成具有交错条纹结构(D周期)的胶原纤维(图1)[5]。研究发现,生物体内以自组装模式形成的胶原纤维在热稳定性、耐酶降解性和生物力学性能等方面均显著优于胶原单体分子的体外性能表现[6-7]。该结果提示,自组装行为对胶原生物学性能的改善有促进作用。正是基于这一认识,天然胶原生物体内、体外自组装成纤维动力学过程、纤维构造、分子学机制以及自组装行为在生物材料构建中的应用等研究得以深入开展。其中,组装动力学是指导和优化组装条件的理论基础。围绕哺乳动物胶原的组装动力学研究已深入开展,并建立了相对成熟的研究方法和理论。但是,针对鱼源胶原体外自组装的相关研究尚鲜有报道。在基于鱼源胶原生物材料的开发中,大部分学者直接应用哺乳动物胶原组装动力学的相关研究成果和结论,而忽视了鱼胶原与哺乳动物胶原在氨基酸组成、分子行为等方面存在的较大差异[8-9]。因此针对鱼源胶原开展组装动力学相关研究显得尤为迫切和必要。有鉴于此,本研究以草鱼皮酶溶性胶原为对象,重点开展草鱼皮胶原蛋白在不同条件下的体外自组装动力学分析,为自组装技术在鱼源胶原性能改进中的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
[10]方法,以含2%胃蛋白酶的0.5 mol/L乙酸为溶剂从新鲜草鱼鱼皮中提取酶溶性胶原蛋白,提取液经盐析、透析纯化后冷冻干燥得到胶原蛋白样品。该胶原蛋白经丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)分析、红外光谱分析和差示量热扫描(differential scanning calorimetry,DSC)分析,证实为具有完整三螺旋分子结构的Ⅰ型胶原。NaH2PO4·2H2O、Na2HPO4·12H2O、NaCl、盐酸、醋酸、戊二醛(体积分数25%)、醋酸异戊酯、磷钨酸等均为国产分析纯;羟基脯氨酸标准品 美国Sigma公司。
1.2 仪器与设备
WFZUV-2000紫外光分光光度计 尤尼柯(中国)上海仪器有限公司;DSC-Q2000差示扫描量热仪 美国TA公司;S-3000N扫描电镜 日本Hitachi公司;Tecnai G2透射电镜 荷兰FEI公司。
1.3 方法
1.3.1 胶原体外自组装动力学实验[11]
草鱼皮胶原蛋白用0.5 mol/L的醋酸充分溶解后置于透析袋中,4 ℃条件下透析,透析外液为设定pH值和离子强度的磷酸盐缓冲溶液(PBS)。透析至平衡后,取出胶原溶液,低温离心脱气(20 000 r/min,10 min)。取3 mL离心后的胶原溶液置于比色池中,采用带温控附件的WFZUV-2000紫外光分光光度计于设定温度条件下实时测定胶原溶液310 nm处的动态吸光度,绘制浊度曲线。胶原组装的基础条件参数为:胶原质量浓度1 mg/mL,组装温度30 ℃,体系NaCl含量为150 mmol/L,体系pH 7.3。在自组装条件对胶原组装动力学行为的影响研究中,除考察因素外,其他条件均采用基础条件参数。
1.3.2 自组装程度测定[12]
醋酸溶解的胶原蛋白按上述方法透析、离心脱气处理后,置于恒温水浴槽中,分别在设定温度条件下启动自组装。组装完毕后离心分离组装胶原纤维(20 000 r/min离心10 min)。以L-羟脯氨酸为对照标准品,以二甲氨基苯甲醛为显色剂采用分光光度法定量测定离心上清液中羟基脯氨酸含量,测定标准曲线为:y=0.192 93x+0.015 61,R2=0.998 89,式中:y为羟脯氨酸含量/(mg/mL),x为测定吸光度。按式(1)计算胶原自组装程度[13]。

式中:m1为组装前胶原样品中的羟脯氨酸总量/mg;m2是组装后样品上清液中的羟脯氨酸总量/mg。
1.3.3 胶原纤维形态学观察
用0.5 mol/L醋酸配制2 mg/mL的胶原蛋白溶液,4 ℃条件下透析,透析外液为含150 mmoL NaCl的磷酸盐缓冲溶液(pH 7.2)。透析至平衡后,取出胶原溶液,低温离心脱气(20 000 r/min,10 min),然后将样品缓慢转移至离心管中,于30 ℃下水浴自组装24 h。
透射电镜样品的处理:组装后的胶原溶液进行低温离心处理(20 000 r/min,10 min),弃去上清液后用相同的PBS缓冲液清洗胶原纤维沉淀并再次离心(重复3次),最后向胶原纤维沉淀中添加3 倍体积的PBS缓冲溶液,振荡均匀,得到胶原纤维的分散悬浮液。将该悬浮液铺设在200 目网孔的铜网上,用1%的磷钨酸染色(pH 7.4,1 min),再用去离子水冲洗,风干,于200 kV下进行透射电镜观测。以透析后但未进行自组装处理的胶原溶液作为对照。
扫描电镜样品的处理:组装后的胶原溶液进行低温离心处理(20 000 r/min,10 min),弃去上清液后用相同的PBS缓冲液清洗胶原纤维沉淀并再次离心(重复3 次),得到的胶原纤维沉淀用含有2%戊二醛的PBS溶液固定10 h(4 ℃),固定样品用PBS洗涤后进行梯度脱水(30%、50%、70%、90%、100%的乙醇),随后用乙醇-醋酸异戊酯混合溶液(体积比1∶1)浸泡两次,每次5~10 min,最后用纯的醋酸异戊酯浸泡两次,每次5~10 min。扫描电镜(scanning electron microscope,SEM)观察前对处理好的胶原组装纤维进行二氧化碳临界点干燥、喷金处理。
D周期和纤维粒径的测量与统计:利用Nano measurer软件,测量透射电子显微镜(transmission electron microscope,TEM)和SEM图片中胶原纤维的D周期值和纤维粒径。从5 张TEM图片中随机选取30 根胶原纤维,测定纤维D周期(每根胶原纤维随机测定5 个D周期);从5 张SEM图中随机选取150 根纤维,测定纤维粒径。所有D周期和纤维粒径测定均取平均值并计算标准偏差。
1.3.4 热变性温度测定[14]
按1.2.3节方法进行胶原蛋白的溶解、自组装处理、离心分离,离心得到的胶原纤维沉淀进行冷冻干燥。以原始胶原样品作为测定对照。DSC测定方法:准确称取10 mg胶原蛋白冻干样品,用0.4 mL的蒸馏水充分溶胀24 h(4 ℃)然后用差式扫描量热仪测定样品变性温度。仪器采用金属铟进行校正(铟的熔融焓为28.451 J/g,熔点为165.4 ℃),扫描温度范围为20~60 ℃;升温速率2 ℃/min,样品室氮气流量为20 mL/min。
1.4 数据处理
采用Origin 8.0自带统计学软件进行数据分析,计算平均值和相对标准偏差,采用单因素方差分析进行多组间比较,P<0.05表示有统计学意义差异。
2 结果与分析
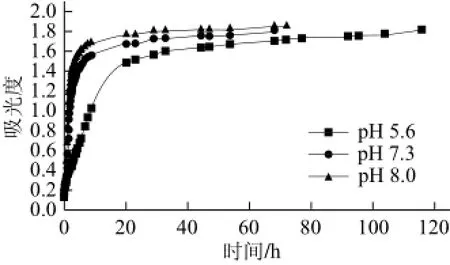
图2 不同体系pH值条件下胶原的浊度曲线Fig.2 Turbidity curve of collagen at different pH
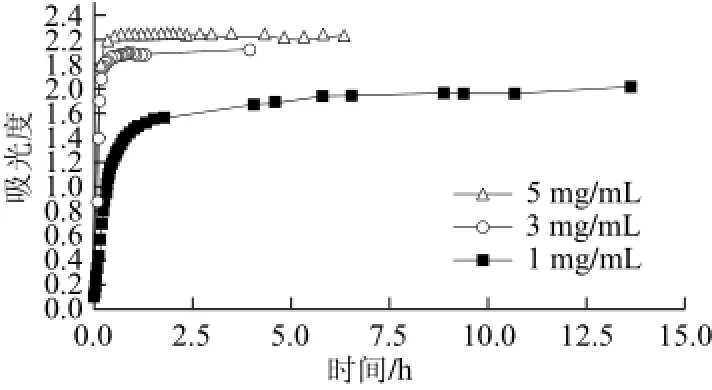
图3 不同质量浓度胶原的体外自组装浊度曲线Fig.3 Turbidity curve of collagen at different concentrations
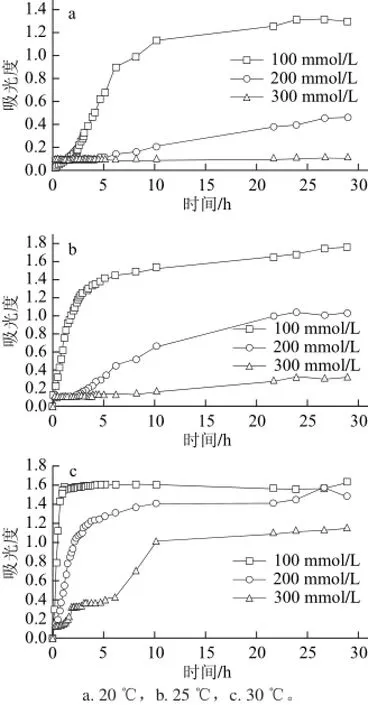
图4 不同温度和NaCl含量条件下的胶原组装浊度曲线Fig.4 Turbidity curve of collagen at different temperatures and NaCl concentrations
2.1 组装条件对草鱼皮胶原蛋白体外自组装行为的影响浊度实验是研究胶原体外自组装动力学的最常见手段。在胶原的自组装进程中,伴随胶原单分子有序重组为胶原微纤维和胶原纤维,胶原体系的溶液浊度也随之增加,因此可以通过实时测定组装体系浊度值的变化来观察胶原溶液的自组装进程。图2~4分别是不同组装条件下草鱼皮胶原蛋白的体外自组装浊度曲线。由图可知,随着组装时间的延长,组装体系浊度值也随之增加并在最后达到平衡。该结果证实,在一定条件下草鱼皮胶原蛋白具备体外自组装能力。从浊度曲线中可以看到,体系pH值、组装温度、胶原蛋白初始浓度以及体系中NaCl浓度等因素均对草鱼皮胶原蛋白的体外自组装行为产生影响。随着体系pH值和胶原质量浓度的提高,草鱼皮胶原体外自组装进程也随之加快(图2、3),说明提高体系pH值和胶原质量浓度对胶原蛋白的体外自组装行为有促进作用。草鱼皮胶原蛋白的体外自组装行为也受温度和体系离子含量的强烈影响(实验中通过控制缓冲溶液中NaCl浓度的方法调节体系离子强度)。随着组装温度的提高和体系离子强度的降低,草鱼皮胶原蛋白的体外自组装进程明显加快(图4),而在NaCl浓度为300 mmol/L、体系温度20 ℃的组装条件下,草鱼皮胶原溶液310 nm处吸光度恒定不变,说明在该条件下胶原的体外自组装行为完全受到抑制(图4a)。
2.2 自组装程度分析

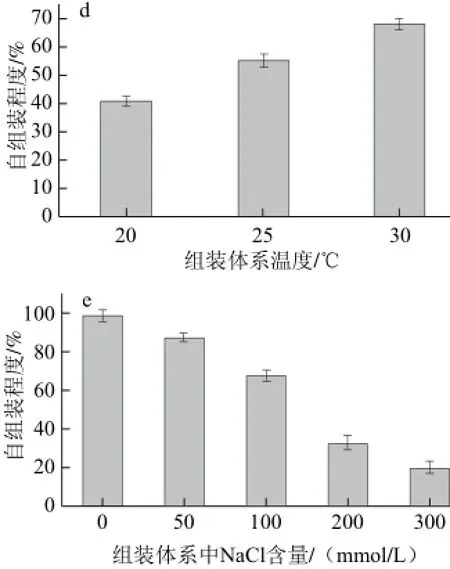
图5 各组装条件对草鱼皮胶原蛋白体外组装程度的影响Fig.5 Effect of self-assembly conditions on the degree of collagen self-assembly
由图5可知,随着组装时间的延长,胶原样品的自组装程度逐渐增加(图5a),组装12 h和24 h时胶原样品的自组装程度明显高于组装3 h和6 h(P<0.05);组装体系pH值、胶原质量浓度、组装温度以及体系离子强度对草鱼皮胶原体外自组装程度的影响趋势与浊度曲线的实验结果一致(图5b~5e),即随着胶原质量浓度、体系温度和体系pH值的增加,胶原自组装程度明显增加,而提高体系离子强度则显著降低胶原的自组装程度(P<0.05)。
2.3 自组装动力学分析
胶原蛋白的体外自组装行为可以用一级速率方程描述[15],即:

式中:Ae为组装平衡阶段时体系310 nm波长处的吸光度;At是t时间点时体系310 nm波长处的吸光度;k为组装速率常数。在组装初始阶段,t=0,At= A0,因此c =-ln(Ae-A0),其中A0为组装初始时体系310 nm波长处的吸光度,由此式(2)可转换为:
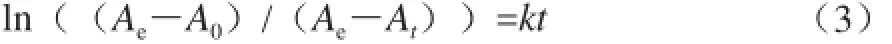
将ln((Ae-A0)/(Ae-At))对组装时间t作图,采用最小二乘法拟合直线后即可通过直线斜率得到组装速率常数k。
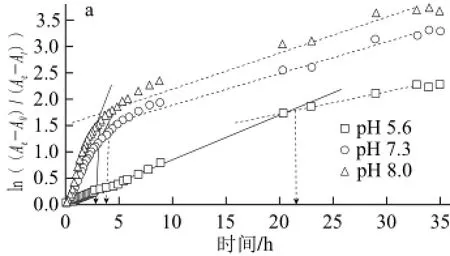
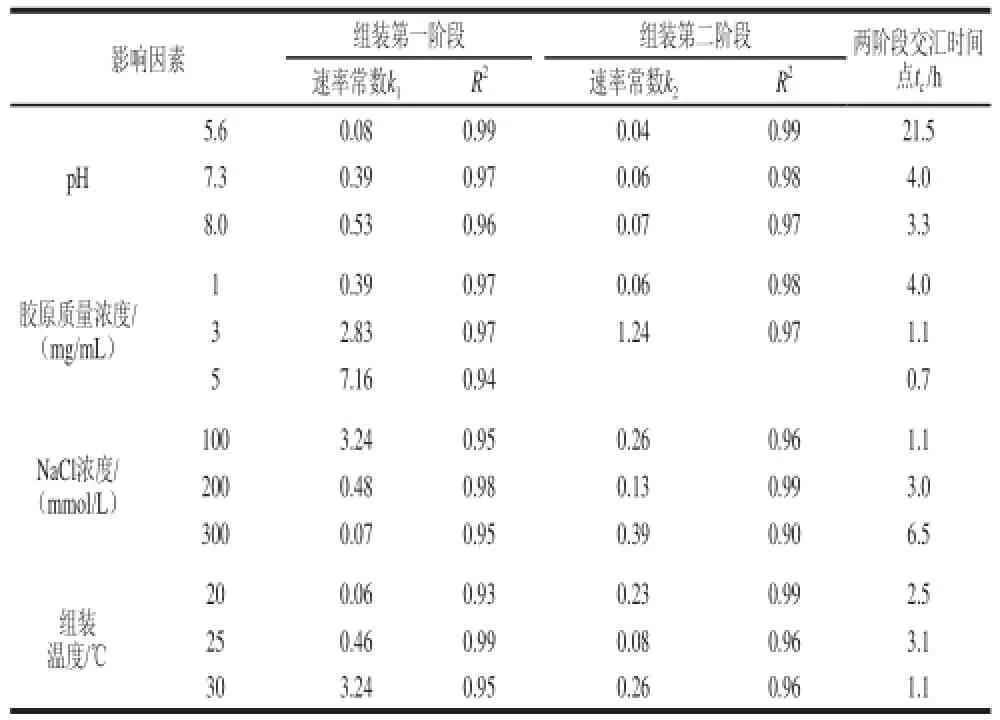
表1 草鱼皮胶原蛋白体外自组装动力学参数Table1 Assembling kinetic parameters of grass carp skin collagen
由图6和表1可知,在不同的组装时间段,草鱼皮胶原蛋白展现出不同的组装速度特征。根据胶原组装速度的不同可以将胶原自组装过程划分为3 个阶段。其中,组装第三阶段均为组装平衡阶段,表现为组装速率常数k为0或接近0;第一和第二组装阶段为组装段,但表现为不同的组装速度(k1和k2)。根据两个组装段拟合直线的交汇点可以得到两阶段的转变时间点tc。当胶原质量浓度为1 mg/mL时,不同pH值条件下草鱼皮胶原蛋白的自组装行为均表现为第一组装段组装速度大于第二组装段组装速度(k1>k2),且随着体系pH值的增加,两个组装阶段转变时间点也随之提前(表1);胶原初始浓度的改变对胶原自组装速度变化有显著影响。随着胶原质量浓度的增加,组装第一阶段速率常数迅速增加(k1>k2)且两阶段转变时间点快速下降。当胶原质量浓度达到5 mg/mL时,整个胶原组装进程仅表现为两个速率阶段(组装段、平衡段)(图6b);草鱼皮胶原蛋白在不同的体系离子强度和组装温度条件下展现出不同的自组装速度行为。在较低的离子强度(NaCl浓度100、200 mmol/L)和较高的组装温度(25 ℃和30 ℃)时,胶原组装速率行为表现为第一组装段组装速度大于第二组装段组装速度(k1>k2),但是在较高的离子强度(NaCl浓度300 mmol/L)和较低的组装温度(20 ℃)时,胶原组装速率行为则完全相反(k1<k2)。
2.4 组装胶原纤维的形态学观察

图7 自组装胶原纤维的形态学观察Fig.7 Fiber morphology images of self-assembled collagen
由图7可知,自组装后草鱼皮胶原蛋白展现为典型的纤维结构且具有组装胶原纤维的交错条纹特征,其D周期值为(64.6±1.5)nm、纤维平均粒径为(123.4±32.5)nm,而未组装草鱼皮胶原主要表现为单体分子或数个分子的低聚体形式,其粒径范围为3~22nm且不具备D周期特征。
2.5 胶原蛋白热稳定性分析
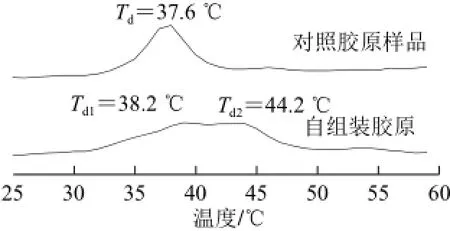
图8 草鱼皮胶原蛋白的DSC测定图谱Fig.8 DSC curve of grass carp skin collagen
由图8可知,在温度扫描模式下,草鱼皮胶原样品的DSC图谱中出现一个明显的吸热峰,归属于胶原分子三螺旋结构解离的吸热行为,其峰值温度定义为胶原的热变性温度Td。对照胶原样品的Td为(37.6±0.3)℃,而自组装后胶原样品展现出两个并肩热变性峰,其中Td1=(38.2±0.5)℃,Td2=(44.2±0.3)℃,该结果提示自组装后草鱼皮胶原蛋白的热稳定性得到了显著提升。
3 讨 论
草鱼皮胶原体外自组装的浊度实验结果表明,体系pH值、离子强度和胶原质量浓度直接影响蛋白分子的有序聚集行为。在弱酸性条件下(pH 5.6)和较高离子强度条件下,胶原分子上带有的同种电荷以及外来离子电荷均会对胶原分子聚集产生抑制作用;高质量浓度胶原溶液(5 mg/mL)与较低质量浓度胶原溶液(1 mg/mL和3 mg/mL)表现出不同的自组装动力学行为,不仅组装平衡时间大幅缩短而且组装速度变化也由三段式演变为两段式。但是,这种质量浓度改变导致胶原组装行为的变化是否会在重组胶原纤维形态上有所反映则尚需进一步的实验验证。草鱼皮胶原组装速度和自组装程度均随体系温度的增加而增加,说明胶原自组装是吸热过程,因为在分子有序聚集过程中需要替换亲水性氨基酸残基上的结合水而产生能量消耗。
天然胶原自组装进程可以划分为3 个阶段,即成核段、组装段和平衡段[16]。其中“成核段”是数个分子聚集成胶原微纤维核,由于尺度较小,因此在浊度实验中表现为吸光度的缓慢上升或维持不变;而“组装段”是胶原分子围绕微纤维核进一步聚集的过程,表现为溶液吸光度的快速上升。在本次实验中,草鱼皮胶原在多数实验条件下(20 ℃和NaCl浓度300 mmol/L条件除外)表现为不同于哺乳动物胶原的自组装行为,即没有明显的“成核段”而是以“快速组装段”、 “低速组装段”和“平衡段”为典型特征。由于鱼类最适生存温度一般低于30 ℃,因此鱼类胶原热变性温度和最适自组装温度均低于哺乳动物胶原,即使在较低温度条件下鱼类胶原分子也可能产生分子间的聚集行为。由此,草鱼皮胶原自组装“成核段”的消失可能是因为在胶原溶液的透析阶段(4 ℃)就已经完成了成核过程。针对透析但未自组装胶原的粒径分析可以发现其粒径分布在3~22 nm范围(图7a),符合胶原微纤维的粒径特征。
草鱼皮胶原自组装纤维形态学观察的结果证实鱼类胶原的体外自组装也是一种分子间有序排列的过程,即表现为错列分布的横纹D周期。哺乳动物胶原纤维D周期值约为67 nm[17],但是我们测定的草鱼皮胶原纤维D周期值为(64.6±1.5)nm。为了消除观察设备的影响,以猪皮胶原为对照,在相同条件下观察猪皮自组装胶原纤维的D周期值,结果为(67.2±1.8)nm,说明草鱼皮胶原组装纤维结构与哺乳动物胶原存在差异性。
自组装前后胶原热变性温度的测定结果表明,经自组装处理后草鱼皮胶原出现两个并肩热变性峰。其中Td1温度与对照Td基本一致,而Td2温度则明显提升(P<0.05)。胶原分子热变性过程的实质是胶原三肽链的解离。其中,水分子发挥重要作用。只有当水分子渗透进入三肽链内部,这种解离过程才能实现[18]。胶原自组装的纤维化行为显然增加了水分子的渗入难度,从而提升了胶原分子的热变性温度。自组装胶原中同时存在Td1和Td2变性温度,说明在自组装胶原产品中仍有部分未纤维化的胶原单体或低聚体分子存在。
4 结 论
与哺乳动物胶原一样,草鱼皮胶原蛋白具备体外自组装能力,但是其自组装行为受胶原质量浓度、pH值、离子强度、温度等因素的影响。草鱼皮胶原蛋白可以通过自组装形成具有D周期特征结构的胶原纤维,但是其D周期长度值略低于哺乳动物胶原。经纤维重组后,草鱼皮胶原蛋白的热稳定性得到明显提升。
参考文献:
[1] INANOVA V P, KRIVCHENKO A I. A current viewpoint on structure and evolution of collagens[J]. Journal of Evolutionary Biochemistry and Physiology, 2012, 48 (2): 127-139.
[2] GAUZA M, KUBISZ L. Electrical conductivity of fish skin collagen in the temperature range 290-380 K[J]. Acta Physica Polonica A, 2010, 118(1): 54-57.
[3] SUGIURA H, YUNOKI S, KONDO E, et al. in vivo biological responses and bioresorption of tilapia scale collagen as a potential biomaterial[J]. Journal of Biomaterials Science, 2009, 20(10): 1353-1368.
[4] SIRBU R, NEGREANU-PIRJOL T, LECA M, et al. Rheological characterization of collagen gels from marine resources of black sea and chlohexidine salt for using in dental medicine[J]. International Journal of Biological and Life Sciences, 2011, 7(3): 158-163.
[5] KYLE S, AGGELI A, LNGHAM E, et al. J. Production of selfassembling biomaterials for tissue engineering[J]. Trends in Biotechnology, 2009, 27(7): 423-433.
[6] GOUGH A M J E, SAIANI A. Self-assembled peptide-based hydrogels as scaffolds for in vitro cartilage repair[J]. European Cells and Materials, 2011, 22(3): 59.
[7] CHENG X, GURKAN U A, DEHEN C J, et al. An electrochemical fabrication process for the assembly of anisotropically oriented collagen bundles[J]. Biomaterials, 2008, 29(22): 3278-3288.
[8] SIRBU R, NEGREANU-PIRJOL T, LECA M, et al. Rheological characterization of collagen gels from marine resources of black sea and chlohexidine salt for using in dental medicine[J]. International Journal of Biological and Life Sciences, 2011, 7(3): 158-163.
[9] BAMA P, VIJAYALAKSHIMI M, JAYASIMMAN R, et al. Extraction of collagen from cat fish by pepsin digestion and preparation and characterization of collagen chitosan sheet[J]. International Journal of Pharmacy and Pharmaceutical Sciences, 2010, 2(4): 133-137.
[10] 汪海波, 梁艳萍, 汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J]. 水产学报, 2012, 36(4): 553-560.
[11] LI Y, ASADI A, MONROE M R, et al. pH effects on collagen fibrillogenesis in vitro: electrostatic interactions and phosphate binding[J]. Materials Science and Engineering C, 2009, 29(5): 1643-1649.
[12] TENNI R, SONAGGERE M, VIOLA M, et al. Self-aggregation of fibrillar collagens Ⅰ and Ⅱ involves lysine side chains[J]. Micron, 2006, 37(7): 640-647.
[13] REDDY G K, ENWEMEKA C S. A simplified method for the analysis of hydroxyproline in biological tissue[J]. Clinical Biochemistry, 1996, 29(3): 225-229.
[14] PAN Yao, WANG Haibo, WANG Haiyin, et al. Biochemical and physiological characterization of collagen from the skin of Bighead carp (Aristichthys nobilis)[J]. Journal of Food, Agriculture & Enviroment, 2012, 10(3/4): 92-98.
[15] YAN M, LI B, ZHAO X, et al. Effect of concentration, pH and ionic strength on the kinetic self-assembly of acid-soluble collagen from walleye pollock Theragra chalcogramma skin[J]. Food Hydrocolloids, 2012, 29(1): 199-204.
[16] GOBEAUX F, MOSSER G, DAVIDSON P, et al. Fibrillogenesis in dense collagen solutions: a physicochemical study[J]. Journal of Molecular Biology, 2008, 376(5): 1509-1522.
[17] STEPLEWSKI A, HINTZE V, FERTALA A. Molecular basis of organization of collagen fibrils[J]. Journal of Structural Biology, 2007, 157(2): 297-307.
[18] FRIESS W, LEE G. Basic thermoanalytical studies of insoluble collagen matrices[J]. Biomaterials, 1996, 17(23): 2289-2294.
Self-Assembly Kinetics of Collagen from Grass Carp Skin
ZHAO Yan, LU Liang, YANG Ling, DENG Ming-xia, YANG Huan, WANG Hai-bo*
(Collage of Food Science and Technology, Wuhan Polytechnic University, Wuhan 430023, China)
In this study, the kinetic behavior and influential factors of self-assembly, fiber morphology and thermal stability of pepsin soluble collagen from grass carp skin were explored. The turbidity and self-assembly degree indicated that grass carp skin collagen had self-assembling ability although it was influenced by collagen concentration, pH, ionic strength and temperature. Under the conditions of 7–8, 3–5 mg/mL, 25–30 ℃ and 0–200 mmol/L for pH, collagen concentration, culture temperature and NaCl concentration, respectively the self-assembling process progressed faster and finally reached a higher level. The kinetic analysis suggested that the whole assembly react ion could be divided into nucleating, fibrillogenesis and plate phases at higher ionic strength and lower temperature, but divided into rapid assembly, slow assembly, and plate phases when the assembling conditions were changed to lower ionic strength and higher temperature. Morphological observations indicated that grass carp skin collagen could be self-assembled into fibrils with characteristic D-periodicity in vitro, but the length of D-periodicity (64.6 nm) was smaller than that of the mammalian counterpart (approximately 67 nm). The results of DSC analysis showed that the thermal stability of grass carp skin collagen was obviously improved after self-assembly.
fresh water fish; collagen; self-assembly; kinetics
S 943
A
1002-6630(2014)11-0021-06
10.7506/spkx1002-6630-201411005
2013-11-14
国家自然科学基金面上项目(21376183);武汉市科技局科技攻关计划项目(200920137006);武汉市农副资源循环利用与新产品开发工程技术中心资助项目(201120637175);湖北省自然科学基金重点项目(2009CDA117);武汉市科技局应用基础研究项目(2013020501010177);湖北省高等学校优秀中青年科技创新团队计划项目(T201208)
赵燕(1990—),女,硕士研究生,研究方向为天然产物化学。E-mail:wanghaibo@whpu.edu.cn
*通信作者:汪海波(1971—),男,教授,博士,研究方向为天然产物化学。E-mail:wanghaibo@whpu.edu.cn
