KAI1蛋白对786-O细胞增殖及凋亡的影响*
2014-02-09窦红珍付云锐
陈 峰,鲁 伟,窦红珍,游 刚,付云锐,谢 鑫
(重庆市南川区人民医院泌尿外科 408400)
肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)是肾小管上皮细胞发生一系列的链锁基因突变或功能损伤所造成的瘤变过程[1]。CCRCC是肾癌中最为常见的病理学亚型,大约占肾癌的60%~85%[2]。因此,CCRCC的致病机制的研究对人类抗肾癌有着重要的作用。
有研究表明[3],趋化因子受体CXCR-4是一种缺氧性反应分子,抑癌基因VHL可以对CXCR-4进行反向调节,使其表达降低,当VHL抑癌基因失活时可使肿瘤通过依赖乏氧诱导因子(HIF)依赖性CXCR-4发生转移,因此,CXCR-4的表达关系到CCRCC的侵润、转移。近年来,研究证实KAI1也是一种肿瘤转移抑制基因,在肿瘤的转移、增殖方面有明显的作用[4]。KAI1最早在前列腺癌细胞中被发现,因此,被称为前列腺癌转移抑制基因[5]。当KAI1的正常功能被破坏或丧失时,可导致肿瘤细胞的黏附力、侵袭性、移动性及分化程度受到影响。目前,研究已证实,KAI1在非小细胞肺癌、结直肠癌、鼻咽癌、胃癌等多种肿瘤细胞的转移、增殖及侵袭过程中发挥重要作用[6-8]。但是,KAI1在肾透明细胞癌的侵袭、增殖及转移中是否发挥作用,尚未有研究进行证实。本研究拟通过慢病毒转染KAI1基因到肾癌细胞株中,观察其对人肾透明细胞癌786-O的增殖、转移、侵袭及凋亡的影响,为本研究后续的研究奠定实验基础。
1 材料与方法
1.1 材料 肾透明细胞癌786-O细胞株购自中国医学科学院基础医学研究所。大肠埃希菌DH5α购自北京奥科生物技术有限公司,pCMV慢病毒载体购自上海北诺生物科技有限公司。兔抗人KAI1抗体及羊抗兔辣根过氧化物酶二抗均购自美国Santa Cruz公司。噻唑蓝(MTT)、二甲亚砜(DMSO)购自上海Sigma公司,RPMI-1640培养基购自 Hycolone公司。胎牛血清购自杭州四季青公司。Annexin V/FITC凋亡试剂盒购自南京凯基生物公司。本实验分为3组:转染KAI1基因的作为实验组(pCMV-KAI1)、转染pCMV空载体的为阴性对照组(pCMV-NEG)、未进行处理的786-O细胞为空白对照组(CON)。
1.2 方法
1.2.1 细胞培养 将786-O细胞接种于细胞培养瓶中,用含有20%胎牛血清的RPMI1640培养液培养,37℃、5%CO2的恒温培养箱中培养。每2~3d传代一次,细胞消化使用胰酶,之后进行培养,并取对数生长期的786-O细胞进行培养。
1.2.2 慢病毒感染及感染率的检测 慢病毒载体感染786-O细胞,具体过程参见文献[9],786-O细胞接种于24孔板,待细胞生长至约80%融合时,分别加入不同效价的pCMV-KAI1,培养6h后弃上清液,换含10%胎牛血清的RPMI 1640培养液继续培养48h,荧光显微镜下观察细胞转染情况,计算感染率。感染率(%)=荧光细胞数/全部细胞数×100%。
1.2.3 MTT实验 将对数生长期的786-O细胞数量调整为大约1×105/细胞培养瓶,并将其接种于96孔细胞培养板,每孔的接种量为100μL,在细胞培养箱中培养24h后,分别转染pCMV-KAI1载体及pCMV空载体,空白对照组使用同体积的PBS溶液。继续静止培养24h,加入10mg/mL的MTT试剂,培养3h后加入DMSO,在酶标仪540nm波长出检测每一孔的吸光度值A。
786-O细胞抑制率=(1-实验组孔平均A值)/空白对照组空A值×100%。
1.2.4 流式细胞仪检测 将对数生长期的786-O细胞接种于六孔板中,保证每孔细胞数大约为2×104/孔,培养24h后加入pCMV-KAI1表达载体,继续培养24h后用胰酶进行消化,并收集786-O细胞。根据Annexin V/FITC凋亡检测试剂盒的使用说明书进行细胞凋亡的检测。
1.3 统计学处理 采用SPSS17.0软件进行数据分析处理,计量资料±s进行表示。采用单因素方差分析进行组间比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 慢病毒转染效率测定 慢病毒载体感染细胞48h,由于pCMV携带有GFP标签,所以,在荧光显微镜下观察慢病毒载体转染效率。慢病毒载体转染的量为MOI-10,实验组可见大量的荧光表达,而空白对照组中未见荧光表达,见图1。

图1 倒置荧光显微镜观察慢病毒转染786-O细胞的转染效率(荧光显微镜×400)
2.2KAI1的表达对786-O细胞增殖活性的影响 实验组转染pCMV-KAI1载体后,通过MTT法检测出实验组分别与阴性对照组和空白对照组比较,786-O细胞的增值能力显著下降,差异有统计学意义(P<0.05),其细胞存活率为39.43%,见图2。
2.3KAI1促发786-O细胞凋亡的发生 由于 MTT结果证实KAI1高表达使786-O细胞的增殖活性降低,作者推测活性的降低可能是由于KAI1诱发了细胞凋亡的发生,因此,流式细胞技术(FCM)检测细胞凋亡情况。结果显示,KAI1的表达显著的增加了786-O细胞凋亡的数量,与阴性对照组和空白对照组相比差异有统计学意义(P<0.05),见图3。
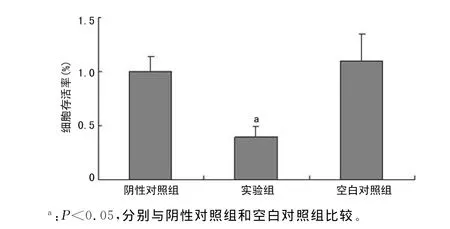
图2 KAI1对786-O细胞增殖活性的影响

图3 流式细胞技术检测KAI1对786-O细胞凋亡的影响
3 讨 论
CCRCC是最为常见的泌尿系统恶性肿瘤,成人肾癌的发病中有大约三分之二为CCRCC,其5年平均生存率一般不足20%[10],同时随着人们生活水平的不断提高,其发病率也在不断升高。CCRCC不同于一般肿瘤,在临床上应用放疗及化疗的方法治疗效果较差,因此,大多的CCRCC患者最终都必须进行手术切除。但是,存在的问题是CCRCC的发病比较隐蔽,症状表现不明显,在确诊时可能已经是肿瘤晚期,发生了大量增殖、扩散,一般预后不佳[11]。尽管CCRCC转移率较高、容易扩散,但其发生发展的分子机制目前尚未十分明确,因此,发现CCRCC增殖及转移的分子机制对于CCRCC的控制及寻找其转移的早期分子标记具有十分重要的意义。
研究显示,KAI1能够抑制肿瘤的增殖及转移,在分离的肿瘤细胞中,KAI1蛋白水平显著降低。这说明KAI1与肿瘤细胞的增殖间进行着激烈的博弈,此消彼长。本研究中,作者首次尝试探讨KAI1蛋白在CCRCC 786-O细胞增殖及细胞凋亡中的作用。
慢病毒载体是以慢病毒的基因组结构框架为模版,将病毒复制及致病的有关基因敲除,并将某些分子标记物及治疗性基因插入,从而组建而成为慢病毒基因治疗工具。慢病毒载体具有转染效率高、在细胞及动物体内维持时间长的特点,同时能够感染多种哺乳动物细胞[12]。本研究选择慢病毒载体p-CMV,其带有绿色荧光标签,可以标记KAI1从而检测其在786-O细胞中的表达效率。GFP绿色荧光显示,在实验组细胞中有80%左右的细胞呈现出了GFP表达阳性,证明KAI1在786-O细胞中的表达效率较高。
MTT结果显示,786-O细胞转染了pCMV-KAI1载体后,786-O细胞的活性显著降低(P<0.01),这说明CCRCC癌细胞786-O的增殖受到KAI1表达的影响,这与Shi等[13]报道的结果相似。Uchida等[14]应用免疫组织化学法对食管癌和正常食管中KAI1表达进行研究,显示食管癌组织中KAI1的表达显著降低,这也证实KAI1的表达可以保证正常食管不发生瘤变。由于786-O增殖活性降低,本研究推测可能是由于786-O细胞发生了细胞凋亡。因此,本研究应用FCM检测了KAI1表达后786-O细胞的凋亡情况,结果证实KAI1表达细胞与阴性对照组和空白对照组相比,早期凋亡数和晚期凋亡数都显著降低,说明KAI1对786-O细胞增殖的抑制作用可能是通过启动细胞凋亡而实现的。Li等[15]也证实,KAI1在非小细胞肺癌中的表达可诱导细胞凋亡的发生,并且抑制了细胞增殖。因此,KAI1蛋白在786-O细胞中的表达,可促进肿瘤细胞的凋亡,从而抑制肿瘤细胞的增殖。因此,术后KAI1蛋白的常规检查可能对诊断和判断预后有一定的价值。对其致病机制的进一步研究,可以为CCRCC的治疗提供新的靶点。
[1] Hahn WC,Weinberg RA.Rules for making human tumor cells[J].N Engl J Med,2002,347(20):1593-1603.
[2] Gigante M,Li G,Ferlay C,et al.Prognostic value of serum CA9in patients with metastatic clear cell renal cell carcinoma under targeted therapy[J].Anticancer Res,2012,32(12):5447-5451.
[3] Staller P,Sulitkova J,Lisztwan J,et al.Chemokine receptor CXCR4downregulated by von Hippel-Lindau tumour suppressor pVHL[J].Nature,2003,425(6955):307-311.
[4]Jiang WX,Song BG,Wang PJ.Expression of nm23,KAI1 and spiral computed tomography findings in primary gallbladder carcinoma[J].Chin Med J(Engl),2009,122(21):2666-2668.
[5] Dong JT,Lamb PW,Rinker-Schaeffer CW,et al.KAI1,a metastasis suppressor gene for prostate Cancer on human chromosome 11p11.2[J].Science,1995,268(5212):884-886.
[6] 吕铮,阎继东,张志勇,等.KAI1和Smad4在非小细胞肺癌的表达及临床病理意义[J].重庆医科大学学报,2012,37(11):968-971.
[7] Malik FA,Sanders AJ,Jones AD,et al.Transcriptional and translational modulation of KAI1expression in ductal carcinoma of the breast and the prognostic significance[J].Int J Mol Med,2009,23(2):273-278.
[8] 季润元,赵玉芳,束晓明,等.胃癌组织 KAI1/CD82、MRP1/CD9的表达及临床意义[J].江苏医药,2012,38(14):1640-1642.
[9] Ghosh SS,Gopinath P,Ramesh AA,et al.Denoviral vect ors:aprom isi ng t ool for gene t herapy[J].Appl Biochem Biotechnol,2006,133(1):9-30.
[10]Li JW,Shen Y,Zhang YG.Experiment research of curcumin on the proliferation and apoptosis of human renal cell carcinoma cell line 786-O[J].中 国 医 药 导 报,2012,9(11):19-21.
[11]Seligson D,Janzen N,Yu H,et al.Using tumor markers to predict the survival of patients with metastatic renal cell carcinoma[J].J Urol,2005,173(5):1496-1501.
[12]Nishitsuji H,Ikeda T,Miyoshi H,et al.Expression of small hairpin RNA by lentivirus-based vector confers efficient and stable gene-suppression of HIV-1on human cells including primary non-dividing cells[J].Microbes Infect,2004,6(1):76-85.
[13]Shi H,Deng JH,Zheng SB,et al.Lentivirus mediated clusterin silence inhibits proliferation and promotes apoptosis in human renal cell Cancer line 786-O in vitro[J].Mol Med Rep,2012,8(1):35-40.
[14]Uchida S,Shimada Y,Watanabe G,et al.Motility-related protein (MRP-1/CD9)and KAI1/CD82expression inversely correlate with lymph node metastasis in oesophageal squamous cell carcinoma[J].Br J Cancer,1999,79(7/8):1168-1173.
[15]Li C,Wang ZY,Wang P,et al.Expression of metastasis suppressor gene KAI1in non-small cell lung Cancer and its significance[J].Chinese Journal of General Practice,2010,8(1):15-17.
