扶正解毒方对前胃癌荷瘤小鼠术后复发模型肿瘤相关巨噬细胞及相关细胞因子的干预研究❋
2014-02-09贾程辉李枋霏何莉莎
贾程辉,李枋霏,何莉莎,李 杰△
(1.中国中医科学院广安门医院肿瘤科,北京 100053; 2.北京中医药大学,北京 100029)
近年来,人们认识到肿瘤相关巨噬细胞(Tumor-associated macrophages,TAM)并非发挥抗肿瘤作用,而是参与并促进肿瘤发生、侵袭和转移的过程[1~3]。目前认为,巨噬细胞至少包括2种不同的活化表型和功能特征亚群[4]:①经典活化的巨噬细胞(classically activated macrophages,caMphi) M1型;②替代性活化的巨噬细胞(alternatively activated macrophages,aaMphi) M2型。Mantovani等[5]认为,M1型和M2型巨噬细胞是巨噬细胞连续活化状态的两个极端,并指出TAM可能发生替代性活化,更偏向于M2型极化的巨噬细胞,递呈抗原的能力很弱,能抑制T细胞增殖,参与肿瘤的生长、进展和转移,以及适应性免疫、血管生成和间质形成等过程[6]。CD分子是确定淋巴细胞表型和分离纯化淋巴细胞的重要依据。已有文献报道[7],M2型巨噬细胞表面甘露糖受体(CD206)表达明显上调,而M1型巨噬细胞FcγⅢ/Ⅱ受体CD16/32表达增加,两者是判断巨噬细胞类型的重要表面标志,其中诱导巨噬细胞向M2型分化的因子包括IL-4、IL-10、IL-13、TGF-β1。本实验在原有实验基础上进一步观察扶正解毒中药抑制肿瘤复发、转移的机制,并推测可能通过抑制肿瘤相关巨噬细胞因子的表达,改善肿瘤微环境,促使M2型巨噬细胞向M1型转化,进而影响肿瘤的转移和复发。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级近交系6~7周615小鼠,雌雄各半,体质量18~20 g,购自中国医学科学院药品鉴定所实验动物中心。
1.1.2 瘤株 小鼠前胃癌细胞由中国医学科学院基础医学研究所病理室用甲基卞基亚硝胺灌胃诱发而成,移植率100%。
1.1.3 药物 实验用扶正解毒方为深棕色浸膏,每1 g浸膏含生药6 g,由黄芪、党参、生白术、枸杞子、土茯苓、制何首乌、藤梨根组成制剂由中国中医科学院广安门医院制剂室提供。阳性对照化疗药物为5-氟脲嘧啶注射液10 ml/支、0.25 g/支,由上海旭东海普药业有限公司生产。
1.1.4 试剂 Mouse IL-4、 IL-10 、IL-13 、TGF-β Immunoassay ELISA Kit (R&D,USA);PE anti-mouse F4/80 ,PE Rat IgG2a,κ Isottype Ctrl (Biolegend,USA);APC anti-mouse CD206 ,APC Rat IgG2a, κ Isottype Ctrl (Biolegend,USA);FITC anti-mouse F4/80,FITC Rat IgG2a, κ Isottype Ctrl (Biolegend,USA)。
1.2 方法
1.2.1 动物造模 复苏小鼠前胃癌细胞(MFC),传代培养3代,对数生长期时胰酶消化终止生长,制备成单细胞悬液,调整细胞浓度为4×107/ml,取0.05 ml瘤细胞悬液接种于小鼠左侧后肢爪垫内侧皮下(移植时避免细胞悬液外溢)。
1.2.2 给药方法 足垫接种MFC细胞后14 d切除原发瘤,依据原发瘤重随机分组。对照组为不接瘤的正常小鼠及不接瘤但实行截肢手术小鼠,其他组为接瘤组。①对照组(Normal-operation、Normal):自截肢后24 h给予小鼠饮水灌胃,每日0.2 ml,每日1次;中药组(FZJD-treated):自截肢后24 h给予小鼠扶正解毒中药灌胃,每日0.2 ml,每日1次。每公斤体质量小鼠用药量相当于成人(按60 kg计)临床用量的15倍;化疗组(5-FU- treated):从截肢后当日给予5-氟脲嘧啶注射液,按照20 mg/kg 剂量腹腔注射 0.2 ml,每天1次,连续 7 d;②中西医结合组(FZJD+5-FU):自截肢后24 h给予小鼠扶正解毒中药灌胃,每日1次0.2 ml。每公斤体质量小鼠用药量相当于成人(按60 kg计)临床用量的15倍。并给予5-氟脲嘧啶注射液,按照20 mg/kg 剂量腹腔注射 0.2 ml,每天1次,连续7 d;模型组(untreated):自截肢后24 h给予小鼠饮水灌胃,每日1次0.2 ml。15 d后处死小鼠,取血、复发瘤和脾脏组织。
1.3 检测
1.3.1 流式细胞术检测M1、M2型巨噬细胞表型 将复发瘤、脾脏从小鼠身上剥离,PBS冲洗干净,称取组织1 g分别置于培养皿中(预冷),用无菌眼科剪剪成小块置滤膜中研磨。吸取所有研磨液滤至新离心管中,1200 rpm离心5 min,倒走上层清液;2%FBS-PBS1200 rpm离心洗涤3次,每次5 min;将细胞重悬在2%FBS-PBS,即为肿瘤组织的单细胞悬液,0.4%台酚蓝染色,显微镜下进行细胞计数,显示细胞存活率大于90%;取1×106个细胞重悬于100 μl 2%FBS-PBS中,用微量移液枪滴加PE-F4/80+和APC-CD206+、FITC-CD16/32抗体各2 μl,避光孵育20 min;PBS洗涤2遍,将细胞重悬于300 μl 1%多聚甲醛中过滤,上流式细胞仪检测。
1.3.2 ELISA法检测IL-4、IL-10、IL-13 、TGF-β1的含量 制取小鼠血清分装样本储存于-80℃冰箱中,检测前置于室温融化。每个微孔中加入50 μl Assay Dilute RD液,再分别加入50 μl标准检测样本、对照样本、小鼠血清样本,轻轻拍打微板框1 min充分混匀,盖上黏条室温孵育2 h。吸走微孔中的液体,加入400 μl的wash buffer洗涤5次,将微孔板翻转在厚纸巾上拍打直至吸干所有液体。在每个微孔中加入100 μl抗体结合物Conjugate,盖上黏条,室温孵育2 h;重复洗涤步骤,在每个微孔中加入100 μl显色反应液Substrate Solution,室温避光孵育30 min,在每个微孔中加入100 μl反应终止液Stop solution,轻轻拍打微板以混匀,将微板置于酶标仪,在450 nm与570 nm波长下检测吸光度OD值。
1.4 统计学方法

2 结果
2.1 扶正解毒中药对脾脏组织中M2、M1型巨噬细胞表达含量的影响(表1)
2.2 扶正解毒中药对肿瘤组织中M2、M1型巨噬细胞表达含量的影响(表2)
2.3 扶正解毒中药对不同组织不同干预模式下M2/M1比值的影响(表3)
2.4 前胃癌小鼠血清中肿瘤相关细胞因子的表达 (表4)
3 讨论
国家“八五”期间,我科采用扶正解毒方剂配合化疗治疗胃肠癌术后277例。临床研究表明,该药不但能增加化疗完成率,Ⅲ期胃癌5年生存率比健脾益肾冲剂同期胃癌5 年生存率还提高了9.1% ,生存期得到一定延长[8]。前期动物实验结果显示,扶正解毒方联合5-FU抑制局部肿瘤复发率达75%,抑制远处肺转移率达50.07%,抑制淋巴结转移率达75.80%,提高生存期率达16.91%,与临床研究结果相符,且同单一治疗方案比较具有明显优势。
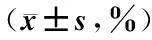
表1 脾脏组织中M2、M1型巨噬细胞含量
注:中西医结合组与模型组、化疗组、中药组比较:#P<0.05;与正常空白组、空白术后组比较:P>0.05; 模型组与其他各组比较:*P<0.05

表2 肿瘤组织中M2、M1型巨噬细胞含量比较
注:中西医结合组与模型组比较:#P=0.036<0.05;与中药组、化疗组比较:P>0.1;模型组与其他各组比较:*P=0.034<0.05

表3 不同组间M2/M1比值情况变化表
注:模型组与其他各组比较:*P=0.000<0.05); 中西医结合组与中药组、化疗组比较:#P<0.05; 模型组与其他各组比较**P=0.000<0.05;中西医结合组与中药组、化疗组比较:&P<0.05

表4 小鼠血清中肿瘤相关细胞因子表达表
注:中西医结合组与模型组比较:#P=0.013<0.05; 模型组与其他各组比较:*P<0.05;模型组与其他各组比较:**P<0.05;中西医结合组与模型组、中药组、化疗组比较:&P<0.05
肿瘤相关巨噬细胞(Tumor-associated macrophages,TAM)是肿瘤间质的主要组成部分,约占肿瘤间质中炎症细胞的30%~50%。Porta等[9]在总结前人TAM研究成果的基础上,提出巨噬细胞具有杀伤肿瘤和促瘤生长的双重作用。M1型巨噬细胞可通过直接或间接分泌多种促炎性细胞因子杀伤病原体和肿瘤细胞;而M2型巨噬细胞表现为较低的抗原提呈能力,并可通过分泌抑制性细胞因子如IL-10、TGF-β等下调免疫应答。IL-4 、IL-10、IL-13 和 TGF-β都是与 M2 型巨噬细胞有着密切关系的细胞因子。肿瘤组织可释放这些细胞因子使血液中的单核细胞募集并分化为 TAM,而 TAM 本身也可分泌这些因子从而促进肿瘤的生长。如此形成一个恶性循环,使得 TAM 浸润程度加深,肿瘤恶性进程加快。
从实验结果可推测,M2型巨噬细胞和肿瘤的发生发展有相关性且关系密切。 实验结果,接瘤组和非接瘤组M2型巨噬细胞表达含量明显高于非接瘤组;不同组织中,表达含量差异明显,脾脏中M1型含量大于M2型,而肿瘤组织中与之相反;不同的干预模式下,模型组(只接瘤不药物干预)M2型巨噬细胞的含量明显高于其他组,M1型巨噬细胞含量低于其他组,给予扶正解毒中药、5-FU、中西结合治疗后M2、M1变化明显。
M2/M1比值对于胃癌的预后评估有一定的参考意义, 实验结果可知,脾脏组织中两者比值呈“斜坡形”下降,肿瘤组织中者的比值呈“峭壁形”下降。无论是肿瘤组织、脾脏组织中M2/M1,模型组均高出其他组若干倍,与其他组比较差异有统计学意义(P<0.01)。给予扶正解毒中药、化疗药、中西结合治疗后,数值下降趋势非常明显。相较于单一细胞值来讲,二者比值更为灵敏,组间比较差异有统计学意义(P<0.01),IL-4、IL-10、IL-13、TGF-β1助长了肿瘤的发生、进展。实验模型组高表达M2 型巨噬细胞相关细胞因子,肿瘤可引起4种因子的高表达;单纯使用扶正解毒中药干预后,4种因子含量有所降低,IL-3、TGF-β1的含量甚至比化疗组更低,中西结合组下降更明显;不同组别细胞因子的表达趋势同肿瘤相关巨噬细胞表达一致,从侧面证明肿瘤相关巨噬细胞同肿瘤发生发展的相关性。
总之,扶正解毒方在一定程度上促使M2型巨噬细胞向M1型转化,抑制M2 型巨噬细胞相关细胞因子的分泌,从而抑制肿瘤生长和血管、淋巴管生成,一定程度上降低了肿瘤侵袭和转移力,而中西药的联合能有效抑制肿瘤的复发转移。
[1] Wyckoff J. A paracrine loop between tumor cells and macrophages is required for tumor cell migration in mammary tumors[J]. Cancer Res, 2004 (64): 7022-7029.
[2] Sica A, Schioppa T, Mantovani A, et al. Tumor associated macrophages are a distinct M2 polarized population promoting tumors progression: potential targets of anti-cancer therapy[J]. Eur J Cancer, 2006, 42(6): 717-727.
[3] 郭秋均,李杰.肿瘤相关巨噬细胞在重塑免疫微环境中的作用[J]. 肿瘤, 2013, 10:922-927.
[4] David M. The many faces of macrophage activation[J]. J Leuk Biol, 2003, 73 (2): 209-212.
[5] Mantovani A,Sozzani S,Locati M,et al.Macrophage polarization:Tumor associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J]. Trends Immunol, 2002, 23(11):549-555.
[6] Mantovani A, Sica A, Sozzani S, et al. The chemokine system in diverse forms of macrophage activation and polarization[J].
Trends Immunology, 2004, 25(12): 677-686.
[7] 郭强, 李康, 徐林, 等. 4T1荷瘤小鼠肿瘤相关巨噬细胞(TAM)的表型及吞噬功能的研究[J]. 中国免疫学杂志, 2009, 25(3): 225-228.
[8] 孙桂芝, 王桂绵, 陈长怀, 等. 扶正防癌口服液合并化疗治疗晚期胃癌临床和实验研究[J]. 中国中西医结合外科杂志,1995, 1 (5): 266-270.
[9] Portal C. Tumor promotion by tumor-associated macrophages [J]. Adv ExpMed Biol, 2007, 604(1): 67-86.
