前列消癥汤对前列腺癌PC-3细胞PI3K/Akt信号通路表达的影响❋
2014-02-09宋竖旗张亚强
宋竖旗,张亚强,薄 海
(中国中医科学院广安门医院,北京 100053)
前列腺癌是老年男性常见的恶性肿瘤,在欧美其发病率高达4.4%~14.2%,已成为第一位危害男性健康的肿瘤[1]。在我国,该病发病率呈逐年上升趋势。
前列消癥汤是中国中医科学院广安门医院刘猷枋教授临床用于治疗激素非依赖性前列腺癌(androgen independent prostate cancer,AIPC)的经验有效方。前期临床研究发现[2,3],该方能明显提高晚期前列腺癌患者生活质量,抑制PSA的过快增长,延长患者生存期,但其具体分子机制不明。本研究围绕PI3K/Akt信号通路,采用血清药理学方法探讨含药血清对PI3K/Akt信号通路中的重要分子PTEN、Akt、mTOR、NF-κB表达的影响,揭示中药复方治疗前列腺癌的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞株 人激素非依赖性前列腺癌PC-3细胞株(简称PC-3细胞)购自中国医学科学院协和医科大学细胞库,在我院中心实验室长期冻存。
1.1.2 实验药物与试剂 F12/DMEM 1:培养基、胎牛血清(FBS),美国Hyclone公司;胰蛋白酶,吉诺生物制品公司; RNA柱式抽提试剂盒,上海生工生物工程公司;RT-PCR试剂盒,上海东洋纺生物科技有限公司。
1.2 主要仪器
CO2细胞培养箱,美国Shell Lab公司;超净工作台,苏州净化设备厂;F039300A型Sunrise酶标仪,瑞士TECAN公司;高压蒸汽灭菌器,日本HIRAYAMA 公司;台式干燥箱,上海森信实验仪器有限公司;RT-PCR仪,美国应用生物系统公司;凝胶成像系统,德国Leica公司;JY99-IIIB型超声波细胞破碎仪,宁波新芝生物科技股份有限公司;5415R型高速离心机,德国Eppendorf公司;Lambdal P40紫外可见光分光光度仪,美国pe公司;Mini-ROTEAN3电泳系统与Mini Trans-Blot转移系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 前列消癥汤水煎剂制备 前列消癥汤组方:黄芪15 g,生薏苡仁30 g,莪术9 g,土贝母9 g,猪苓15 g,白花蛇舌草20 g,黄精10 g。成年雄性Wistar大鼠20只,体质量250~300 g,采用随机数字表法分为4组,每组5只。人和大鼠间按体表面积折算的等效剂量比率为人(70. 0 kg)∶大鼠(200 g)=1∶0. 018换算大鼠的等效剂量,分为低剂量组(大鼠与人等效剂量)、中剂量组(10倍于低剂量组)、高剂量组(20倍于低剂量2组),计算各实验组每只大鼠每天剂量,再计算5只大鼠7 d的剂量。将各组5只大鼠7 d剂量的中药复方制备成水煎剂220 ml, 用于每组5只,每只大鼠每次3 ml,每天2 次灌胃共7 d。水煎剂制备过程:将上述剂量的3组药方的中药分别置煎煮容器内,加入相当药材5倍量的冷水浸泡1 h,煮沸30 min过滤。药渣再加3倍量的水,继续煎煮20 min过滤。合并2次滤液,于水浴上浓缩成220 ml。水煎剂于开始灌胃的前1 d制备完成,置于4 ℃冰箱保存备用。
1.3.2 含药血清制备 将大鼠按随机数字表法分为4组,每组5只。分别用3组中药的水煎剂、生理盐水灌胃,每次3 ml,每天2 次共7 d,末次给药2次,间隔1 h。最后1次灌胃后于60~90 min 时间段内,10%水合氯醛注射液按3.5 ml/kg 剂量腹腔注射,大鼠麻醉后下腔静脉取血,置于无抗凝管内。室温下静置30 min,待凝血坚固、血清析出。3000 r/min,离心20 min后,吸出上清即为含药血清或空白血清。同组血清混合,用0.22 μm 的微孔膜过滤除菌、分装,置于-20 ℃保存备用。
1.3.3 细胞培养 前列腺癌细胞株PC-3培养于含10%胎牛血清F12/DMEM1∶1培养基中,置于温度为37 ℃气体环境为5% CO2、湿度为饱和湿度的培养箱中培养。每2~3 d换液1次,5~6 d消化(0.25%胰蛋白酶液)、传代。
1.3.4 细胞冻存 ①生长于对数期的细胞长满培养瓶约90%以上时,加入消化液制成单细胞悬液;②细胞悬液离心后去除上清,加入预先配制好的冻存液重悬细胞;③将悬浮于冻存液的细胞按照每管约1.5 ml分装于冻存管中,根据细胞生长状态可1瓶冻1管;④先将冻存管置于4 ℃约40 min,接着置于-20 ℃约30~60 min、置于-80 ℃超低温冰箱中放置过夜,最后置于液氮罐中长期保存。
1.3.5 细胞复苏 ①将水浴锅预热至37 ℃;②从液氮罐中取出细胞,迅速将冻存管投入到已经预热的水浴锅中解冻,并要不断地摇动,使管中的液体迅速融化;③酒精消毒冻存管的外壁,吸出细胞悬液注入离心管并加入10倍的培养液,混匀后离心去上清;④加入培养液重悬成单细胞悬液后,接种于培养瓶中继续培养,第2天换液1次。
1.3.6 Western blot 免疫印迹测定蛋白表达 采用Western blot 免疫印迹法,以mTOR、p-AKT等蛋白表达为参照,与β-actin蛋白表达量的比值作为组织内蛋白的相对表达水平。具体步骤如下:①灌胶与上样:配制15%分离胶加水封胶。分离胶凝固后配制4%的浓缩胶插入样品梳,待到浓缩胶凝固后取出样品梳。加入50 μg蛋白的上样样品至0.5 ml离心管中,加入5×SDS上样缓冲液至终浓度为1×。上样前将样品于沸水中煮5 min,使蛋白变性冷却至室温,加足量的电泳液后上样;②电泳:先用80 V电压电泳30 min,待样品走出加样孔后,将电压调至100 V。电泳至溴酚兰刚跑出即可终止电泳,停止电泳并拆开胶板;③转膜操作:按胶大小切6张Whatman 3 mm 滤纸及1张PVDF膜,在预冷的1×转膜Buffer中,浸泡凝胶30 min,浸泡PVDF膜、滤纸、海绵20 min,以1×转膜Buffer注满电转膜槽,接通电泳仪,以60 V电压转移2 h。转完后将膜用1×丽春红染液染5 min,水冲洗后可见膜上的蛋白条带;④免疫反应:将膜用TBS从下向上浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭1 h。将c-fos等蛋白抗体以1×TBST稀释至适当浓度(1∶1000稀释),将膜蛋白面朝下放于抗体液面上,4 ℃冰箱中孵育过夜。然后用TBST在室温下脱色摇床上洗2次,每次10 min。同上方法准备二抗稀释液并与膜接触(约1∶1000),室温下孵育1 h后,用TBST在室温下脱色摇床上洗2次,每次10 min,进行化学发光反应;⑤化学发光、显影、定影:将膜发光底物工作液A和B两种试剂在保鲜膜上等体积混合1 min后,将膜蛋白面朝下与此混合液充分接触1 min,将膜移至X光片夹中曝光X片。曝光结束后放入显影液中显影并定影,自来水冲去残留的定影液后,室温下晾干;⑥凝胶图像分析:将胶片进行扫描或拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值。
1.3.7 RT-PCR法测定基因表达 ①细胞制备:用含10%胎牛血清的F12/DMEM1∶1培养液培养的PC-3细胞, 长至瓶底的80%~90%时弃去培养液,0.25%胰酶消化,制成单细胞悬液,1500 rpm离心5 min,弃上清液收集细胞。用含10%胎牛血清的培养液将细胞制成单细胞悬液。将细胞悬液浓度调整至2×105ml,接种至六孔板中,37 ℃培养过夜,细胞贴壁,生长率达80%~90%,将培养液分别更换为含10%胎牛血清的培养液、大鼠空白血清及低、中、高剂量大鼠含药血清培养液3 ml,培养24 h;②按照Trizol试剂说明书提取细胞总RNA,紫外分光光度计测A260、A280,定量并检测其纯度,提取总RNA进行1.0%的琼脂糖凝胶电泳鉴定。提取的总RNA用Quick Master RT试剂盒反转录为cDNA。RT-PCR反应体系:2×RT-PCR Quick Master Mix 25ul,引物各10 pmol,RNA样品0.1~2 μg,Mg2+2.5 μl,上游引物 10 pmol,下游引物 10 pmol,加DEPC水至50 μl。各β-actin(内参基因)、PTEN、RELA、mTOR等引物均由Primer Premier 5.0设计软件设计,上海生工公司合成(引物序列见表1)。反应条件:90 ℃预变性30 min,90 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1min,共40个循环;72 ℃后延伸7 min。1.0%的琼脂糖凝胶电泳观察扩增结果。实验中同步进行内对照β-actin的定量检测,分别制备目的基因和内参基因β-actin的标准曲线。结果分析使用双标准曲线法进行相对定量,以mTOR、PTEN、RELA(NF-κB)基因分别与β-actin拷贝数之比为目的基因的相对表达量。
1.4 统计学方法
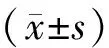
2 结果
2.1 含药血清对PTEN、p-Akt、mTOR及NF-κB p65蛋白表达影响
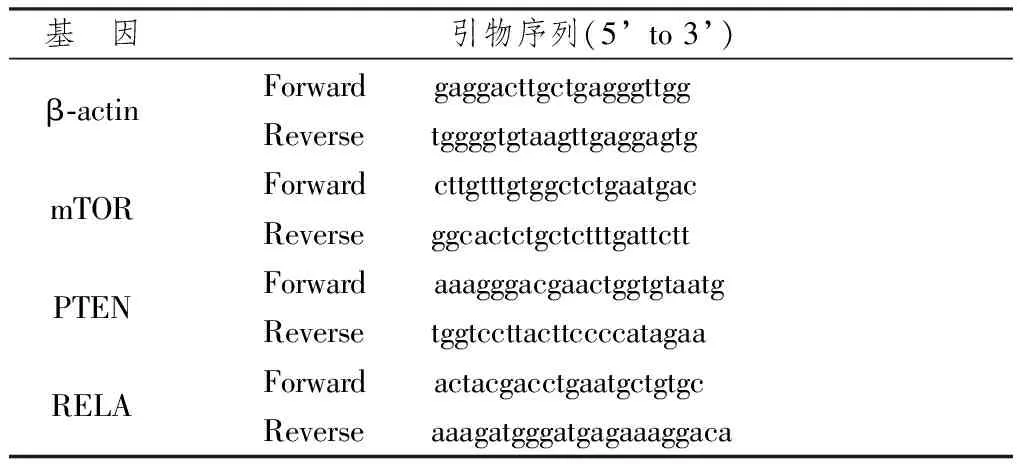
表1 各基因引物序列
表2、图1显示,前列消癥汤大鼠含药血清各剂量组培养前列腺癌PC-3细胞株24 h后,各细胞组的p-Akt蛋白水平、mTOR蛋白水平及NF-κB p65蛋白水平呈明显下降趋势,而PTEN蛋白水平呈现升高趋势。前列消癥汤含药血清中、高剂量组PTEN蛋白表达量明显高于胎牛血清组(对照组),差异有统计学意义(P<0.05);前列消癥汤含药血清中、高剂量组p-Akt和NF-κB p65蛋白表达量低于对照组,差异有统计学意义(P<0.05);经含药血清处理后,mTOR蛋白表达水平随药物剂量的升高呈现下降趋势,差异无统计学意义(P>0.05)。
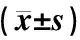
表2 含药血清对PC-3细胞PI3K/Akt信号通路蛋白表达影响
注:与对照组比较:*P< 0.05
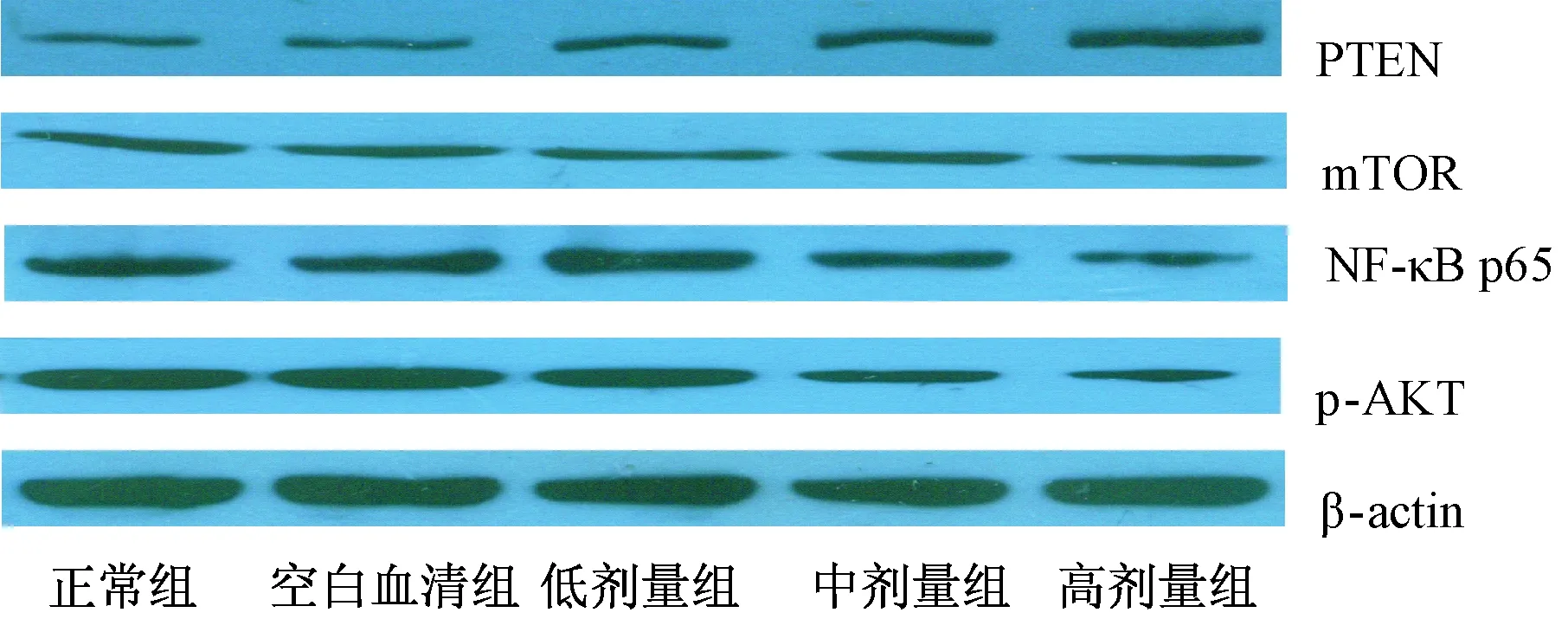
图1 含药血清对PI3K/Akt信号通路主要分子蛋白表达影响
2.2 含药血清培养对mTOR、PTEN、RelA(NF-κB)基因表达的影响
表3、图2显示,用含10%血清的培养液培养前列腺癌PC-3细胞24 h后,前列消癥汤含药血清高剂量组mTOR、RelA(NF-κB)基因表达被抑制,与胎牛血清组、空白血清组比较差异有统计学意义(P<0.05);胎牛血清组与空白血清组比较,mTOR基因表达差异无统计学意义(P>0.05)。前列消癥汤含药血清高剂量组PTEN基因的表达增强,与胎牛血清组、空白血清组比较差异有统计学意义(P<0.05);胎牛血清组与空白血清组比较,PTEN基因表达差异无统计学意义(P>0.05)。
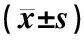
表3 含药血清对mTOR、PTEN和NF-κB/RelA基因表达影响
注:与胎牛血清组比较:*P< 0.05

图2 含药血清对PC-3细胞PI3K/AKT通路中mTOR、PTEN和NF-κB/RelA基因表达影响注:1.大鼠含药血清高剂量组;2.胎牛血清组;3. 大鼠空白血清组
3 讨论
磷脂酰肌醇3-激酶/蛋白激酶 B(phosphatidy-linositol-3-kinase/protein kinase B,PI3K/Akt)信号通路是细胞内重要的信号转导途径之一。研究表明,PI3K/Akt信号通路对激素非依赖性前列腺癌(androgen independent prostate cancer,AIPC)的发生发展及转归中起重要作用。AIPC细胞表达大量活化的PI3K和Akt,活化的Akt能调节肿瘤细胞的增殖、凋亡、代谢、细胞周期以及肿瘤血管生成,促进AIPC的发生、发展[4~6]。PTEN (Phosphatase and tensin homologue deleted on chromo-some ten) 是1个抑癌基因,能特异地使磷脂酰肌醇-3,4,5-三磷酸3’位脱磷酸,实现PI3K/AKT信号通路的负性调节[7]。PTEN丢失或功能失常是前列腺癌发生最常见的病因之一,而PTEN的失活必然导致PI3K/AKT通路活化。Wang等采用Cre-Loxp系统以去除PTEN的表达,构建的小鼠前列腺癌模型表明,由PTEN丢失引发的小鼠前列腺癌与人体前列腺癌发生有着相似的过程,并且还会引起该肿瘤细胞的转移与不依赖于雄激素的增殖[8]。Akt处于PI3K/Akt信号传导通路的核心部位,在细胞的增殖、生存及凋亡和细胞恶变的产生中扮演重要角色。Akt的活化与肿瘤的发生发展密切相关,活化的Akt在介导细胞生长和增殖、细胞运动和侵袭、细胞凋亡和抵抗化疗、放疗方面有重要作用。多种生长因子、激素、细胞因子、PTEN的失活等均可刺激Akt的活化。激活后的磷酸化Akt(p-Akt)蛋白再转位到胞浆中或胞核内,通过对一系列底物的磷酸化,从而发挥其生物学功能。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是Akt最重要的底物之一。mTOR在哺乳动物中最重要的生物学功能是参与蛋白翻译的调节,mTOR可整合细胞外生长因子、营养、能量等各种信号,通过RNA的转录尤其是蛋白质翻译合成调控细胞的生长、增殖和分化。核转录因子kappa B(NF-κB)是1个转录因子蛋白家族,包括5个亚单位,即Rel (cRel)、p65 (RelA, NF-κB3)、RelB和p50(NF-κB1)、p52(NF-κB2),最常见的NF-κB二聚体是p65与 p50组成的异二聚体。在静息的细胞中,NF-κB 和NF-κB 的抑制单位IκB形成复合体,以无活性形式存在于胞浆中。当细胞受细胞外信号刺激后,IκB激酶复合体(IκB kinase,IKK)活化将IκB磷酸化,使NF-κB暴露核定位位点。NF-κB与PI3K/Akt信号通路关系密切,它是Akt的作用靶基因之一。PKB/Akt可直接磷酸化IKKa,使IκB激酶(IKK)激活,调节NF-κB活性。PKB/Akt对于IKK介导的IκB降解和NF-κB激活是必需的。PKB/Akt是NF-κB依赖的基因转录的重要调节因素,对刺激前列腺癌细胞的生长有重要作用[9]。由此可见,PI3K/Akt信号通路对AIPC的发生发展起重要作用,PTEN功能失常激活PI3K/AKt信号通路,Akt与它的底物或靶基因促进了前列腺癌细胞增殖和抗细胞凋亡。
前列消癥汤(莪术、土贝母、猪苓、白花蛇舌草、生薏苡仁、炙黄芪、黄精组成)是由中国中医科学院广安门医院著名中西医结合泌尿外科专家刘猷枋教授治疗激素非依赖性前列腺癌(AIPC)的经验方。刘猷枋教授在临床诊治过程中,观察到晚期前列腺癌病机,多属本虚标实,本虚指正气不足、气血亏虚,标实指湿热、瘀毒[10]。正气不足,邪气蔓延,癌瘤破坏人体阴阳平衡,耗损气血津液;多数患者经过药物或手术去势后肾精亏虚、气血失和而出现潮热、汗出等一系列症状。前列消癥汤就是在这个理论基础上以利湿解毒、益气养阴为治法组方而成,治疗上应以扶正祛邪并用。方中生薏苡仁健脾渗湿为君药;黄精、黄芪补气养阴,配白花蛇舌草清热解毒为臣药;伍以莪术、土贝母、猪苓解毒散结、祛瘀止痛,共为佐使,诸药合用共达利湿解毒、益气养阴之功,体现了中医扶正祛邪的原则。临床累积治疗AIPC患者100多例,发现该方能改善患者排尿困难、疼痛、食欲减低等症状,提高患者生活质量,延长患者生存期[2,3]。实验研究发现,前列消癥汤能抑制人前列腺癌雄激素不敏感细胞株PC-3的增殖,诱导PC-3细胞的凋亡[11]。既然,PI3K/Akt信号通路对AIPC的发生发展起重要作用,前列消癥汤治疗AIPC有效,且能抑制PC-3细胞的增殖。那么前列消癥汤能否调控PI3K/Akt信号通路而发挥治疗作用?
为验证上述推论,本研究采用血清药理学方法,选取人PC-3细胞作为研究对象,制备前列消癥汤大鼠含药血清、胎牛血清及含药血清培养PC-3细胞,用Western Blot和RT-PCR法检测含药血清对PI3K/Akt通路中关键分子PTEN、Akt、mTOR、NF-κB表达的影响。Western Blot结果,前列消癥汤含药血清各剂量组培养前列腺癌PC-3细胞株24 h后,各细胞组的p-Akt蛋白水平、mTOR蛋白水平及NF-κB p65蛋白水平呈明显下降趋势,而PTEN蛋白水平呈升高趋势。与胎牛血清组(对照组)比较差异有统计学意义(P<0.05),且呈剂量依赖性,含药血清高剂量组效果更明显。RT-PCR结果,前列消癥汤含药血清高剂量组mTOR、RelA(NF-κB)基因表达被抑制,与胎牛血清组、空白血清组比较,差异有统计学意义(P<0.05);胎牛血清组与空白血清组比较,mTOR基因表达无统计学意义(P>0.05)。前列消癥汤含药血清高剂量组PTEN基因的表达增强,与胎牛血清组、空白血清组比较,差异有统计学意义(P<0.05)。由此可推论,前列消癥汤含药血清能下调PI3K/Akt信号通路中Akt、mTOR和NF-κB表达,上调PTEN表达,这可能是中药复方治疗前列腺癌的分子机制之一。
[1] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[2] 张亚强,林飞.前列消癥汤治疗前列腺癌的临床观察[J].中国中西医结合外科杂志,2006,12(2):83-85.
[3] 庞然,高筱松,卢建新,等.前列消癥汤治疗激素难治性前列腺癌临床观察[J]. 北京中医药,2010,29(12):918-919.
[4] Bitting RL,Armstrong AJ.Targeting the PI3K/Akt/mTOR pathway in castration-resistant prostate cancer,2013,20,20(3):83-99.
[5] Bartholomeusz C,Gonzalez-Angulo AM.Targeting the PI3K signaling pathway in cancer therapy[J]. Expert Opin Ther Targets,2012,16(1):121-30.
[6] 饶建明,杨金瑞,易路. PI3K/AKT信号传导通路与雄激素非依赖性前列腺癌关系的进展[J]. 国际泌尿系统杂志,2006,26(5):652-656.
[7] Blanco-Aparicio C,Renner O,Leal JF,et al. PTEN,more than the AKT pathway[J]. Carcinogenesis,2007,28(7):1379-86.
[8] Wang S,Gao J,Lei Q,et al. Prostate-specific deletion of the murine PTEN tumor suppressor gene leads to metastatic prostate cancer[J]. Cancer Cell,2003,4(3):209-21.
[9] Chen JS, Konopleva M,Andreeff M,et al. Drug-resistant breast carcinoma(MCF-7) cells are paradoxically sensitive to apoptosis[J]. J Cell Physiol,2004,200(2):223-34.
[10] 宋竖旗,李灿.张亚强对晚期前列腺癌病因病机的认识[J].中国中医基础医学杂志,2008,14(2):131-133.
[11] 张亚强,林飞.前列消癥汤对前列腺癌裸鼠移植的抑制作用[J].中国中医药信息杂志,2005,12(11):20-21.
