脯氨酸-4-羟化酶在大肠杆菌中的密码子优化表达及对反式-4-羟脯氨酸生物合成的作用
2014-02-08刘合栋袁春伟张震宇
刘合栋,袁春伟,张震宇
(江南大学生物工程学院工业生物技术教育部重点实验室,无锡214122)
脯氨酸-4-羟化酶在大肠杆菌中的密码子优化表达及对反式-4-羟脯氨酸生物合成的作用
刘合栋,袁春伟,张震宇
(江南大学生物工程学院工业生物技术教育部重点实验室,无锡214122)
为了使脯氨酸-4-羟化酶基因在重组大肠杆菌中得到高表达,通过调整大肠杆菌密码子偏好性以及mRNA二级结构,使得脯氨酸-4-羟化酶基因得到优化。将优化后的脯氨酸-4-羟化酶基因插入含有色氨酸串联启动子的pUC19质粒,构建重组质粒pUC19-ptrp2-Hyp,并导入大肠杆菌BL21(DE3)中。在摇瓶水平,重组菌以L-脯氨酸为底物发酵8 h,可积累(0.492±0.034) g/L 的反式-4-羟脯氨酸。在发酵罐水平,通过补料分批发酵来提高反式-4-羟脯氨酸的产量,当补糖速率为18 g/h时,反式-4-羟脯氨酸的产量高达42.5 g/L,反式-4-羟脯氨酸产率为0.966 g/(L·h)。
重组大肠杆菌;脯氨酸-4-羟化酶;反式-4-羟脯氨酸;密码子优化;发酵;条件优化
反式-4-羟脯氨酸广泛应用于医药、化工、动物饲料和美容业等方面。在医药方面,反式-4-羟脯氨酸作为原料可用于合成消炎药、碳青霉烯类[1]。在化工上,反式-4-羟脯氨酸可作为手性原料合成多种聚合物[2]。在动物饲料应用上,添加反式-4-羟脯氨酸可防止因甘氨酸合成不足而导致的营养不良现象[3]。反式-4-羟脯氨酸用于高级化妆品中,可消除氧化剂和调整细胞的氧化还原状态[4]。目前,国内生产反式-4-羟脯氨酸的主要方法是生物提取法,利用动物蛋白来源,如明胶、猪皮为原料,经酸、碱水解后提取反式-4-羟脯氨酸。该方法纯化步骤长,成本高,且废弃物污染严重[5];而化学合成方法合成成本高,也不适合工业生产[6]。
随着微生物资源的开发和生物技术的发展,利用微生物生产反式-4-羟脯氨酸成为可能。1961年, Katz等[7]发现反式-4-羟脯氨酸作为前体物参与链霉菌放线菌素的合成,即羟脯氨酸可经微生物酶代谢合成。1979年,Katz等[8]研究发现游离的反式-4-羟脯氨酸参与绿灰菌素的代谢。Shibasaki等[9]通过筛选得到1株脯氨酸-4-羟化酶酶活最高的指孢囊菌,并命名为指孢囊菌RH1,测序获得脯氨酸-4-羟化酶基因序列。1997年,Shibasaki等[10]将指孢囊菌RH1脯氨酸-4-羟化酶基因置于一个强启动子的调控下,导入大肠杆菌中,在发酵罐中发酵100 h后,反式-4-羟脯氨酸的积累量达到41 g/L。Shibasaki等[11]将脯氨酸代谢关键酶基因导入到反式-4-羟脯氨酸生产菌中,在以葡萄糖为底物的培养基中培养96 h后,反式-4-羟脯氨酸产量达到25 g/L。
为了进一步提高脯氨酸4-羟化酶的表达量和反式-4-羟脯氨酸产量,可利用终止强度更大的终止密码子TAAT代替常用的终止密码子TAA或者TAG[12],改变密码子偏好性[13],降低5′端GC百分比[14],降低mRAN二级结构,优化发酵条件和补料策略[15]。本文的主要目的是通过优化脯氨酸-4-羟化酶基因的表达以及大肠杆菌发酵补料策略,促进脯氨酸4-羟化酶的表达和反式-4-羟脯氨酸的积累。
1 材料与方法
1.1 菌株和质粒
所有的DNA序列由上海旭冠公司合成。T4 DNA连接酶和限制性内切酶均购自TaKaRa公司。所用菌株和质粒见表1,其中质粒pAMP由pUC19质粒构建而成。

表1 菌株与质粒
1.2 脯氨酸-4-羟化酶基因的优化
脯氨酸-4-羟化酶基因序列来源于GenBank(登录号BAA20094.1)。由于大肠杆菌与脯氨酸-4-羟化酶基因的来源菌指孢囊菌[9]的密码子偏好性差异较大,为了使脯氨酸-4-羟化酶在大肠杆菌中得到高表达,首先通过同义转换调整密码子偏好性,将脯氨酸-4-羟化酶基因的低使用率密码子替换为在大肠杆菌中使用频率高的密码子,并调整脯氨酸-4-羟化酶基因的GC百分比,使得最终的脯氨酸-4-羟化酶基因GC百分比接近大肠杆菌GC百分比。为了便于基因克隆和操作,通过同义转化消除脯氨酸-4-羟化酶基因的酶切位点。最后,利用RNAstructure 5.3软件预测脯氨酸-4-羟化酶基因mRNA二级结构,并计算出mRNA二级结构的自由能ΔG,并通过调整脯氨酸-4-羟化酶基因的mRNA二级结构,使得脯氨酸-4-羟化酶基因mRNA的5′端避免形成二级结构,最终使脯氨酸-4-羟化酶基因得到优化。
1.3 重组质粒的构建
为了高效表达脯氨酸-4-羟化酶基因,引入强启动子-色氨酸串联启动子,色氨酸串联启动子(图1)由色氨酸和色氨酸结构类似物调控,当发酵液中缺少色氨酸时,色氨酸串联启动子控制脯氨酸-4-羟化酶基因的表达。

图1 色氨酸串联启动子序列Fig.1 Tryptophan tandem promoter sequence
优化后的脯氨酸-4-羟化酶基因和色氨酸串联启动子序列由上海旭冠公司合成。为了便于基因操作,在优化后的脯氨酸-4-羟化酶基因5′和3′端分别加入HindⅢ和BamHⅠ酶切位点,在色氨酸串联启动子基因5′和3′端分别加入EcoRⅠ和HindⅢ酶切位点,将合成好的脯氨酸-4-羟化酶基因连接到pAMP质粒上,构建重组质粒PAMP-Hyp;然后将合成后的色氨酸串联启动子基因经EcoRⅠ和HindⅢ双酶切后,连接到经同样酶双酶切后的pAMP-Hyp质粒上,构建重组质粒pAMP-ptrp2-Hyp。将重组质粒pAMP-ptrp2-Hyp经EcoRⅠ和BamHⅠ双酶切后,获得含有优化后的脯氨酸-4-羟化酶基因和色氨酸串联启动子基因片段,将该片段连接到pUC19质粒上,构建重组质粒。重组质粒pUC19- ptrp2-Hyp的构建过程如图2所示。

图2 pUC19-ptrp2-Hyp重组质粒的构建Fig.2 Construction of expression vector pUC19-ptrp2-Hyp
1.4 重组大肠杆菌的构建
将构建好的重组质粒pUC19- ptrp2-Hyp转化至感受态大肠杆菌BL21(DE3)中,并涂布在相应的抗性平板上,于37 ℃培养箱中培养10 h,待长出单菌落后,挑取单菌落,提取质粒,酶切验证。
重组大肠杆菌,在脯氨酸-4-羟化酶基因强启动子的控制下表达,在细胞内将L-脯氨酸和2-酮戊二酸分别转化为反式-4-羟脯氨酸和琥珀酸,其中,2-酮戊二酸由葡萄糖经糖酵解途径和三羧酸循环(TCA)途径代谢获得。
1.5 摇瓶发酵生产反式-4-羟脯氨酸
重组大肠杆菌经稀释后涂布于含50 μg/mL氨苄青霉素LB平板中,于37 ℃培养24 h后,挑取单菌落,接种到30 mL(250 mL摇瓶)LB培养基中,220 r/min、37 ℃培养8 h后,按6%的接种量接种到30 mL(250 mL摇瓶)发酵培养基中,220 r/min、35 ℃培养8 h。发酵培养基为葡萄糖10 g/L,甘油5 g/L,胰蛋白胨8 g/L,(NH4)2SO45 g/L,K2HPO41 g/L,NaCl 2 g/L,MgSO40.2 g/L,FeSO43 mmol/L,CaCl20.015 g/L,脯氨酸200 mmol/L。
1.6 脯氨酸-4-羟化酶全细胞活性测定[9]
发酵液离心后,称取湿菌体质量,然后用酶反应缓冲液将细胞冲洗悬浮后,在35 ℃摇床中200 r/min培养10 min,然后在沸水中加热2 min,灭活菌体,终止酶反应,测定反式-4-羟脯氨酸浓度,反式-4-羟脯氨酸测定采用氯胺T法[16]。
1.7 补料分批发酵生产反式-4-羟脯氨酸
将保藏于-80 ℃冰箱的菌种涂布于含50 μg/mL氨苄青霉素的LB平板上,37 ℃培养24 h后,从平板上挑取单菌落,接种至装有30 mL LB培养基的250 mL三角摇瓶中,37 ℃、220 r/min摇床培养8~8.5 h后,将种子按6%的接种量接种于的7 L BioFlo 415发酵罐中,装液量4 L,发酵温度35 ℃,用质量分数为30%的氨水控制pH为6.5以上,通气量为1~3 vvm(1个vvm表示每分钟通气量与罐体实际料液体积的比值),搅拌转速为400~900 r/min。在发酵过程中,通过调节通气量和搅拌转速,使得发酵罐溶氧水平维持在40%以上,以残糖的耗尽为标志开始补加质量分数40%葡萄糖,此时开始采用不同的流加速率开始补料。发酵培养基为葡萄糖10 g/L,甘油5 g/L,胰蛋白胨8 g/L,(NH4)2SO45 g/L,K2HPO41 g/L,NaCl 2 g/L,MgSO40.2 g/L,FeSO43 mmol/L,CaCl20.015 g/L,L-脯氨酸400 mmol/L。
1.8 菌体浓度和葡萄糖、反式-4-羟脯氨酸的测定
分光光度计测定发酵液A600值,根据实验数据拟合细胞干质量DCW(g/L)和菌液A600值的回归方程为DCW=0.54A600。发酵液葡萄糖采用SBA-40 C型生物传感分析仪测定(山东省科学院生物研究所),反式-4-羟脯氨酸的测定方法采用氯胺T法[16]。
2 结果与讨论
2.1 脯氨酸-4-羟化酶基因的优化设计和合成
脯氨酸-4-羟化酶基因序列的密码子使用频率分析由数据库完成(http://www.kazusa.or.jp/codon),分析结果显示:来源于指孢囊菌的初始脯氨酸-4-羟化酶基因部分密码子在大肠杆菌中的使用频率很低,如CAC(His)、CUC(Leu)、CGG(Arg)、UCG(Ser)、GUC(Val),这些密码子的使用频率均低于15%,而且,这些低频密码子以集群形式分布在脯氨酸-4-羟化酶mRNA上,会进一步影响大肠杆菌蛋白的表达[17]。同时,初始脯氨酸-4-羟化酶基因的GC百分比高达73.62%,远高于大肠杆菌基因GC百分比。
具体的优化过程如表2所述。第一步,根据大肠杆菌的密码子偏好性,利用密码子优化软件JCAT[18],通过同义转换,将来源于指孢囊菌的脯氨酸-4-羟化酶基因中的低频密码子替换为大肠杆菌高表达基因密码子,同时,调整脯氨酸-4-羟化酶基因的GC百分比,使得4-羟化酶基因的GC百分比接近大肠杆菌,该步骤改变了141个核苷酸,同时GC百分比也从73.62%降到了59.46%,更接近大肠杆菌高表达基因的GC百分比。第二步,为了便于基因工程操作,通过同义转化消除脯氨酸-4-羟化酶基因的EcoRⅠ酶切位点。第三步,利用RNA折叠分析软件5.3预测脯氨酸-4-羟化酶基因的mRNA二级结构,mRNA折叠自由能,通过改变同义密码子调整mRNA的5′端结构,使得脯氨酸-4-羟化酶基因的mRNA的5′端避免形成二级结构,如图3所示,优化之前的mRNA折叠能ΔG为-1 281.6 kJ/mol,优化后的mRNA折叠能ΔG为-1 202.5 kJ/mol,优化后的脯氨酸-4-羟化酶基因的mRNA保证AUG起始密码子后及其后的几个碱基组成的密码子翻译口袋呈打开状态,降低核糖体结合到mRNA上的能势,使得核糖体能够顺利地沿着起始密码子向后翻译,最终脯氨酸-4-羟化酶基因序列得到优化。由于在优化过程中后一优化步骤对前一优化步骤的调整,最终的密码子数/核苷酸数改变并不是前面三步优化的累加。
与野生型脯氨酸-4-羟化酶基因序列比较,优化后的脯氨酸-4-羟化酶基因共改变了137个密码子和139个核苷酸,同时,GC百分比从73.62%降低到59.27%,更接近大肠杆菌高表达基因的GC百分比含量,优化后的脯氨酸-4-羟化酶基因如图4所示。
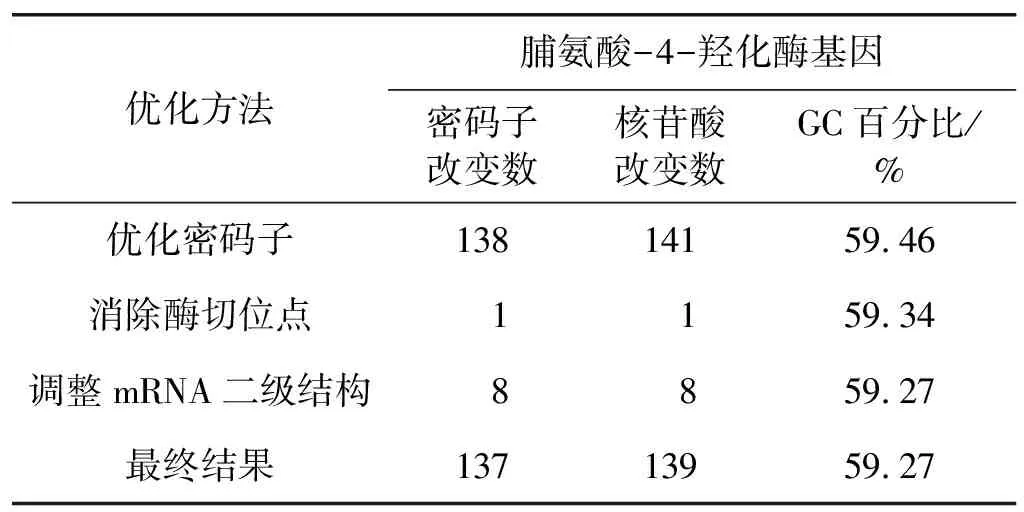
表2 密码子优化过程

A—调整之前的序列;B—调整之后的序列图3 脯氨酸-4-羟化酶mRNA二级结构预测结果Fig.3 Native gene mRNA secondary structure and adjusted gene mRNA secondary structure was predicted by software

图4 野生型脯氨酸-4-羟化酶基因(上)与优化后的脯氨酸-4-羟化酶基因(下)的序列比对Fig.4 Alignment of nucleotide sequences between wild-type gene(upper) and synthetic optimized (lower), changed base are indicated
2.2 脯氨酸-4-羟化酶在大肠杆菌中的表达
将重组质粒pAMP-ptrp2-Hyp经EcoRⅠ和BamHⅠ双酶切后,其中较小的条带为色氨酸串联启动子和脯氨酸-4-羟化酶基因序列,双酶切后最终形成1 850和1 063 bp 2条条带,如图5所示。经DNA测序,序列完全正确。
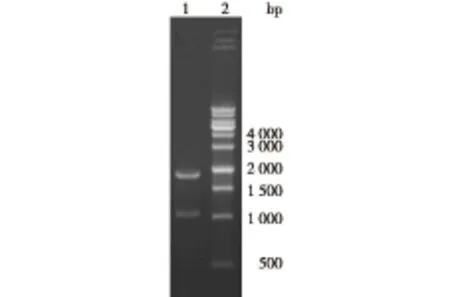
1—pAMP-ptrp2-Hyp双酶切;2—1 kb ladder marker M1181图5 pAMP-ptrp2-Hyp双酶切 Fig.5 Double digestion of pAMP-ptrp2-Hyp
由于pAMP质粒上酶切位点少,不便于外源基因的引入,因此最终选择实验室常用的质粒pUC19作为脯氨酸-4-羟化酶的表达质粒,将优化后的脯氨酸-4-羟化酶基因和色氨酸串联启动子序列经双酶
切后,连接到pUC19质粒上,构建重组质粒pUC19-ptrp2-Hyp,然后将重组质粒pUC19-ptrp2-Hyp转化到大肠杆菌BL21(DE3)中,构建重组菌,经摇瓶发酵,重组菌BL21(DE3)/pUC19-ptrp2-Hyp的反式-4-羟脯氨酸产量和全细胞酶活如表3所示,重组菌BL21(DE3)/pUC19-ptrp2-Hyp的反式-4-羟脯氨酸产量高达(0.492±0.034) g/L,同时,全细胞活性达到(0.75±0.08) U/g。
2.3 重组大肠杆菌发酵罐补料分批发酵生产反式-4-羟脯氨酸
摇瓶培养过程中无法控制pH和溶氧值,而且摇瓶发酵容易导致供氧不足,很难达到高密度发酵。提高反式-4-羟脯氨酸的产量和L-脯氨酸的转化率,必须通过重组大肠杆菌的高密度发酵来实现,因此,研究重组大肠杆菌在发酵罐补料分批发酵中的生长特性和产酸情况是必经之路。反式-4-羟脯氨酸发酵中,残余的C源过多会导致大肠杆菌代谢副产物增多,乙酸过量积累,最终使得发酵提前结束;而当C源不足时,细胞生长速度过慢,同样会导致4-反式-4-羟脯氨酸产量下降。因此,选择合适的补料策略至关重要。匀速流加补料策略广泛应用于各种表达系统,与其他补料策略相比,匀速流加补料策略操作方便简单,易于控制。匀速流加发酵对降低底物抑制、提高细胞生物量和目的产物产量等具有重要的作用。

表3 重组菌BL21(DE3)/pUC19-ptrp2-Hyp的反式-4-羟脯氨酸产量和全细胞脯氨酸-4-羟化酶活性
注:a—将 1个单位酶活定义为1 min将1 nmol脯氨酸完全转化为反式-4-羟脯氨酸的酶量,单位为U;脯氨酸-4-羟化酶全细胞 活性是单位体积发酵液1 g干细胞的酶活,单位为U/g。
按照1.7的方法进行补料分批发酵,采用连续补料流加,并考察不同的葡萄糖流加速度对反式-4-羟脯氨酸产量的影响,3个不同的连续流加速率分别为12、18和24 g/h,发酵结果如图6所示。

图6 重组大肠杆菌在不同的匀速补糖速率下的菌体浓度、 残糖和反式-4-羟脯氨酸产量的变化Fig.6 The cell concentration,glucose concentration and trans-4-hydroxyproline concentration curves of recombinant E.coli in fed-batch cultures by constant rate feeding strategy
由图6可知:当葡萄糖以24 g/h的速率匀速流加时,残糖在16 h后开始过量积累,20 h时残糖质量浓度达到1 g/L,在培养48 h后发酵结束,残糖质量浓度高达5.08 g/L。由于残糖过量积累,可能导致代谢抑制物和乙酸的积累,从而影响反式-4-羟脯氨酸的积累,最终的菌体A600和反式-4-羟脯氨酸的产量分别为38.2和27.0 g/L。当以12 g/h的速率匀速流加葡萄糖时,发酵液中残糖浓度一直维持在0~0.1 g/L之间,直至发酵结束,然而,与以24 g/h的速率匀速流加葡萄糖液相比,补糖速率为12 g/h时的最大细胞浓度A600只能达到31.83,而且反式-4-羟脯氨酸的产量也明显降低。由此可知,当发酵液中的残留葡萄糖一直维持在很低的水平时(<0.1 g/L),虽然并未抑制细菌的生长,但是葡萄糖是重组大肠杆菌生产必须的C源和能源物质,葡萄糖的供给不足,导致细胞代谢生长受限,使得反式-4-羟脯氨酸的产量急剧下降,最终反式-4-羟脯氨酸积累量不足18 g/L。
当以18 g/L的恒定补糖速率培养时,发酵液中的葡萄糖质量浓度维持在0.1~0.3 g/L之间,与前2组比较,该组的细胞浓度和反式-4-羟脯氨酸产量均达到最大值,反式-4-羟脯氨酸产量高达42.5 g/L,产酸速率达到0.966 g/(L·h),比目前国际最高水平高125%[9]。同时,L-脯氨酸的转化率达到81.1%,最终的产酸量比目前的最高水平高1.5 g/L[10]。当以18 g/L的恒定补糖速率培养时,残糖未过量积累,代谢副产物可得到有效控制。
然而,在发酵过程中,发酵后期的溶氧一直维持在10%以下,使得重组菌生长缓慢,脯氨酸-4-羟化酶的表达量下降,最终影响产酸,因此,通过提高发酵液中的溶解氧,是提高产率最直接的方法。在大规模生产中,提高搅拌转速、维持较高的罐压和提高通气量均可获得较高的溶氧,然而这些改进均需要消耗大量的能源和电力,不利于生产成本的控制。有研究报道通过在菌种中引入血红蛋白基因,可有效解决供氧不足的问题,在提高菌体比生长速率的同时,产物产量也得到提高[19-20],后期的研究中,可考虑在分子水平上引入透明颤菌血红蛋白基因,提高氧气利用率并促进脯氨酸-4-羟化酶的表达。
3 结 论
利用色氨酸串联启动子控制脯氨酸-4-羟化酶基因的表达,在以葡萄糖为C源,L-脯氨酸为底物的发酵培养基中,采用匀速补糖策略,最终的反式-4-羟脯氨酸产量达到42.5 g/L,反式-4-羟脯氨酸产酸速率高达0.966 g/(L·h),产酸速率比目前国际最高水平高125%。
[1] Remuzon P.Trans-4-hydroxy-L-proline,a useful and versatile chiral starting block[J].Tetrahedron,1996,52(44):13803-13835.
[2] Trost B M,Brindle C S.The direct catalytic asymmetric aldol reaction[J].Chem Soc Rev,2010,39(5):1600-1632.
[3] Wu G,Bazer F W,Burghardt R C,et al.Proline and hydroxyproline metabolism:implications for animal and human nutrition[J].Amino Acids,2011,40(4):1053-1063.
[4] Phang J M,Donald S P,Pandhare J,et al.The metabolism of proline,a stress substrate,modulates carcinogenic pathways[J].Amino Acids,2008,35(4):681-690.
[5] 张自强,赵东旭,杨新林.羟脯氨酸的研究与开发[J].氨基酸和生物资源,2006,28(1):55-58.
[6] Jurczak J,Prokopowicz P.Highly stereoselective synthesis ofcis-(2R,3S)-3-hydroxyproline[J].Tetrahedron Lett,1993,34(44):7107-7110.
[7] Katz E,Prockop D J,Undenfriend S.Precursors of the hydroxyproline and ketoproline in actinomycin[J].J Biol Chem,1962,237(6):1585-1588.
[8] Katz E,Kamal F,Mason K.Biosynthesis oftrans-4-hydroxy-L-proline byStreptomycesgriseoviridus[J].J Biol Chem,1979,254(14):6684-6690.
[9] Shibasaki T,Mori H,Chiba S,et al.Microbial proline 4-hydroxylase screening and gene cloning[J].Appl Environ Microbiol,1999,65(9):4028-4031.
[10] Shibasaki T,Mori H,Ozaki A.Enzymatic production oftrans-4-hydroxy-L-proline by regio- and stereospecific hydroxylation ofL-proline[J].Biosci Biotechnol Biochem,2000,64(4):746-750.
[11] Shibasaki T,Hashimoto S,Mori H,et al.Construction of a novel hydroxyproline-producing recombinantEscherichiacoliby introducing a proline 4-hydroxylase gene[J].J Biosci Bioeng,2000,90(5):522-525.
[12] Poole E S,Brown C M,Tate W P.The identity of the base following the stop codon determines the efficiency of in vivo translational termination inEscherichiacoli[J].EMBO J,1995,14(1):151-158.
[13] Brinkmann U,Mattes R E,Buckel P.High-level expression of recombinant genes inEscherichiacoliis dependent on the availability of thednaY gene product[J].Gene,1989,85(1):109-114.
[14] Pedersen-Lane J,Maley G F,Chu E,et al.High-level expression of human thymidylate synthase[J].Protein Expression Purif,1997,10(2):256-262.
[15] Yohannes E,Barnhart D M,Slonczewski J L.pH-dependent catabolic protein expression during anaerobic growth ofEscherichiacoliK-12[J].J Bacteriol,2004,186(1):192-199.
[16] Kesava Reddy G,Enwemeka C S.A simplified method for the analysis of hydroxyproline in biological tissues[J].Clin Biochem,1996,29(3):225-229.
[17] Kim S,Lee S B.Rare codon clusters at 5′-end influence heterologous expression of archaeal gene inEscherichiacoli[J].Protein Expression Purif,2006,50(1):49-57.
[18] Grote A,Hiller K,Scheer M,et al.JCat:a novel tool to adapt codon usage of a target gene to its potential expression host[J].Nucleic Acids R,2005,33(S2):W526-W531.
[19] Urgun-Demirtas M,Pagilla K R,Stark B C,et al.Biodegradation of 2-chlorobenzoate by recombinantBurkholderiacepaciaexpressingVitreoscillahemoglobin under variable levels of oxygen availability[J].Biodegradation,2003,14(5):357-365.
[20] Sanny T,Arnaldos M,Kunkel S A,et al.Engineering of ethanolicE.coliwith theVitreoscillahemoglobin gene enhances ethanol production from both glucose and xylose[J].Appl Microbiol Biotechnol,2010,88(5):1103-1112.
(责任编辑 管 珺)
Expression of codon-optimized proline-4-hydroxylase inEscherichia coli and its effect on trans-4-hydroxyproline biosynthesis
LIU Hedong,YUAN Chunwei,ZHANG Zhenyu
(Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
To improve expression of proline 4-hydroxylase inEscherichiacoli,the DNA sequence encoding proline 4-hydroxylase was adjusted based on the codon bias ofE.coliand the mRNA secondary structure.The optimized proline-4-hydroxylase gene was overexpressed inE.coliBL21(DE3) under a tryptophan tandem promoter in pUC19 vector.In shaking flask culture,trans-4-hydroxyproline was accumulated to (0.492±0.034) g/L in 8 h withL-proline as substrate.For an enhancedtrans-4-hydroxyproline production byE.coliBL21(DE3),the effect of constant feeding strategy ontrans-4-hydroxyproline production in a fermentor was studied.With constant feeding rate at 18 g/h,a maximumtrans-4-hydroxyproline titer of 42.5 g/L with a hightrans-4-hydroxyproline productivity (0.966 g/(L·h)) was achieved.
recombinantEscherichiacoli;proline-4-hydroxylase;trans-4-hydroxyproline;codon optimization;fermentation;optimization
10.3969/j.issn.1672-3678.2014.06.009
2013-04-17
国家自然科学基金(30800018、30970058);高等学校博士学科点专项科研基金(200802951036);工业生物技术教育部重点实验室主任基金(KLIB-ZR200801);江苏省自然科学基金(BK2012554)
刘合栋(1987—),男,湖北黄石人,硕士研究生,研究方向:基因工程育种、发酵工程;张震宇(联系人),教授,E-mail:zhangzy@jiangnan.edu.cn
Q786
A
1672-3678(2014)06-0044-08
