尼罗红荧光法快速检测培养过程中湛江等鞭金藻的中性脂
2014-02-08王海涛刘亚男曹旭鹏王伟良
王海涛,刘亚男,曹旭鹏,薛 松,王伟良
(1.中国科学院大连化学物理研究所海洋生物工程研究组,大连116023;2.中国科学院大学,北京100049; 3.华东理工大学生物反应器工程国家重点实验室,上海200237)
尼罗红荧光法快速检测培养过程中湛江等鞭金藻的中性脂
王海涛1,2,刘亚男1,曹旭鹏1,薛 松1,王伟良3
(1.中国科学院大连化学物理研究所海洋生物工程研究组,大连116023;2.中国科学院大学,北京100049; 3.华东理工大学生物反应器工程国家重点实验室,上海200237)
研究一种快速准确测定微藻中中性脂的方法。湛江等鞭金藻是一种中性脂含量高且具有开发潜力的能源微藻。以湛江等鞭金藻为实验对象,首先优化尼罗红染色的条件。当二甲基亚砜体积分数为2.0%、尼罗红质量浓度为1.00 μg/mL、细胞密度为1.0×106个/mL、激发波长为480 nm、检测波长为580 nm时,优化的染色时间为10 min。其次测定了背景荧光对检测的影响。结果表明,在不同细胞状态下,背景荧光强度大约是微藻内荧光强度的20%左右,可以忽略。最后比较了尼罗红荧光法和重量法。结果表明,荧光强度与中性脂含量的相关系数R2=0.946 8,虽然两者相关性并不十分高,但作为一种快速测定微藻中中性脂的方法,尼罗红荧光法依然是研究微藻培养过程中中性脂含量变化的有效方法。
尼罗红;中性脂;湛江等鞭金藻;生物柴油
微藻生物柴油是第三代生物柴油,研究微藻中中性脂的积累规律是降低微藻生物柴油生产成本、实现微藻生物柴油商业化的关键[1-3]。在微藻中性脂积累机制研究中,迫切需要一种能够准确快速并且样品用量少的检测方法来追踪中性脂的积累过程。质量法、高效液相色谱法和薄层层析-气相色谱法是测定微藻中中性脂常用的方法[4-6]。这些方法首先通过有机溶剂将中性脂萃取,然后再通过不同手段定量。为了保证测定的准确,在萃取过程中要保证将中性脂完全提取,与此同时还要保证提取过程中中性脂不被破坏[7];在定量过程中,质量法需要的样品量较多(约100 mg),以保证称量准确[8],色谱法样品用量少(约5 mg),但是需要特殊的设备[9-10](检测器、色谱柱等),操作也较为复杂。因此,这些方法不能用于微藻中性脂的快速检测[6,11]。
尼罗红是一种荧光染料,在疏水环境下可以激发出红色荧光。尼罗红荧光法测定微藻中中性脂含量以其样品用量少、检测快速等优点,广泛用于富油微藻的高通量筛选。在富油微藻高通量筛选中,尼罗红荧光法面临的主要问题是因部分微藻细胞壁太厚染料不能进入细胞,从而无法发挥作用。针对这个问题,人们作了较深入的研究。如采用微波、超声或二甲基亚砜(DMSO)处理细胞[6,11-12]。这种针对高通量筛选进行的优化,必然要考虑不同微藻的特点,特别是具有较厚细胞壁的微藻,将这种方法应用于无细胞壁的微藻固然可行,但是却不是这种微藻的最优条件(染色剂浓度、DMSO浓度等),而且一些处理步骤如微波处理等也是不必要的。因此建立针对特定微藻的尼罗红染色法是必需的。
湛江等鞭金藻(Isochrysiszhangjiangensis)是一种海洋微藻,属于金藻门,普林藻纲,等鞭藻目,等鞭藻科,在分类学地位上接近于球等鞭金藻(Isochrysisgalbana),无细胞壁,是一种理想的产油微藻[13]。笔者以湛江等鞭金藻为对象,系统地优化尼罗红染色的条件,包括检测波长的选择、细胞浓度与荧光强度的关系、DMSO用量、染色时间和尼罗红用量,并考察背景荧光对检测的影响,以期为建立其他无细胞壁微藻的尼罗红荧光法提供参考。
1 材料与方法
1.1 藻株与培养条件
湛江等鞭金藻(Isochrysiszhangjiangensis),由辽宁省海洋水产研究所提供,保存在中国科学院淡水藻种库(编号为FACHB-1750)。海水取自大连周边海域,砂滤后高压蒸气灭菌(110 ℃、15 min),冷却至室温后加入f/2培养基母液(不添加硅酸盐),NaNO3为f/2培养基浓度的6倍,其他成分与f/2培养基浓度相同。
1.2 细胞密度
采用分光光度法测定细胞密度,测定680 nm处光密度,根据吸光度与细胞密度关系获得细胞密度。
1.3 尼罗红荧光强度测定
荧光强度采用Cary Eclipse荧光分光光度计(安捷伦公司)检测,激发波长为480 nm,发射波长为580 nm。海水自荧光直接采用荧光分光光度计测定;向海水中加入终质量浓度为1.00 μg/mL的尼罗红和终体积分数为2.0%的DMSO,此时测定的荧光强度减去海水自荧光强度即为海水中尼罗红荧光强度;用海水将微藻样品稀释至细胞密度1.0×106个/mL左右,测定的荧光强度减去海水自荧光强度为微藻细胞自身荧光强度;用海水将微藻样品稀释至细胞密度为1.0×106个/mL左右,加入尼罗红染料使其终质量浓度为1.00 μg/mL,加入DMSO使其终体积分数为2.0%,避光染色10 min,此时测定的荧光强度为总荧光强度,总荧光强度减去微藻细胞自身荧光和海水自荧光即为微藻内尼罗红荧光强度。
1.4 质量法测定中性脂含量
他以为这样的盛世,会是一千年,一万年,他读书学武,游荡在街巷里,母亲在百花谷迎来送往,打情骂俏,达官贵人、三教九流在他们俩的小世界之外活色生香地活。三个月后,回望过去,我们不在其中,那也不过是一场做得有些长、又太过热烈的绮梦罢了,他们真的由梦里醒来了吗?胡子大叔、秀才哥哥,还有胖婶,你们掉在这个流言里,不愿醒来,是想搬去万花谷里继续做梦吧!
称取约100 mg冷冻干燥的藻粉,首先加入3.8 mL的氯仿-甲醇-蒸馏水(体积比为1∶ 2∶ 0.8),涡旋混合2 min,然后加入1 mL氯仿,涡旋混合0.5 min,最后加入1 mL蒸馏水,涡旋混合0.5 min。4 000 r/min离心5 min,弃去上层,下层在35 ℃下真空旋转蒸干,剩余物即为脂质[4]。将脂质用1 mL氯仿溶解,上样至固相萃取柱(Sep-Pak Vac 6cc 500 mg,Waters),用10 mL氯仿将中性脂洗脱,除去溶剂,剩余物即为中性脂[7]。
2 结果与讨论
2.1 激发波长和检测波长的选择
当环境极性下降时,尼罗红最大荧光发射波长会发生蓝移[14]。微藻中性脂包括甘油三酯、甘油二酯和甘油一酯等,其极性依次增强,所以尼罗红在甘油三酯、甘油二酯和甘油一酯中的最大荧光发射波长也不同,分别是580、620和630 nm[11]。不同微藻中这3种脂质的比例也不同,所以经过尼罗红染色后,它们的最大发射波长也不同。针对尼罗红的这种特性,首先应该确定尼罗红染色后的最大发射波长。笔者考察湛江等鞭金藻经尼罗红染色后的荧光发射光谱和尼罗红本身的荧光发射光谱,结果如图1所示。从图1可知,经尼罗红染色后的湛江等鞭金藻在500~800 nm内有2个特征峰,分别是580和680 nm。其中580 nm处的特征峰是尼罗红发出的荧光,680 nm处特征峰为叶绿素发出的荧光。而尼罗红自身在这2个波长处没有明显特征峰。因此,对于湛江等鞭金藻来讲,选择激发波长为480 nm,荧光检测波长为580 nm。这与其他报道中选取的激发和检测波长相同[14]。
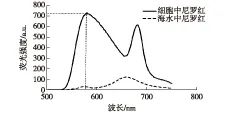
图1 细胞中和海水中尼罗红的荧光发射光谱Fig.1 Emission spectram of nile red in cells and sea water
2.2 细胞密度与荧光强度关系
考察细胞密度与荧光强度的关系,结果如图2所示。由图2可知:在细胞密度在4.0×105~1.5×106个/mL之间时,细胞密度与荧光强度线性相关;当细胞密度大于1.5×106个/mL时,荧光强度不再随细胞密度的增加而线性增加。这可能是由于细胞密度太高,出现了遮蔽效应,荧光强度与细胞密度之间的线性关系被打破,导致荧光强度不再随细胞密度增加而等比例增加。而当细胞密度小于4.0×105个/mL时,荧光强度并不等比例降低,这是由于细胞密度太低,背景荧光的影响增大所致。检测荧光时细胞密度不能过高也不能过低,因此确定最佳的细胞密度范围为4.0×105~1.5×106个/mL。这与文献[6]中报道的小球藻最佳细胞浓度相当。

图2 细胞密度与荧光强度的关系Fig.2 Relationship of cell density and relative fluorescence intensity
2.3 二甲基亚砜浓度对荧光强度的影响
DMSO可以协助尼罗红进入细胞,通过添加DMSO可以提高微藻染色后荧光强度。如在具有较厚细胞壁的小球藻和布朗葡萄藻中,添加20%左右DMSO后,荧光强度比未添加DMSO时提高了2~6倍[6,15-16]。在细胞密度在4.0×105~1.5×106个/mL之间时,考察DMSO浓度对荧光强度的影响,结果如图3所示。由图3可知:当DMSO体积分数小于2.0%时,荧光强度从0.8% DMSO时的350 a.u.增加到2.0% DMSO时的375 a.u.;当DMSO浓度大于2.0%时,继续增加DMSO浓度就会发生荧光淬灭,导致荧光强度下降,当DMSO浓度达到8.0%时,荧光强度下降到200 a.u.,只有2.0% DMSO时的53%。对于湛江等鞭金藻来讲,荧光强度随DMSO增加而缓慢升高,但幅度并不明显,这说明对于无细胞壁的湛江等鞭金藻来讲,由于染料较易穿透,DMSO对荧光强度的促进作用有限。在DMSO浓度为2.0%时荧光强度最大,继续提高DMSO浓度时荧光强度迅速下降。文献中报道的最佳DMSO浓度一般在20%左右[6],与之相比使湛江等鞭金藻达到最高荧光强度DMSO浓度很小,考虑到DMSO对染色的促进作用,确定2.0%是DMSO的最佳浓度。

图3 DMSO体积分数对荧光强度的影响Fig.3 Effects of DMSO volume ratio on relative fluorescence intensity
在2.0%DMSO体积分数下,考察0.25~2.00 μg/mL尼罗红质量浓度范围内荧光强度与尼罗红质量浓度的关系,结果如图4所示。由图4可知:当尼罗红质量浓度小于1.00 μg/mL时,荧光强度随染色剂浓度增加而增强;当尼罗红质量浓度达到1.00 μg/mL时,继续增加尼罗红质量浓度,荧光强度不再增加,因此最佳尼罗红质量浓度为1.00 μg/mL。
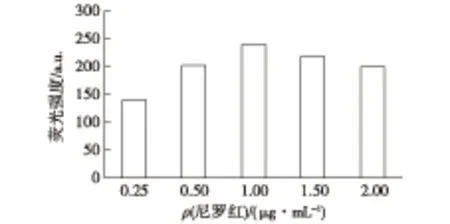
图4 尼罗红质量浓度对荧光强度的影响Fig.4 Effects of nile red concentration on relative fluorescence intensity
2.5 染色时间
在2.0%DMSO、1.00 μg/mL尼罗红浓度下,考察染色时间与荧光强度的关系,结果如图5所示。由图5可知:虽然5 min时荧光强度最高,达到370 a.u.,但是在10 min后荧光强度又略有下降;染色10 min后,荧光强度稳定在360 a.u.附近,不再随染色时间的延长而增加,因此选择10 min作为染色时间。这与文献[6]中的最佳染色时间相同。

图5 染色时间对荧光强度的影响Fig.5 Effects of staining time on relative fluorescence intensity
2.6 背景荧光的干扰
在使用荧光分光光度计定量中性脂时,应该考虑到与尼罗红浓度相关的背景荧光对测定的干扰。在某些情况下需要进行样品预处理,如通过离心或者过滤的方法去除背景荧光[17]。荧光分光光度计测得荧光包括4部分,分别是微藻细胞自身荧光、溶液中尼罗红荧光、溶液自身荧光和微藻内尼罗红荧光。微藻内尼罗红荧光与细胞中性脂含量相关,其他荧光属于背景荧光。不同培养时期细胞的状态不同,在适应期和对数生长期,细胞内中性脂含量较少,背景荧光可能会干扰结果;而在稳定期,细胞内中性脂含量较高,背景荧光的干扰相对较小。测定了适应期、对数生长期和稳定期的背景荧光,结果如表1所示。由表1可知:与细胞内荧光强度相比,背景荧光强度较小,最大只有微藻中尼罗红荧光强度的20%左右,并且强度基本稳定,不随细胞状态变化而变化,因此对于湛江等鞭金藻来讲,可以忽略背景荧光对测定的影响。
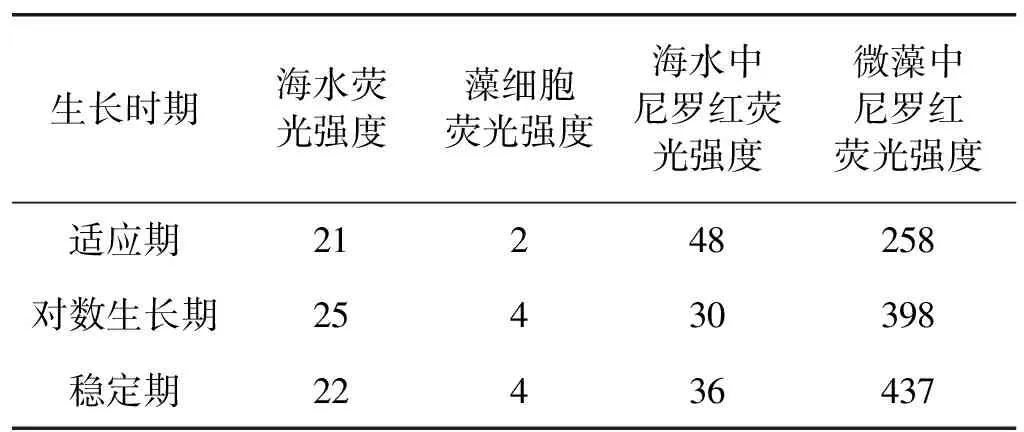
表1 不同培养阶段背景荧光强度
2.7 单位细胞荧光强度与中性脂含量的关系
采用批次培养方式,柱状管式反应器培养湛江等鞭金藻,生长曲线如图6所示。由图6可知:细胞在第4天开始进入稳定期。收集不同培养时间的细胞样品,采用优化的尼罗红染色法测定单位细胞荧光强度,同时采用质量法测定此时微藻中中性脂的含量。结果表明单位细胞荧光强度和中性脂含量相关性良好,相关系数为R2=0.946 8。这表明尼罗红染色法可以替代重量法测定微藻中中性脂含量。

图6 湛江等鞭金藻生长曲线Fig.6 Growth curve of I.zhangjiangensis
2.8 与其他微藻尼罗红染色法的比较
表2总结了文献中最优尼罗红染色的条件,从表2中可以看出,与湛江等鞭金藻相比,具有较厚细胞壁的微藻大都需要较高浓度的DMSO,大约是湛江等鞭金藻的7~15倍。从图3可以看出, DMSO浓度超过最佳浓度后,荧光强度随DMSO浓度增加迅速下降,这一现象进一步表明有细胞壁微藻尼罗红染色条件不适用于无细胞壁微藻。
不同微藻的最佳尼罗红浓度不同,但是相差并不悬殊,在0.3~1.5 μg/mL之间。研究背景荧光对测定干扰的报道不多,笔者系统地考察了不同培养阶段背景荧光对检测的影响,结果发现背景荧光强度保持恒定,并且与细胞内荧光强度相比较小,约是后者的1/5,因此可以将背景荧光忽略,以简化检测流程,提高检测效率。背景荧光主要来自溶液中的尼罗红,其强度与尼罗红浓度相关,不同微藻使用的尼罗红浓度相差不大,因此可以推测在检测其他微藻时,背景荧光也是可以忽略的。

表2 不同微藻尼罗红染色条件
不同微藻的中性脂成分不同,如布朗葡萄藻的中性脂主要是烃类化合物[20],因此尼罗红染色后不同微藻的最大荧光波长也不同。如在小球藻中选择激发波长为530 nm、发射波长为575 nm[6]。因此荧光检测波长要根据不同微藻进行选择。
尼罗红染色法测得的数据是相对荧光强度,要最终确定中性脂含量需要荧光强度与中性脂含量的相关关系。有研究采用甘油三酯作为标准品获取荧光强度与中性脂含量的关系,但是如前所述,尼罗红在不同中性脂中的最大荧光波长不同,因此采用这种方法会引入系统误差。本研究中,笔者通过测定不同中性脂含量的湛江等鞭金藻的荧光强度来获取荧光强度与中性脂含量的关系,这就消除了因尼罗红在不同中性脂中的最大荧光波长不同而引入的误差。这同时说明,不同微藻需要建立各自荧光强度与中性脂含量的关系。
不同微藻之间染色时间差异不明显,大都在10 min左右,这说明在DMSO的作用下,细胞壁不再是尼罗红进入细胞的障碍,尼罗红可以通过自由扩散进入细胞。
对于荧光检测来讲,如果细胞密度过高,则会引起遮蔽效应,此时荧光强度不再随细胞密度增加而线性增加。不同微藻的最佳检测浓度范围是不同的。对于湛江等鞭金藻,最佳细胞密度为4.0×105~1.5×106个/mL,这与Chen等[6]报道的小球藻最佳染色细胞密度相当,但比刘新颖等[15]报道的布朗葡萄藻细胞密度范围窄。这表明不同微藻最佳细胞密度范围不同。
3 结 论
以无细胞壁的湛江等鞭金藻为研究对象,优化了尼罗红染色法测定中性脂的方法,并与有细胞壁微藻的尼罗红染色法作比较。结果表明:最佳DMSO体积分数为2.0%,最佳尼罗红质量浓度为1.00 μg/mL,最佳染色时间为10 min,最佳检测细胞浓度为1.0×106个/mL,最佳激发波长为480 nm,检测波长为580 nm。同时测定了背景荧光对检测的影响。结果表明,在不同细胞状态下,背景荧光强度基本恒定,与微藻内荧光强度相比较弱,可以忽略。最后比较了尼罗红染色法和质量法,结果表明荧光强度与中性脂含量相关系数达到R2=0.946 8。与质量法相比,尼罗红染色法检测时间短,样品用量少。尼罗红染色法仅需要10 min即可完成测定,质量法则通常需要较长时间;尼罗红染色法仅需要几毫升细胞密度为1.0×106个/mL的样品,干质量大约是0.1 mg,而质量法则需要高达100 mg干藻粉,大约是尼罗红染色法所需样品量的1 000倍。尼罗红染色法是一种快速地检测微藻中中性脂含量的方法,可以用于快速检测培养过程中中性脂的变化过程。针对湛江等鞭金藻的尼罗红荧光法的优化过程,也为建立其他无细胞壁微藻的尼罗红荧光法提供了参考。
[1] Mata T M,Martins A A,Caetano N S.Microalgae for biodiesel production and other applications:a review[J].Renew Sust Energ Rev,2010,14(1):217-232.
[2] Hu Q,Sommerfeld M,Jarvis E,et al.Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J].Plant J,2008,54(4):621-639.
[3] Chisti Y.Biodiesel from microalgae[J].Biotechnol Adv,2007,25(3):294-306.
[4] Bligh E,Dyer W J.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37(8):911-917.
[5] Siaut M,Cuiné S,Cagnon C,et al.Oil accumulation in the model green algaChlamydomonasreinhardtii:characterization,variability between common laboratory strains and relationship with starch reserves[J].BMC Biotechnol,2011,11(1):7.doi:10.1186/1472-6750-11-7.
[6] Chen W,Zhang C,Song L,et al.A high throughput nile red method for quantitative measurement of neutral lipids in microalgae[J].J Microbiol Methods,2009,77(1):41-47.
[7] Ryckebosch E,Muylaert K,Foubert I.Optimization of an analytical procedure for extraction of lipids from microalgae[J].J Am Oil Chem Soc,2012,89(2):189-198.
[8] Fidalgo J P,Cid A,Torres E,et al.Effects of nitrogen source and growth phase on proximate biochemical composition,lipid classes and fatty acid profile of the marine microalgaIsochrysisgalbana[J].Aquaculture,1998,166(1/2):105-116.
[9] James G O,Hocart C H,Hillier W,et al.Fatty acid profiling ofChlamydomonasreinhardtiiunder nitrogen deprivation[J].Bioresour Technol,2011,102(3):3343-3351.
[10] Danielewicz M A,Anderson L A,Franz A K.Triacylglycerol profiling of marine microalgae by mass spectrometry[J].J Lipid Res,2011,52(11):2101-2108.
[11] Chen W,Sommerfeld M,Hu Q.Microwave-assisted nile red method for in vivo quantification of neutral lipids in microalgae[J].Bioresour Technol,2011,102(1):135-141.
[12] 张敬键,吕雪娟,李爱芬,等.微藻细胞油脂含量的快速检测方法[J].中国生物工程杂志,2012(1):64-72.
[13] Feng D,Chen Z,Xue S,et al.Increased lipid production of the marine oleaginous microalgaeIsochrysiszhangjiangensis(chrysophyta) by nitrogen supplement[J].Bioresource Technol,2011,102(12):6710-6716.
[14] Elsey D,Jameson D,Raleigh B,et al.Fluorescent measurement of microalgal neutral lipids[J].J Microbiol Methods,2007,68(3):639-642.
[15] 刘新颖,汪志平,于金鑫,等.布朗葡萄藻脂质含量的荧光光谱检测方法的改进[J].生物工程学报,2013(3):382-391.
[16] 王海英,符茹,黄宝祥.基于尼罗红荧光染色的小球藻脂质快速检测方法研究[J].中国油脂,2012(3):78-81.
[17] Cooksey K E,Guckert J B,Williams S A,et al.Fluorometric determination of the neutral lipid content of microalgal cells using nile red[J].J Microbiol Meth,1987,6(6):333-345.
[18] Doan T Y,Obbard J P.Improved nile red staining ofNannochloropsissp[J]. J Appl Phycol,2011,23(5):895-901.
[19] 杨勋,刘平怀,郝宗娣,等.富油微藻Monoraphidiumsp.的分离及其油脂提取工艺研究[J].安徽农业科学,2011(32):19988-19990.
[20] 胡章喜,安民,段舜山,等.不同氮源对布朗葡萄藻生长、总脂和总烃含量的影响[J].生态学报,2009(6):3288-3294.
(责任编辑 管 珺)
Nile red fluorescence method for rapid measurement of neutral lipids during thecultivation of the marine microalgae Isochrysis zhangjiangensis
WANG Haitao1,2,LIU Yanan1,CAO Xupeng1,XUE Song1,WANG Weiliang3
(1.Marine Bioengineering Group,Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China; 3.State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology,Shanghai 200237,China)
A rapid method for quantifying neutral lipids in microalgae is impending.The marine microalgaIsochrysiszhangjiangensis,an ideal candidate for producing biodiesel,was taken as a model system to establish the nile red florescence method.The optimal staining condition was 2.0% dimethyl sulfoxide (V/V),1.00 μg/mL nile red,1.0×106cell/mL cell density and staining for 10 min.The excitation and emission wavelength was 480 nm and 580 nm,respectively.Background fluorescence at different growth phase was measured and its intensity was only about 20% of the florescence intensity in cell.Compared with the fluorescence intensity in cell,the intensity of background florescence was weak and negligible.A correlation coefficient ofR2=0.946 8 was obtained between the fluorescence intensity of nile red and the neutral lipid content measured by conventional gravimetric method.Although the correlation coefficient was not perfect,nile red method is useful in determining neutral lipid content during microalga cultivation.
nile red; neutral lipid;Isochrysiszhangjiangensis; biodiesel
10.3969/j.issn.1672-3678.2014.06.015
2013-11-14
国家重点基础研究发展计划(973计划)(2011CB200903);国家高技术研究发展计划(863计划)(2012AA052101);辽宁省自然科学基金(2012010263);中国科学院“百人计划”(A1097)
王海涛(1988—),男,山东聊城人,博士研究生,研究方向:微藻生物能源;薛 松(联系人),研究员,E-mail:xuesong@dicp.ac.cn
Q93.333
A
1672-3678(2014)06-0078-06
