exosomes在肺癌细胞对顺铂敏感性降低过程中的作用研究
2014-02-08肖霞缪建华李树春吴建中于韶荣冯继锋
肖霞 缪建华 李树春 吴建中 于韶荣 冯继锋
肺癌是全球发病率和死亡率最高的恶性肿瘤之一。几十年来顺铂作为肺癌化疗的基础药物,在肺癌治疗中占有举足轻重的地位。尽管如此,仍然有很多初始化疗有效的患者经过一段时间的治疗后出现了对顺铂敏感性降低的现象。而影响患者对顺铂敏感性的因素有很多,包括癌细胞内顺铂的蓄积含量[1-3]、解毒能力[4]以及DNA的修复功能[5]等,同时,肿瘤微环境的改变也是其重要的影响因素。
在肿瘤微环境下细胞间的作用方式有很多种,目前,一种膜性微囊泡exosomes(即外分泌体)在细胞信息传递中的作用逐渐受到重视[6]。exosomes是直径为30~100 nm的内吞来源的膜性囊泡[7],由多种细胞分泌并存在于多种体液中,研究表明exosomes中含有大量的microRNAs,mRNAs和蛋白质等物质,并且细胞可以通过胞吞作用内化微环境中的exosomes,exosomes进入受体细胞后释放出其所携带的包括miRNA、mRNA在内的遗传信息引起受体细胞的生物学反应,因此exosomes被认为是一种参与细胞间信息交流的载体[8]。同时,不同细胞分泌的exosomes具有不同的特性及生物学功能,同种细胞在不同环境下分泌的exosomes也具有不同的特性及生物学功能。而exosomes生物学功能的差异主要取决于其表面携带的相关分子及内部装载的信息。如果携带的信息与增殖有关,那么exosomes可在进入受体细胞后调节其下游通路,影响细胞的增殖[9-10];如果携带的信息与血管生成调节有关,那么exosomes在进入受体细胞后可影响其血管形成[11];如果携带的信息与转移和侵袭有关,那么exosomes在进入细胞后可影响其侵袭性[12-13]。研究发现前列腺癌细胞来源的exosomes可能参与前列腺肿瘤细胞对多西他赛的耐药形成[14]。
本研究以肺癌A549和H1975细胞为模型,探讨顺铂处理后肺癌细胞来源的exosomes对同源细胞的顺铂敏感性的影响,为顺铂敏感性调节机制提供一条新的思路,也为提高肺癌细胞对顺铂的敏感性提供一种新的方法。
1 材料与方法
1.1 细胞培养人肺腺癌细胞株A549和H1975均购自中国科学院上海细胞生物学研究所,生长于含有10%灭活胎牛血清(Hyclone,美国)的含双抗的RPMI 1640(凯基生物,南京)培养液中,于37℃、5%CO2、85%湿度的恒温箱内培养,0.25%胰酶(Gibico,美国)消化液消化传代。所有实验均采用对数生长期细胞。1.2exosomes的制备、电镜观察和蛋白检测肺腺癌细胞A549和H1975培养48 h后收集细胞上清液用于exosomes的制备。首先,收集的上清液通过一系列离心去除细胞及碎片:1000 g×10 min、10 000 g×30 min 4℃、100 000 g×2 h 4℃(Beckman 70 Ti rotor,美国),取浓缩液,然后加入exoquick-TC(System Biosciences,Mountain View,美国),经1500 g×30 min 4℃离心获取的沉淀即为exosomes。用PBS重悬后置于-80℃保存。
将exosomes稀释后取20 μl滴加于铜网上,晾干后即在透射电镜(TEM,JEM-2100,JEOL,日本)下观察。
取exosomes用裂解液裂解后加入1×上样缓冲液,100℃煮沸5 min,加样于上样孔内,浓缩胶80 V,30 min,分离胶100 V,90 min。然后转膜250 mA,60 min,室温封闭后,一抗采用兔抗鼠CD63(System Biosciences,Mountain View,Calif),4℃过夜。二抗采用辣根过氧化物酶标记的羊抗兔抗体(System Biosciences,Mountain View,美国),室温孵育2 h,用ECL显色试剂盒(Peirce)于成像仪(Bio-Rad)中显色。
1.3 荧光显微镜观察细胞胞吞exosomes的过程将提取的exosomes用PBS稀释后,取DiD染料(Biotium,美国)2 μl,加入1 ml稀释后的exosome重悬液中室温孵育0.5 h,再以20,000 g×30 min,4℃离心后取上清,滤器(0.22 μm,millipore,美国)过滤,以每孔取液40 μl,加入60 μl PBS混匀后加入六孔板中,培养3 h后用共聚焦显微镜观察exosomes是否进入细胞中。
1.4 CCK-8检测细胞存活率取对数生长期A549细胞接种于96孔板中(6×103个/孔),24 h贴壁后加入顺铂(浓度分别为0、1、2、3、4、5、6、7、8、9、10 μg/ml),培养48 h。每孔加入10 μl CCK-8(Dojindo,Kumamoto,日本)和90 μl不完全培养基的混合液,0.5 h后,用酶标仪测450 nm波长下的光密度值。检测H1975细胞存活率的方法同上。
同样,取对数生长期A549细胞接种于96孔板中(6×103个/孔),24 h贴壁后将培养液换成不含exosomes的培养液,NOR EXO组以未经顺铂处理的A549细胞来源的exosomes预处理细胞,DDP EXO组以经顺铂处理的A549细胞来源的exosomes预处理细胞,而PBS组以等量的PBS预处理细胞,3 h后对3组的细胞以3 μg/ml的顺铂处理,48 h后每孔加入10 μl CCK-8和90 μl不完全培养基的混合液,0.5 h后,用酶标仪测450 nm波长下的光密度值。检测H1975细胞存活率的方法同上。
1.5 统计学方法使用SPSS 18.0统计软件处理数据,结果以¯x±s表示,组间的比较采用单因素方差(one-way ANOVA)分析。P<0.05为差异具有统计学意义。
2 结果
2.1 exosomes的形态学特征和蛋白表达通过不同梯度的超速离心和exoquick-TC,从肺癌A549细胞的上清液中分离出肿瘤来源的exosomes,然后通过透射电镜对其形态进行了观察。如图1A所示,exosomes具有特征性的盘状结构,直径30~100 nm。
之前的研究表明CD63为exosomes表达的特异性高表达蛋白,为了进一步验证我们所提的囊泡为exosomes,而不是其他如凋亡小体、微囊泡等细胞分泌物,我们检测了所提样品的CD63蛋白的表达,如图1B所示:与细胞相比,exosomes中富含CD63蛋白。
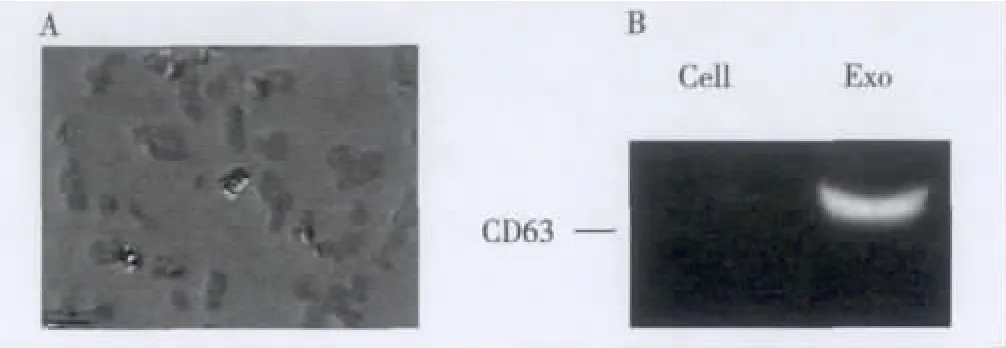
图1 exosomes的鉴定
2.2 exosomes被细胞吞入的观察将exosomes和细胞共培养,通过共聚焦显微镜对细胞进行观察。如图2所示,培养液中大部分exosomes可在3 h内被细胞胞吞。

图2 荧光显微镜下观察exosomes被细胞胞吞
2.3 exosomes对肺癌细胞的顺铂敏感性的影响不同浓度的顺铂分别处理A549细胞和H1975细胞48 h后,与对照组比较,顺铂对这2种细胞的生长都有抑制作用,且呈浓度依赖性。3 μg/ml的顺铂处理组2种细胞的生存率都接近50%(图3)。分别用未经顺铂处理和经顺铂处理的A549细胞和H1975细胞来源的exosomes对细胞进行预处理,见图4。与对照组相比,未经顺铂处理的A549细胞来源的exosomes对细胞的顺铂敏感性没有影响,而将顺铂处理的A549细胞来源的exosomes预处理A549细胞后,细胞的存活率提高了大约24%;同样的,与对照组相比,未经顺铂处理的H1975细胞来源的exosomes对细胞的顺铂敏感性没有影响,而将经顺铂处理过H1975细胞来源的exosomes预处理细胞后,细胞的存活率提高了大约15%。
3 讨论
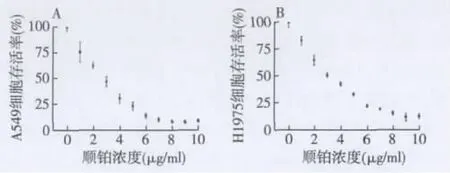
图3 不同浓度的顺铂处理48 h后肺癌细胞的存活率
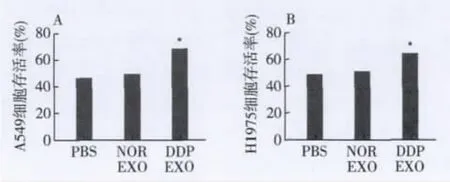
图4 顺铂处理的肺癌细胞来源的exosomes降低细胞对顺铂的敏感性
在顺铂处理下,肺癌细胞周围的微环境发生了变化,细胞作出了相应的变化来适应周边的环境,DNA损伤修复系统和各种通路被激活,细胞存活率发生了改变,在浓度为3 μg/ml的顺铂刺激下,接近50%的肺癌细胞(A549细胞和H1975细胞)内的DNA损伤修复系统在被激活后,细胞内的核苷酸损伤仍然不能修复,细胞不能顺利进入完整的细胞周期,遗传信息不能进行复制,细胞不能正常地进行分裂,随即,细胞进入了凋亡或死亡程序。而其他细胞则通过修复等一系列通路的调整顺利地存活下来了,其分泌的exosomes将释放至细胞外并通过旁分泌方式传递到周围同源细胞,被邻近细胞以胞吞方式吞入,exosomes内包裹的RNA和蛋白被释放,通过调节下游通路从而影响受体细胞的生物学功能,受体细胞作出了相应的改变,致使细胞对顺铂敏感性降低,当再次用顺铂处理细胞时,顺铂对细胞的抑制率显著降低。在本实验中,3 μg/ml的顺铂组肺癌细胞系A549和H1975的生存率都接近50%,由于对exosomes预处理,这个浓度下的细胞存活率可以有上升和下降的空间,便于实验观察,因而我们选取3 μg/ml作为我们研究的顺铂浓度。
目前有研究显示耐药的前列腺癌细胞中可装载与耐药相关的信息,并且这些信息可以通过exosomes传递至非耐药细胞中引起受体细胞敏感性降低[14]。exosomes可能通过介导miRNAs和mRNAs的传递影响A549细胞间的信息交流,从而改变受体细胞对药物的敏感性[15]。本研究认为在顺铂处理过程中肺癌细胞分泌的exosomes可装载相关信息并将这些信息传递至其他同源细胞,从而降低细胞对顺铂的敏感性。当然,这种对于exosomes引起细胞对药物敏感性的解释只是其中的一种,还有研究认为耐药的卵巢癌细胞可通过囊泡排出更多的顺铂从而降低细胞对顺铂的敏感性[16],可能2种机制都参与了该药物敏感性调节过程。
通过我们的研究发现,肺癌细胞在受到顺铂处理后可以向周围微环境中分泌exosomes,而这些exosomes进入受体肺癌细胞后能够降低受体细胞对顺铂的敏感性,因此,是否可以通过阻断此过程中exosomes的分泌和传递来减弱在顺铂治疗肺癌中产生敏感性降低的现象,这为深入研究肺癌细胞对顺铂敏感性的调节机制提供了一种新的思路。在未来非小细胞肺癌的治疗中,针对exosomes的抑制剂与其他化疗药物的联合治疗可能成为研究的趋势,这作为一种新的治疗策略值得进一步的研究。
[1]Ishida S,Lee J,Thiele DJ,et al.Uptake of the anticancer drug cisplatin mediated by the copper transporter Ctr1 in yeast and mammals[J].Proc Natl Acad Sci U S A,2002,99(22):14298-14302.
[2]Liedert B,Materna V,Schadendorf D,et al.Overexpression of cMOAT(MRP2/ABCC2)is associated with decreased formation of platinum-DNA adducts and decreased G2-arrest in melanoma cells resistant to cisplatin[J].J Invest Dermatol,2003,121(1):172-176.
[3]Komatsu M,Sumizawa T,Mutoh M,et al.Copper-transporting P-type adenosine triphosphatase(ATP7B)is associated with cisplatin resistance[J].Cancer Res,2000,60(5):1312-1316.
[4]Brozovic A,Fritz G,Christmann M,et al.Long-term activation of SAPK/JNK,p38 kinase and fas-L expression by cisplatin is attenuated in human carcinoma cells that acquired drug resistance[J].Int J Cancer,2004,112(6):974-985.
[5]Galluzzi L,Senovilla L,Vitale I,et al.Molecular mechanisms of cisplatin resistance[J].Oncogene,2012,31(15):1869-1883.
[6]Mathivanan S,Ji H,Simpson RJ.Exosomes:extracellular organelles important in intercellular communication[J].J Proteomics,2010,73(10):1907-1920.
[7]Keller S,Sanderson MP,Stoeck A,et al.Exosomes:from biogenesis and secretion to biological function[J].Immunol Lett,2006,107(2):102-108.
[8]Valadi H,Ekstrom K,Bossios A,et al.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J].Nat Cell Biol,2007,9(6):654-659.
[9]Katakowski M,Buller B,Zheng X,et al.Exosomes from marrow stromal cells expressing miR-146b inhibit glioma growth[J].Cancer Lett,2013,335(1):201-204.
[10]Xin H,Li Y,Buller B,et al.Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth[J].Stem Cells,2012,30(7):1556-1564.
[11]Liu WM,Dennis JL,Gravett AM,et al.Supernatants derived from chemotherapy-treated cancer cell lines can modify angiogenesis[J].Br J Cancer,2012,106(5):896-903.
[12]Nangami GN,Watson K,Parker-Johnson K,et al.Fetuin-A(alpha2HS-glycoprotein)is a serum chemo-attractant that also promotes invasion of tumor cells through Matrigel[J].Biochem Biophys Res Commun,2013,438(4):660-665.
[13]Rana S,Malinowska K,Zoller M.Exosomal tumor microRNA modulates premetastatic organ cells[J].Neoplasia,2013,15(3):281-295.
[14]Corcoran C,Rani S,O'Brien K,et al.Docetaxel-resistance in prostate cancer:evaluating associated phenotypic changes and potential for resistance transfer via exosomes[J].PLoS One,2012,7(12):e50999.
[15]Xiao X,Yu S,Li S,et al.Exosomes:decreased sensitivity of lung cancer a549 cells to cisplatin[J].PLoS One,2014,9(2):e89534.
[16]Safaei R,Larson BJ,Cheng TC,et al.Abnormal lysosomal trafficking and enhanced exosomal export of cisplatin in drugresistant human ovarian carcinoma cells[J].Mol Cancer Ther,2005,4(10):1595-1604.
