斑点追踪显像评价房间隔缺损封堵前后右心室功能
2014-02-08杨性安丁晓明
杨性安,王 刚,丁晓明,朱 佳
由于右心室复杂的几何构型,在定量评价其功能时仍面临着许多挑战,即使实时三维超声心动图仍由于很难获取清晰的图像而不能广泛应用[1],目前能应用于右心室功能定量评价的工具主要是组织多普勒技术和斑点追踪显像(speckle tracking imaging,STI)[2-4],但后者由于克服了组织多普勒技术具有角度依赖性的缺点而更具应用价值,本研究旨在利用STI评价房间隔缺损(atrial septal defect,ASD)患者在封堵前后右心室功能的变化。
1 资料与方法
1.1 病例入选标准 (1)继发孔型ASD,5 mm≤缺损直径≤36 mm,伴右心容量负荷增加,左向右分流;(2)缺损边缘至冠状静脉窦,上、下腔静脉及肺静脉距离≥5 mm,至房室瓣≥7 mm;(3)不合并必须外科手术的其他心脏畸形。

Table 1 Comparison of right ventricular parameter among control group,ASD group before and after percutaneous closure

组别例数RVEDD(mm)LVEDD(mm)RVFAC(%)TAPSE(mm)对照组5725.24±4.01 51.36±5.02 51.56±10.77 23.15±5.05 ASD组封堵前5735.11±8.32*△44.22±7.07*△58.38±9.98*△32.04±4.25*△ASD组封堵后5729.14±5.61* 49.05±5.11* 52.36±7.55 24.59±6.92 F值36.0122.448.7042.52P值<0.01<0.01<0.01<0.01
注:RVEDD=右室舒张末期内径,LVEDD=左室舒张末期内径,RVFAC=右室面积变化分数,TAPSE=右房室瓣环收缩期位移;与对照组比较,*P<0.05;与ASD组封堵后比较,△P<0.05

表2 对照组、ASD组封堵前后右心室各节段PSLS比较
注:与对照组比较,*P<0.05;与ASD组封堵后比较,△P<0.05
1.2 临床资料 选择2008年1月—2012年11月浙江省台州医院心内科封堵治疗成功、超声二维图像质量良好的ASD患者57例为研究对象,其中男25例,女32例;年龄16~67岁,平均(42.5±14.0)岁。另选择同时期与ASD患者年龄、性别匹配的体检健康者57例为对照组,其中男25例,女32例;年龄18~65岁,平均(41.3±13.7)岁。体格检查、生化指标、胸部X线片、心电图、超声心动图检查均正常。
1.3 仪器和方法 GE公司生产的Vivid7彩色多普勒超声成像仪,M3S探头,频率1.7~3.4 MHz。EchoPAC 8.0版超声工作站。受检者左侧卧位,连接心电图,调节帧频60~90帧/s,于呼气末屏气,获取标准心尖四腔切面三个连续心动周期的动态图像,刻录光盘后行脱机分析。
1.4 数据分析 将原始数据导入EchoPAC工作站,一般超声指标测量:测量右室舒张末期内径(RVEDD)、左室舒张末期内径(LVEDD)、右室面积变化分数(RVFAC),测量右房室瓣环收缩期位移(TAPSE),肺动脉收缩压估测根据下腔静脉内径及塌陷率来计算[5]。STI指标测量:先测量肺动脉开放及关闭时的时间,然后进入STI成像模式,将二维图像停帧于心内膜显示最清晰的收缩期末,手动仔细勾画右心室心内膜边界后,系统自动对心肌内的斑点进行追踪,随时调整感兴趣区宽度,使其包纳心肌全层。追踪结束后系统将自动给出右心室游离壁和室间隔基底段、中间段、心尖段6个节段收缩期峰值纵向应变(peak systolic longitudinal strain,PSLS)。ASD患者检查时间为封堵前1周内和封堵3个月后,封堵后预后不佳评估标准为至少符合以下条件中的一项:(1)NYHA心功能等级≥Ⅱ级;(2)肺动脉高压〔肺动脉收缩压≥40 mm Hg(1 mm Hg=0.133 kPa)〕。

2 结果
2.1 对照组、ASD组封堵前后右心室超声指标比较 ASD组封堵前与ASD组封堵后和对照组比较,RVEDD、RVFAC、TAPSE增大,LVEDD减小,差异有统计学意义(P<0.05);ASD组封堵后与对照组比较,RVEDD增大,LVEDD减小,差异有统计学意义(P<0.05,见表1)。
2.2 对照组、ASD组封堵前后右心室各节段PSLS比较 ASD组封堵前较ASD组封堵后和对照组右心室游离壁基底段、游离壁中间段、游离壁心尖段、室间隔心尖段及右心室整体PSLS增大,差异有统计学意义(P<0.05,见表2,见图1~3)。
2.3 以右心室游离壁心尖段PSLS预测ASD组封堵后预后的ROC曲线 57例ASD患者成功封堵3个月后评估心功能仍有7例NYHA心功能等级≥Ⅱ级,4例存在肺动脉高压,5例心功能≥Ⅱ级且合并肺动脉高压,以右心室游离壁心尖段PSLS预测ASD组封堵后预后的最佳截断值为-22.3%,敏感度为82.9%,特异度为75.0%(见图4)。
3 讨论
在存在心内分流或其他右心室疾病的患者中,定量评价右心室的功能对诊断是有帮助的,传统评价右心室功能的指标如RVFAC、TAPSE、心肌作功指数等可作为参考指标,但仍存在许多缺陷[6-7]。STI是新发展的一项新工具,可以对右心室局部心肌功能做出定量评价。
本研究结果显示ASD组封堵前较ASD组封堵后及对照组LVEDD减小,RVEDD、RVFAC、TAPSE增大,这与ASD患者容量负荷增大,右心室扩大,右心室心肌初长度增加,收缩力量增强有关,但是随着肺动脉压力的不断升高,右心室收缩力量反而会下降[8],由于本组大部分ASD患者肺动脉压力正常或仅轻微升高,还是以右心室收缩力量增强为主,故仍能对上述现象做出合理解释。左心室受到右心室的压迫变小,ASD组封堵后与对照组比较,RVEDD增大,LVEDD变小,可能与部分心肌发生不可逆性重构,心腔大小无法完全恢复至正常大小有关。
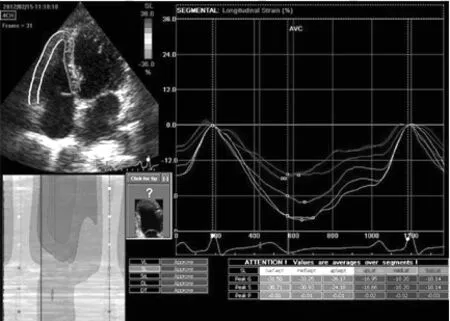
图1 对照组右心室各节段PSLS
Figure 1 PSLS in each segment of right ventricle in control group
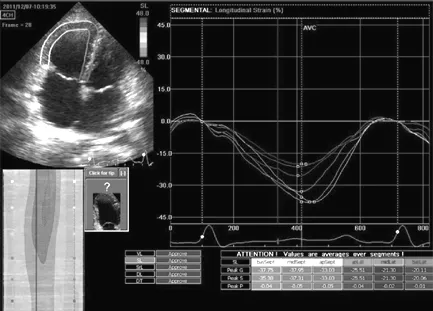
图2 ASD组封堵前右心室各节段PSLS
Figure 2 PSLS in each segment of right ventricle in ASD group before percutaneous closure
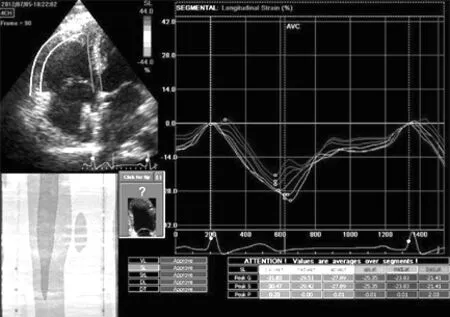
图3 ASD组封堵3个月后右心室各节段PSLS
Figure 3 PSLS in each segment of right ventricle in ASD group 3 months after percutaneous closure
右心室心肌在ASD封堵后第1个月就发生重构,封堵后3个月可能有足够时间使右心室心肌完成重构[9]。ASD组封堵前与对照组比较发现,ASD患者右心室游离壁基底段、中间段、心尖段、室间隔心尖段及右心室整体PSLS较对照组增大,而在封堵3个月后这些指标均得到恢复,其发生的机制为:由于ASD左向右大量的血液分流,使右心室容量明显增大,右心室扩大,心肌初长度增大,在肺动脉压力正常的情况下,通过Frank-Starling机制调节,心肌的收缩力增强,随着病情的进展,肺动脉压力逐渐升高,右心室心肌除了受容量负荷作用外,还受到压力负荷的左右,压力负荷使右心室心肌的张力增加,收缩力量减弱,当其减弱的效果超过Frank-Starling机制调节作用时,其收缩力量就会减弱,在封堵3个月后,右心室容量负荷减小,心肌初长度恢复至正常状态,肺动脉压力也降低,故心肌收缩力也得到了恢复。本研究结果与陈纪昀等[4]研究结果存在着矛盾,其原因是本研究大部分ASD患者肺动脉压力正常或仅轻微升高,而陈纪昀等[4]研究对象是ASD伴肺动脉高压,通过上述的发生机制可以合理地解释本研究的结果。仔细分析右心室各节段及整体的PSLS在封堵前后的变化情况,发现右心室游离壁中间段和心尖段变化较大,尤其是游离壁心尖段的PSLS变化最大,故研究中提出以右心室游离壁心尖段PSLS作为预测ASD组封堵后疗效的指标,这与以往的研究仅对ASD封堵前后的功能做出评估[2-4,6-9],而不能对ASD封堵后的疗效做出预测不同。本研究以封堵后满足以下之一:(1)NYHA心功能等级≥Ⅱ级;(2)肺动脉高压作为封堵后预后较差的评估标准,通过ROC曲线分析得出以右心室游离壁心尖段PSLS预测封堵治疗效果不佳的最佳截断值为-22.3%,敏感度为82.9%,特异度为75.0%。这对指导评估ASD组封堵治疗预后具有重要的意义。
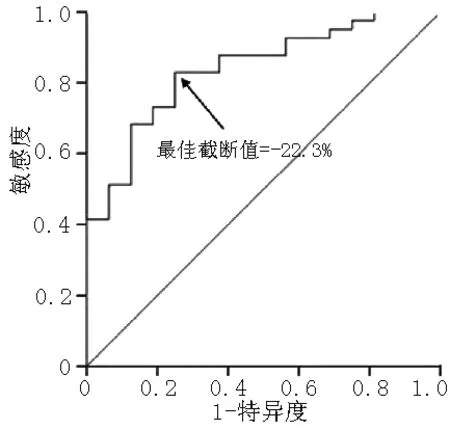
图4 以右心室游离壁心尖段PSLS预测ASD组封堵后预后的ROC曲线
Figure 4 ROC curve for PSLS at apical free wall site to predict unfavorable outcome of ASD group after percutaneous closure
总之,STI技术是可以评价右心室心肌局部和整体功能的一种有力工具,右心室游离壁心尖段PSLS可以作为预测ASD封堵后预后的较好指标。不足之处:ASD仍然依靠清晰的二维图像质量,研究中没有对不同肺动脉压力情况下的右心室功能作进一步研究,同样其左心室功能也没有作进一步研究,这是今后需要进一步做的工作。
1 朱伟红,张瑾,童锴等.实时一个心动全容积三维超声心动图对正常人群右心室功能的评估[J].中华心血管病杂志,2012,40(8):702-705.
2 Van De Bruaene A,Buys R,Vanhees L,et al.Regional right ventricular deformation in patients with open and closed atrial septal defect[J].Eur J Echocardiogr,2011,12 (3):206-213.
3 Bussadori C,Oliveira P,Arcidiacono C,et al.Right and left ventricular strain and strain rate in young adults before and after percutaneous atrial septal defect closure[J].Echocardiography,2011,28 (7):730-737.4 陈纪昀,袁建军,朱好辉,等.二维斑点追踪技术评价房间隔缺损伴肺动脉高压患者封堵术后的右室功能变化[J].中国临床医学影像杂志,2012,23(6):389-392.5 Rudski LG,Lai WW,Afilalo J,et al.Guidelines for the echocardiographic assessment of the right heart in adults:a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography,a registered branch of the European Society of Cardiology,and the Canadian Society of Echocardiography[J].J Am Soc Echocardiogr,2010,23(7):685-713.
6 徐丽芳,吴棘,郭盛兰,等.右室Tei指数对伴肺动脉高压房间隔缺损患者右心室功能的研究[J].中国超声医学杂志,2010,26(11):998-1000.
7 Giusca S,Dambrauskaite V,Scheurwegs C,et al.Deformation imaging describes right ventricular function better than longitudinal displacement of the tricuspid ring[J].Heart,2010,96(4):281-288.
8 连溯,郭盛兰,覃诗耘,等.实时三维超声心动图对房间隔缺损在不同肺动脉收缩压下右室功能的研究[J].中国超声医学杂志,2012,28(4):330-333.
9 Kaya MG,Baykan A,Dogan A,et al.Intermediate-term effects of transcatheter secundum atrial septal defect closure on cardiac remodeling in children and adults[J].Pediatr Cardiol,2010,31(4):474-482.
