磁共振弥散加权成像对肝硬化背景下小肝癌的诊断价值研究
2014-02-08熊瑜琦
熊瑜琦,李 镝,康 宁,乔 梁
临床上,肝癌是最常见的恶性肿瘤之一,全世界每年约有60万人死于原发性肝癌(hepatic cell carcinoma,HCC),位居所有恶性肿瘤死亡原因的第3位[1-3]。近年来,肝癌的发生率和死亡率呈逐年上升趋势,严重威胁着人类的生命健康,故肝癌的早期诊断和治疗对于改善患者预后具有重要临床意义[4-6]。在我国,约有3 000万病毒性肝炎患者,其中主要为乙型肝炎和丙型肝炎,慢性病毒性肝炎可逐渐演变为肝硬化,而其中约90%的肝硬化患者晚期可合并肝癌[7-8]。典型肝硬化背景下的癌性结节在常规磁共振(MR)平扫及动态增强扫描诊断中的准确率较高,但对于不典型或直径<2 cm的癌性结节,常规影像学手段较难准确诊断,常被误诊为肝内良性增生结节[9-10]。因此,目前临床迫切需要一种客观、可靠、创伤小的影像诊断技术以鉴别良恶性肝内小结节。本研究对我院收治的68例怀疑伴有癌性小结节(直径 < 2 cm)的肝硬化患者分别采用常规MR平扫及动态增强扫描和磁共振弥散加权成像(MRDWI)扫描,比较两种方法对肝硬化背景下小肝癌的诊断效能差异,以期为肝硬化背景下小肝癌的早期诊断、治疗和预后判定提供新的理论依据。
1 对象与方法
1.1 研究对象 选择2008年1月—2012年10月我院收治的怀疑伴有癌性小结节的肝硬化患者68例为研究对象,其中男48例、女20例,平均年龄(59.7±6.4)岁。68例患者共有93个肝内小结节,平均直径(1.37 ± 0.51 )cm,其中病灶直径<1.0 cm 的21个,1.1~1.5 cm 的35个,1.6~2.0 cm 的37个。患者临床病史、实验室和影像学检查资料均完整;所有病灶分别采用常规MR平扫及动态增强扫描和MRDWI(弥散敏感系数b值分别取50、400、800 s/mm2)进行扫描,以病理组织学活检结果作为金标准。
1.2 检查方法 检查均采用Philips Intera 1.5T超导型MR扫描仪,应用体部表面相控阵线圈。患者检查前需空腹,禁饮食。所有患者常规接受肝脏横轴位T1加权成像(T1 weighted imaging,T1WI)、T2加权成像(T2 weighted imaging,T2WI)、 T2脂肪抑制成像(T2/spectral saturation inversion recovery,T2/SPIR)、冠状面平扫及增强扫描。扫描前先用并行采集技术(array spatial sensitivity encoding technique,ASSET)测试,T1WI:重复时间(repetition time,TR)/回波时间(echo time,TE)160 ms/2.6~3.0 ms,层厚5.0 mm,间隔2.0 mm,层数10~20,视野范围(FOV) 36 cm×27 cm,矩阵288×192,1次采集,扫描时屏气约12 s;T2WI均采用快速自旋回波加脂肪抑制序列,呼吸触发技术:TR/TE 6 000 ms/90 ms,层厚5.0 mm,间隔2.0 mm,层数10~18,FOV 36 cm×27 cm,矩阵384×192,4次采集,扫描时屏气10~15 s。然后采用单次激发平面回波成像序列(single shot echo planar imaging,EPI)进行MRDWI扫描,加脂肪抑制以去除化学位移伪影,肝脏横轴位成像:TR/TE 2 236~7 216 ms /79 ms,TR随b值相应调整,在Z轴方向施加弥散敏感梯度磁场,取3个b值,分别为50、400、800 s/mm2,于吸气末屏气,一次屏气可获得多层图像,层厚6 mm,反转角为90°,间距0.6~1.8 mm,矩阵192×115,激发次数2次,视野 300~400 mm。应用Philips Intera 1.5T超导型MR扫描仪固有软件,通过不同b值的弥散加权图像拟合出表观弥散系数(apparent diffusion coefficient,ADC)图像,依据T2WI序列病变部位选择病灶最大层面上的3个感兴趣区,分别测量同一层面的同一位置病变的不同b值的信号强度,按照公式:ADC=(InS1/S2)/(b2 - b1)计算出ADC值,其中S1与S2分别为弥散敏感系数b1与b2值成像所测得信号强度值[5]。肝硬化病灶和小肝癌病灶ADC值均较正常肝组织低,如ADC值低于1.0×10-3mm2/s则考虑肝癌的可能性大。
1.3 诊断标准 常规MR平扫及动态增强扫描和MRDWI图像均由两位具有10年以上工作经验的影像科医师结合患者病史、其他影像学检查和病理结果进行分析和诊断。图像观察主要从瘤灶T1WI和T2WI信号,有无包膜、出血、坏死、脂肪变,强化方式、MRDWI信号及瘤灶背景的肝实质情况等方面进行分析。若肿瘤病灶直径较大,T1WI呈高信号、T2WI呈等信号且MRDWI呈等信号,增强扫描动脉期血液供应较少或延迟期呈等/高信号,ADC值低于1.0×10-3mm2/s,并伴有脂肪变性、包膜形成时,考虑小肝癌的可能性较大。
1.4 统计学方法 数据均采用SPSS 17.0统计软件进行分析,绘制受试者工作特征曲线(ROC曲线),比较常规MR和MRDWI诊断肝硬化背景下小肝癌的ROC曲线下面积(AUC),计算AUC的标准误并采用Z检验进行比较;计算两者敏感度、特异度及准确度以评价诊断效能差异;两位影像诊断医师分别对常规MR和MRDWI诊断肝硬化背景下小肝癌的差异性评价用Kappa一致性检验,Kappa值 ≤ 0.20提示一致性差,Kappa值在0.21~0.40为一致性中等,Kappa值在0.41~0.60为一致性良好,Kappa值 ≥ 0.61一致性极佳[11]。检验均为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 本组93个肝内小结节中69个(74.2%)肝内小结节被病理证实为肝癌结节,其他24个(25.8%)肝内小结节为良性结节。69个肝癌结节来自于55例患者,其中40个(58.0%)为高分化、24个(34.8%)为中分化、5个(7.2%)为低分化(见图1)。93个肝内小结节的病理组织学结果见表1。当弥散敏感系数取b=50 s/mm2时,图像信噪比高,但所得ADC值偏离真实值较大;若取b=800 s/mm2时,ADC值最接近真实值,但所得图像信噪比低;当b=400 s/mm2时,所得图像的信噪比及ADC值均可达到诊断要求,故取b=400 s/mm2弥散系数图进行分析。
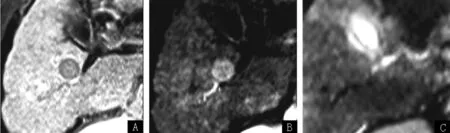
注:A为常规MR平扫图,B为MR动态增强扫描图,C为MRDWI扫描图
图1 1例62岁肝硬化合并小肝癌(直径1.8 cm)患者的影像学资料
Figure 1 MR imagings of one 62-year-old cirrhotic patients with small hepatocellular carcinomas (diameter 1.8 cm)
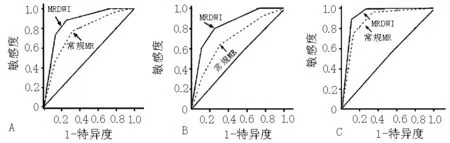
注:A为所有小肝癌结节的ROC曲线,B为高分化小肝癌结节的ROC曲线,C为中、低分化小肝癌结节的ROC曲线;MR=磁共振,MRDWI=磁共振弥散加权成像
图2 常规MR和MRDWI诊断肝硬化背景下小肝癌的ROC曲线
Figure 2 ROC curve of conventional MR and MRDWI in identifying small hepatocellular carcinomas among patients with cirrhosis
表1 93个肝内小结节的病理组织学结果 〔n(%)〕
Table 1 Histopathology results of 93 small hepatic nodules
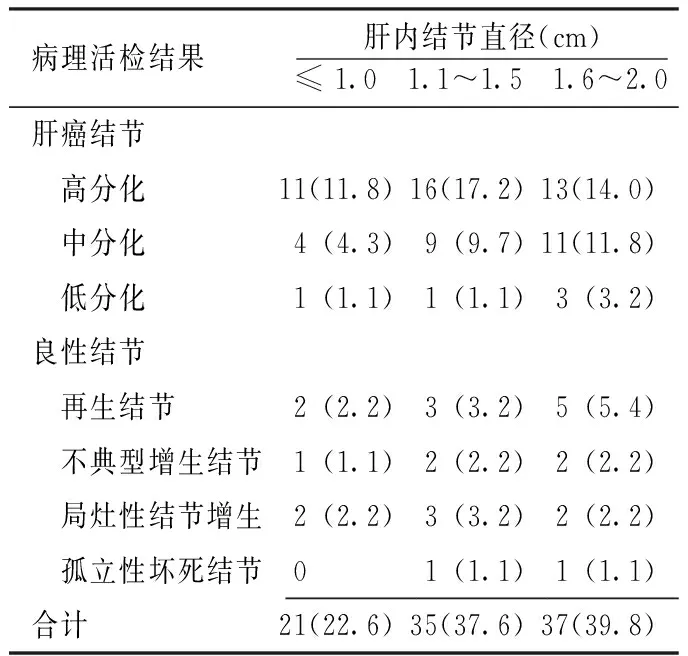
病理活检结果肝内结节直径(cm)≤1.0 1.1~1.5 1.6~2.0肝癌结节 高分化11(11.8)16(17.2)13(14.0) 中分化4(4.3)9(9.7)11(11.8) 低分化1(1.1)1(1.1)3(3.2)良性结节 再生结节2(2.2)3(3.2)5(5.4) 不典型增生结节1(1.1)2(2.2)2(2.2) 局灶性结节增生2(2.2)3(3.2)2(2.2) 孤立性坏死结节0 1(1.1)1(1.1)合计21(22.6)35(37.6)37(39.8)
2.2 常规MR和MRDWI对肝硬化背景下小肝癌的诊断价值 常规MR诊断肝硬化背景下小肝癌的敏感度为75.4%(52/69),特异度为62.5%(15/24),准确度为72.0%(67/93);MRDWI诊断肝硬化背景下小肝癌的敏感度为88.4%(61/69),特异度为83.3%(20/24),准确度为87.1%(81/93,见表2)。常规MR和MRDWI诊断肝硬化背景下小肝癌的ROC曲线结果示,MRDWI诊断肝硬化背景下小肝癌的AUC=0.87大于常规MR(AUC=0.73),两者差异有统计学意义(Z=1.89,P=0.029,见图2-A)。根据病理分化程度进行亚组分析发现,MRDWI诊断高分化小肝癌的AUC=0.82亦大于常规MR(AUC=0.67),差异有统计学意义(Z=2.74,P=0.003,见图2-B);但两种技术诊断中、低分化小肝癌的AUC差异无统计学意义(Z=0.29,P=0.391,见图2-C)。Kappa一致性检验结果表明两位医师对常规MR和MRDWI图像的诊断一致性较高,Kappa值分别为0.77和0.86,说明本研究数据可靠性较高。
表2 常规MR和MRDWI诊断肝硬化背景下小肝癌的四格表
Table 2 Fourfold table of conventional MR and MRDWI in identifying small hepatocellular carcinomas among patients with cirrhosis
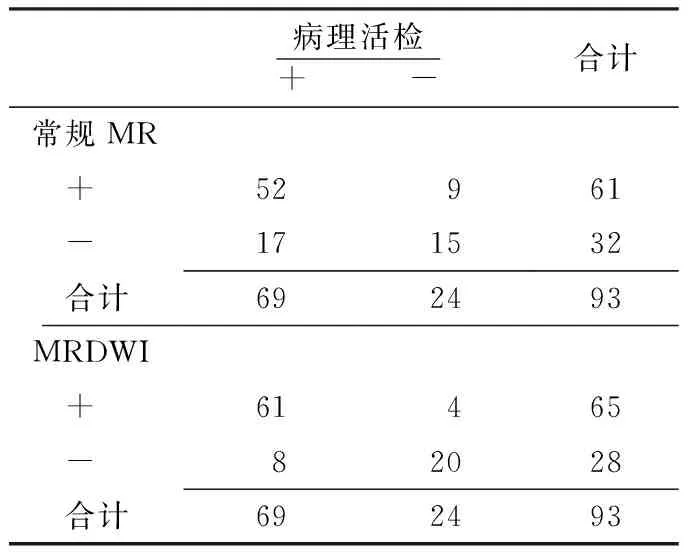
病理活检+ -合计常规MR +52 9 61 -171532 合计692493MRDWI +61 4 65 - 8 2028 合计692493
注:MR=磁共振,MRDWI=磁共振弥散加权成像
3 讨论
临床上,对于肝脏微小占位性病灶的诊断主要依靠CT、磁共振成像(MRI)、超声造影和血管造影等手段,但肝硬化背景下小肝癌常规检查手段成像不典型,早期诊断较困难,易出现漏诊和误诊的情况[12-14]。随着医学影像技术的逐渐成熟,肝硬化背景下小肝癌的诊断已引起临床的高度重视[15]。MRDWI是一种可以从分子水平反映人体组织结构和功能的影像学技术,其可较好地显示肝脏病变的形态学特征,并通过信号特征来判断病变性质[16-17]。研究发现,MRDWI中组织间ADC值的差异取决于细胞内外平衡及细胞结构的改变[18],而肿瘤引起分子弥散运动受限要早于组织内水分的增加,故MRDWI可在早期准确地检测出肝脏内小的肿瘤病灶如肝硬化合并小肝癌等,弥补了常规CT、MR平扫及动态增强扫描不能显示的乏血管肿瘤(指肿瘤组织内微血管较少,组织内呈缺氧状态,生长缓慢,且对放化疗不敏感的一类肿瘤)和T2WI无法显示的低信号病变[19]。目前,MRDWI已成为腹部MRI检查中至关重要的功能成像技术,其可作为肝硬化背景下小肝癌的首选检查手段[20]。
本研究对68例怀疑伴有癌性小结节的肝硬化患者的93个肝内小结节进行了常规MR平扫及动态增强扫描和MRDWI扫描。研究结果发现,肝硬化背景下小肝癌的MRDWI图像呈等信号,ADC值大多数<1.0×10-3mm2/s;而肝硬化病灶ADC值虽低于正常肝组织,但通常>1.0×10-3mm2/s。常规MR扫描T2WI是目前公认显示肝脏良性病灶最敏感的序列[16],呈特异的中等或高信号,但有些癌性结节在T2WI上也可呈中等或高信号,造成良、恶性结节鉴别困难的情况,故根据常规MR平扫及动态增强扫描鉴别良、恶性肝内结节的准确度较低。本研究还发现,MRDWI诊断肝硬化背景下小肝癌的敏感度、特异度和准确度分别为88.4%、83.3%、87.1%优于常规MR的75.4%、62.5%、72.0%;此外,MRDWI诊断肝硬化背景下小肝癌的AUC明显大于常规MR,尤其对于高分化小肝癌;并且Kappa一致性检验结果表明对常规MR和MRDWI图像的诊断两位医师的一致性较高,提示MRDWI可较好地区别良、恶性肝内小结节,是诊断肝硬化背景下小肝癌的良好工具。
本研究尚存在一定的局限性。首先,由于样本量有限,且非癌性结节的比例过低,故本研究结果仍可能存在一定的选择偏移。其次,尽管本研究设计严格,但由于观察者可能受到环境因素、心理因素、身体因素、理论和临床经验等因素的影响,导致诊断结果存在偏移。再者,由于研究对象临床资料及样本量有限,本研究未能针对肿瘤大小、病理类型、肝内结节形态等进行亚组分析,使本研究结果临床应用价值受到限制。因此,进一步扩大研究样本量,探讨其他因素对MRDWI诊断肝硬化背景下小肝癌的效能,对于指导临床早期诊断和治疗小肝癌有重要的价值。
综上所述,MRDWI对肝硬化背景下小肝癌的诊断效能优于常规MR平扫及动态增强扫描,其可作为早期诊断肝硬化背景下小肝癌的首选检查手段。但由于本研究样本量较少,尚需进行大样本高质量的临床研究,以期为临床早期诊断和治疗提供理论参考依据。
1 Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2): 69-90.
2 林莉,林美玲.联合检测血清中ADA、GGT和AFU对肝癌患者诊断的临床意义[J].海南医学院学报,2011,17(3):328-329.
3 朱石柱,黄丽雪,吴俊峰,等.CT灌注成像在原发性肝癌中的临床应用[J].疑难病杂志,2012,11(2):112.
4 Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1): 10-29.
5 刘保魁,杨玉秀,韩双印,等.血浆硫氧还蛋白对肝癌的诊断价值研究[J].中国全科医学,2013,16(5):1578.
6 陶立玉.肿瘤标记物联合检测诊断肝癌的临床价值研究[J].实用心脑肺血管病杂志,2012,20(7):1114.
7 庄辉.病毒性肝炎的流行病学[J].中国计划免疫,2004,10(3): 180-181.
8 甘雨.青少年原发性肝癌与乙型及丙型肝炎病毒感染的关系分析[J].中国全科医学,2012,15(1):170.
9 马丽君,陈青锋.慢性病毒性肝炎肝纤维化无创诊断方法的研究进展[J].实用医学杂志,2011,27(10): 1719-1721.
10 黄泽光,谢长浓,吴永峻.MR弥散加权成像诊断肝硬化不典型癌变结节[J].中国医学影像技术,2010,26(4):701-704.
11 Nasu K,Kuroki Y,Sekiguchi R,et al.Measurement of the apparent diffusion coefficient in the liver: is it a reliable index for hepatic disease diagnosis?[J].Radiation medicine,2006,24(6): 438-444.
12 Viera AJ,Garrett JM.Understanding interobserver agreement: the kappa statistic[J].Fam Med,2005,37(5): 360-363.
13 李晓娟,刘志兰,何冰峰.磁共振扩散加权成像在肝脏占位性病变诊断中的应用[J].实用放射学杂志,2006,22(7): 814-816.
14 何兰芳,刘燕娜.超声造影在肝癌介入诊疗中的应用现状及研究进展[J].中国全科医学,2013,16(7):2427.
15 刘玉江,胡向东,钱林学,等.肝硬化增生结节和小肝癌的超声造影特征研究[J].中华临床医师杂志:电子版,2010,4(7):1086-1089.
16 钱林学,刘玉江,丁惠国.小肝癌的影像学诊断进展[J].世界华人消化杂志,2010,18(5): 479-486.
17 孙希杰,许乙凯,全显跃.分子水平磁共振影像学的研究及进展[J].实用医学杂志,2005,21(19): 2216-2218.
18 赵庆雪,谷艳英.MR弥散张量成像技术及其临床应用[J].吉林医学,2008,29(21):1962-1964.
19 黄志成,韩雪立,李鸿鹏,等.应用 MR 弥散加权成像检测肝脏小病灶的临床研究[J].中国老年学杂志,2009,29(8): 994-996.
20 曾利川,杜勇,杨汉丰,等.磁共振全身弥散加权成像在肿瘤中的应用及技术进展[J].中华临床医师杂志:电子版,2012,6(23):7695-7697.
